





第07讲 氧化还原反应(课件)-2024年高考化学一轮复习讲练测(新教材新高考)
展开
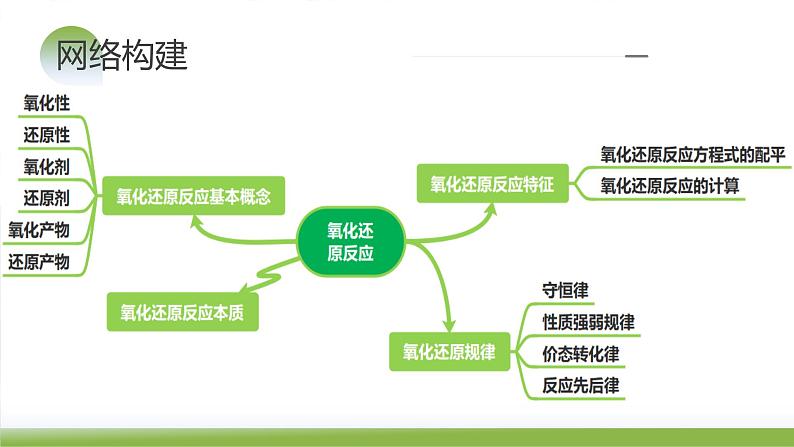
这是一份第07讲 氧化还原反应(课件)-2024年高考化学一轮复习讲练测(新教材新高考),共60页。PPT课件主要包含了复习目标,网络构建,知识梳理题型归纳,真题感悟,内容索引,考情分析,PARTONE等内容,欢迎下载使用。
知识梳理
题型归纳
考点要求考题统计考情分析物质的组成、性质、分类2023**卷**题,**分2022**卷**题,**分2021**卷**题,**分……传统文化中的性质与变化2023**卷**题,**分2022**卷**题,**分2021**卷**题,**分
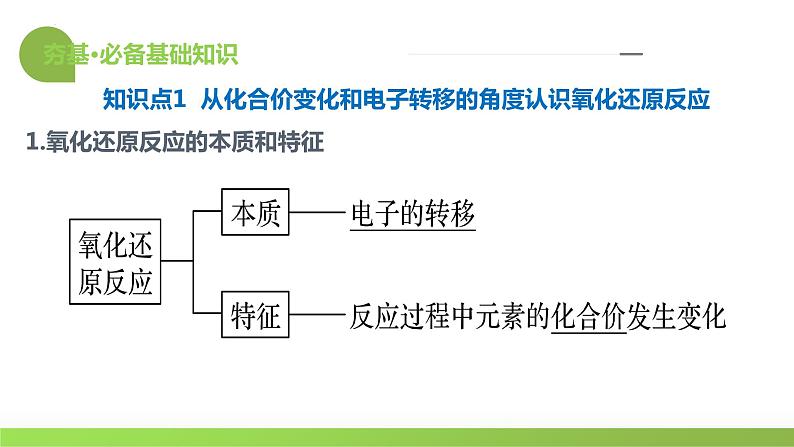
1.氧化还原反应的本质和特征
知识点1 从化合价变化和电子转移的角度认识氧化还原反应
2.基于双线桥理解氧化还原反应概念之间的关系
【名师总结】分析电子转移数目的关键——标出元素化合价
(1)基本方法:先标出熟悉元素的化合价,再根据化合物中正负化合价的代数和为零的原则求解其他元素的化合价。
(2)熟记常见元素的化合价:一价氢、钾、钠、氟、氯、溴、碘、银;二价氧、钙、钡、镁、锌;三铝、四硅、五价磷;说变价也不难,二三铁、二四碳、二四六硫都齐全;铜汞二价最常见。
(3)明确一些特殊物质中元素的化合价:
3.氧化还原反应的相关概念之间的关系
可概括为“氧、氧、得、降、还、还、还”。
4.电子转移的表示方法
请分别用单线桥法和双线桥法表示Cu与稀硝酸反应中电子转移的方向和数目:
(1)双线桥法:①标变价 ②画箭头(反应物指向生成物) ③算数目 ④说变化。
a.箭头指向反应前后有元素化合价变化的同种元素的原子,且需注明“得到”或“失去”。
b.箭头的方向不代表电子转移的方向,仅表示电子转移前后的变化。
c.失去电子的总数等于得到电子的总数。
(2)单线桥法:①标变价 ②画箭头(由失电子原子指向得电子原子) ③算数目(线桥上只标电子转移的总数目,不标“得”“失”字样)
a.箭头从失电子元素的原子指向得电子元素的原子。
b.不标“得到”或“失去”,只标明电子转移的总数。
c.线桥只出现在反应物中。
5.氧化还原反应与四种基本类型反应间的关系
(1)有单质参与的化合反应是氧化还原反应。
(2)有单质生成的分解反应是氧化还原反应。
(4)所有的置换反应都是氧化还原反应。
(5)所有的复分解反应都不是氧化还原反应。
知识点2 从元素价态和物质结构的角度认识氧化剂和还原剂
常见氧化剂包括某些非金属单质、含有高价态元素的化合物、过氧化物等。如:
(1)O2、O3在水溶液中的还原产物,其中酸性条件下是H2O,中性、碱性条件下是OH-;而当还原产物为固态时是O2-或O22-。
(2)浓硝酸的还原产物是NO2,稀HNO3的还原产物是NO。
常见还原剂包括活泼的金属单质、非金属阴离子及含低价态元素的化合物、低价金属阳离子、某些非金属单质及其氢化物等。如:
3.元素化合价处于中间价态的物质既有氧化性,又有还原性
其中:Fe2+、SO32-主要表现还原性,H2O2主要表现氧化性。
(1)根据化合价的高低可判断物质是否具有氧化性或还原性,但不能判断氧化性或还原性的强弱。元素处于最高价态时只有氧化性,但不一定有强氧化性,如Na+、SO42-;同理,元素处于最低价态时也不一定具有强还原性。
(2)非金属阴离子不一定只具有还原性,如O22-既有氧化性又有还原性。金属阳离子不一定只具有氧化性,如Fe2+既有还原性又有氧化性。
4.重要的还原剂——金属氢化物、NaBH4
电子式可表示为M+[:H]-(M为碱金属)。
a.遇水强烈反应放出氢气,使溶液呈强碱性,如:NaH+H2O=NaOH+H2↑
2)万能还原剂——硼氢化钠(NaBH4)
硼氢化钠是一种无机物,化学式为NaBH4,白色至灰白色细结晶粉末或块状,吸湿性强,其碱性溶液呈棕黄色,是最常用的还原剂之一。通常用作醛类、酮类、酰氯类的还原剂,塑料工业的发泡剂,造纸漂白剂,以及医药工业制造双氢链霉素的氢化剂。
误区一:某元素由化合态变为游离态时,该元素不一定被还原,也不一定被氧化。因为元素处于化合态时,其化合价可能为正,也可能为负。若元素由负价变为0价,则其被氧化,若元素由正价变为0价,则其被还原。
知识3 氧化还原反应概念的“五个误区”
误区三:物质的氧化性或还原性的强弱取决于元素原子得失电子的难易程度,与得失电子数目的多少无关。
误区五:在氧化还原反应中,一种元素被氧化,不一定有另一种元素被还原,也可能是同一元素既被氧化又被还原。如:2Na2O2+2H2O=4NaOH+O2↑中,Na2O2既是氧化剂又是还原剂,氧元素一部分化合价升高,一部分化合价降低。
例1.(2023·全国·模拟预测)化学与生活息息相关。下列过程不涉及氧化还原反应的是A.热空气吹出法制溴B.海带中提取碘C.高铁酸盐处理水D.侯氏制碱法以氨制碱
考向1 考查氧化还原反应的判断
【变式训练】(2023·北京西城·统考二模)下列物质的用途,没有利用氧化还原反应的是A.用海水制取Br2B.用煤制甲醇C.用小苏打烘焙糕点D.用NaClO溶液对环境消毒
【思维建模】判断是否发生氧化还原反应的依据主要是看反应时各元素的化合价有无发生变化。
考向2 考查氧化还原反应基本概念
【思维建模】解决氧化还原反应概念的一般思路找变价、判类型、分升降、定其他。其中“找变价”是非常关键的一步,特别是不同反应物中含有同种元素的氧化还原反应,必须弄清元素化合价的变化情况。
考向3 考查氧化还原反应中电子转移的表示方法
1.氧化性是指物质得电子的性质(或能力);还原性是指物质失电子的性质(或能力)。
知识点1 氧化性、还原性的概念
2.氧化性、还原性的强弱取决于得、失电子的难易程度,与得、失电子数目的多少无关。如:Na-e-=Na+,Al-3e-=Al3+,但根据金属活动性顺序表,Na比Al活泼,更易失去电子,所以Na比Al的还原性强。
3.从元素的价态考虑:
最高价态——只有氧化性,如:Fe3+、H2SO4、KMnO4等;
最低价态——只有还原性,如:金属单质、Cl-、S2-等;
中间价态——既有氧化性又有还原性,如:Fe2+、S、Cl2等。
1.依据氧化还原反应方程式判断
知识点2 氧化性、还原性强弱的比较方法
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
口诀:比什么“性”找什么“剂”,“产物”之“性”小于“剂”。
2.依据反应条件及反应的剧烈程度判断
当不同的氧化剂(或还原剂)与同一还原剂(或氧化剂)反应时,反应越易进行,则对应的氧化剂(或还原剂)的氧化性(或还原性)越强,反之越弱。
氧化性:KMnO4>MnO2>O2
2Na+2H2O=2NaOH+H2↑
3.依据被氧化还原的程度判断
a.不同氧化剂作用于同一种还原剂,氧化产物价态高的其氧化性强。
b.不同还原剂作用于同一种氧化剂,还原产物价态低的其还原性强。例如:
a.根据元素周期表判断
b.根据金属活动顺序表
c.根据非金属活动性顺序表判断
a.原电池:一般情况下,两种不同的金属构成原电池的两极,其还原性:负极>正极。
b.电解池:用惰性电极电解混合溶液时,在阴极先放电的阳离子的氧化性较强,在阳极先放电的阴离子的还原性较强。
6.依据“三度”判断(“三度”即:浓度、温度、酸碱度)
a.浓度:同一种物质浓度越大,氧化性(或还原性)越强。如氧化性:浓H2SO4>稀H2SO4,浓HNO3>稀HNO3;还原性:浓盐酸>稀盐酸。
b.温度:同一种物质,温度越高其氧化性(或还原性)越强。如热的浓硫酸的氧化性比冷的浓硫酸的氧化性强。
c.酸碱度:同一种物质,所处环境酸(碱)性越强其氧化性(或还原性)越强。如KMnO4溶液的氧化性随溶液酸性的增强而增强。
考向1 考查氧化性、还原性强弱比较
【题后归纳】谨记常用的氧化性、还原性强弱顺序(1)氧化性:KMnO4>MnO2>Cl2>Br2>Fe3+>I2(2)还原性:S2->SO32-(SO2)>I->Fe2+>Br->Cl-
考向2 考查判断氧化还原反应是否发生
例2.(2022·日照模拟)已知C2O3在酸性溶液中易被还原成C2+,且还原性:I->Fe2+>Cl->C2+ 。下列反应在水溶液中不可能发生的是( )A.3Cl2+6FeI2=2FeCl3+4FeI3B.Cl2+FeI2=FeCl2+I2C.C2O3+6HCl=2CCl2+Cl2↑+3H2OD.2Fe3++2I-=2Fe2++I2
【变式训练】根据下列三个反应:(1)2Fe3++2I-=2Fe2++I2(2)2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O(3)2Fe2++Cl2=2Fe3++2Cl-若要从含有Cl-、I-、Fe2+的混合液中,只除去I-,而Fe2+和Cl-不被氧化,则应向混合溶液中加入( )A.KMnO4 B.Cl2 C.FeCl2 D.FeCl3
知识点1 守恒规律及其应用
氧化还原反应遵循以下三个守恒规律:
①质量守恒:反应前后元素的种类和质量不变。
②电子守恒:即氧化剂得电子的总数等于还原剂失电子的总数,这是配平氧化还原反应方程式的依据,也是有关氧化还原反应计算的依据。
③电荷守恒:离子方程式中,反应物中各离子的电荷总数与产物中各离子的电荷总数相等。书写氧化还原反应的离子方程式时要注意满足电荷守恒,如Fe3++Cu=Fe2++Cu2+(错误),2Fe3++Cu=2Fe2++Cu2+(正确)。
1.价态归中规律思维模型
知识点2 价态规律及其应用
含不同价态的同种元素的物质间发生氧化还原反应时,该元素价态的变化一定遵循“高价+低价―→中间价”,而不会出现交叉现象。简记为“两相靠,不相交”。
例如,不同价态硫之间可以发生的氧化还原反应是
注:不会出现⑤H2S和H2SO4反应中H2S转化为SO2而H2SO4转化为S的情况。
2.歧化反应规律思维模型
“中间价―→高价+低价”。
具有多种价态的元素(如氯、硫、氮和磷元素等)均可发生歧化反应,如:Cl2+2NaOH=NaCl+NaClO+H2O。
(1)判断同种元素不同价态物质间发生氧化还原反应的可能性,如浓H2SO4与SO2不发生反应。
(2)根据化合价判断反应体系中的氧化剂、还原剂及氧化产物、还原产物。如对于反应6HCl+NaClO3=NaCl+3Cl2↑+3H2O中,氧化剂为NaClO3,还原剂为HCl,氧化产物和还原产物都为Cl2。
知识点3 强弱规律及其应用
较强氧化性的氧化剂跟较强还原性的还原剂反应,生成较弱还原性的还原产物和较弱氧化性的氧化产物。一般越易失电子的物质,失电子后越难得电子,越易得电子的物质,得电子后越难失电子。
可以用来比较物质氧化性、还原性的强弱,判断反应进行的方向。
知识点4 先后规律及其应用
①可判断物质发生氧化还原反应的先后顺序
②判断某氧化还原反应中物质氧化性、还原性的相对强弱
③判断某氧化还原反应能否正常进行
氧化性:MnO4-(H+)>Cl2>Br2>Fe3+>I2>稀H2SO4>S
还原性:Mn2+
相关课件
这是一份第07讲 氧化还原反应(练习)-备战2024年高考化学一轮复习精品课件+讲义+练习(新教材新高考),文件包含第07讲氧化还原反应练习原卷版docx、第07讲氧化还原反应练习解析版docx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。
这是一份第07讲 氧化还原反应(课件)-备战2024年高考化学一轮复习精品课件+讲义+练习(新教材新高考),共60页。PPT课件主要包含了复习目标,网络构建,知识梳理题型归纳,真题感悟,内容索引,考情分析,PARTONE等内容,欢迎下载使用。
这是一份第07讲 氧化还原反应(讲义)-备战2024年高考化学一轮复习精品课件+讲义+练习(新教材新高考),文件包含第07讲氧化还原反应讲义原卷版docx、第07讲氧化还原反应讲义解析版docx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。









