





第01讲 物质的量 气体摩尔体积(课件)-2024年高考化学一轮复习讲练测(新教材新高考)
展开
这是一份第01讲 物质的量 气体摩尔体积(课件)-2024年高考化学一轮复习讲练测(新教材新高考),共38页。PPT课件主要包含了复习目标,网络构建,知识梳理题型归纳,真题感悟,内容索引,考情分析,PARTONE等内容,欢迎下载使用。
知识梳理
题型归纳
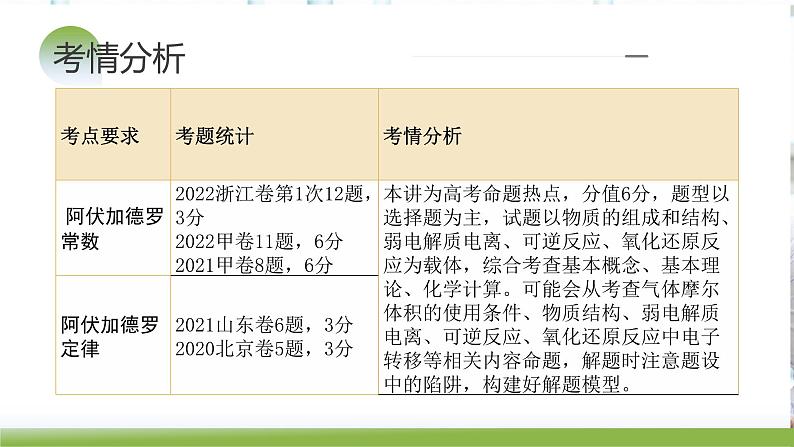
考点要求考题统计考情分析物质的组成、性质、分类2023**卷**题,**分2022**卷**题,**分2021**卷**题,**分……传统文化中的性质与变化2023**卷**题,**分2022**卷**题,**分2021**卷**题,**分
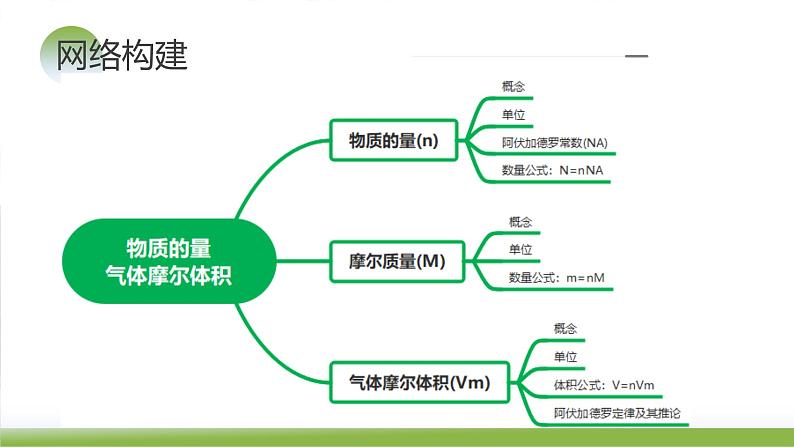
1.物质的量(n)表示含有一定数目粒子的集合体的物理量,单位为摩尔(ml)。
2.物质的量的规范表示方法:
知识点1 物质的量、阿伏加德罗常数
3.阿伏加德罗常数(NA)0.012 kg 12C中所含的碳原子数为阿伏加德罗常数,其数值约为6.02×1023,单位为ml-1。公式:NA=n(N)。
(1)物质的量只能衡量微观粒子,必须指明具体粒子的种类或化学式,故摩尔后面应为确切的微粒名称;如1 ml氢(不确切)和1 ml大米(宏观物质)皆为错误说法。(2)物质的量是物理量,摩尔是物质的量的单位,不是物理量。
(3)6.02×1023是个纯数值,没有任何物理意义,而阿伏加德罗常数(NA)是指1 ml任何微粒所含的粒子数,它与0.012 kg12C所含的碳原子数相同,数值约为6.02×1023。
1.定义:单位物质的量的物质所具有的质量。常用的单位是 g·ml-1。公式:M=m/n。
2.数值:以 g·ml-1为单位时,任何粒子的摩尔质量在数值上都等于该粒子的相对分子(原子)质量。
(2)对具体的物质,其摩尔质量是确定的,不随物质的量的多少而变化,也不随物质的聚集状态而变化。
(1)摩尔质量、相对原子(或分子)质量的含义不同,不是同一个物理量。二者单位也不同,摩尔质量的单位是g·ml-1或kg·ml-1,相对原子(或分子)质量的单位为1,当摩尔质量以g·ml-1为单位时,二者在数值上相等。
例1.(2022·上海青浦·一模)下列对摩尔(ml)的有关说法中错误的是A.摩尔是一个单位而非物理量B.摩尔既能用来计量纯净物,又能用来计量混合物C.1ml任何气体所含气体的分子数目都相等D.0.5ml氦约含有1.204×1024个电子
考向1 考查有关“物质的量”概念理解与辨析
【变式训练】下列有关叙述正确的是( )A.1 ml任何物质都含有6.02×1023个分子B.硫酸的摩尔质量为98 gC.2 ml H2O是1 ml H2O摩尔质量的2倍D.摩尔是物质的量的单位
【名师点睛】本考向考查的是物质中含有的各种粒子或微观结构的问题,一般来说先计算物质基本微粒中含有多少个需要计算的粒子或微观结构,再乘以该物质的物质的量,就可以计算出相应结果,稀有气体分子都是单原子分子。
例2.下列叙述正确的是( )A.24 g镁与27 g铝含有相同的质子数B.等质量的氧气和臭氧,电子数相同C.1 ml重水与1 ml水中,中子数比为2∶1D.1 ml乙烷和1 ml乙烯,化学键数目相同
考向2 物质的量、质量、微粒数之间的关系
【变式训练】(1)某氯原子的质量是a g,12C原子的质量是b g,用NA表示阿伏加德罗常数的值。①该氯原子的相对原子质量为________;②该氯原子的摩尔质量是________;③m g该氯原子的物质的量为________;④n g该氯原子所含的电子数为________。(2)12.4 g Na2R含Na+ 0.4 ml,则Na2R的摩尔质量为________,R的相对原子质量为________。含R的质量为1.6 g的Na2R,其物质的量为________。
【答案】(1)①b(12a) ②aNA g·ml-1③aNA(m) ml④a(17n)(2)62 g/ml 16 0.1 ml
【思维建模】由已知物理量求物质所含的粒子数目的思维模型
(记住特殊物质中1 ml物质所含微粒(分子、原子、电子、质子、中子等)的数目,如Ne、D2O、18O2、—OH、OH-等)
①粒子的大小(物质的本性);
知识点1 影响物质体积大小的因素
②粒子间距的大小(由温度与压强共同决定);
③粒子的数目(物质的量的大小)。
(1)含义:单位物质的量的气体所占的体积,符号为Vm,标准状况下,Vm约为 22.4L·ml-1。
知识点2 气体摩尔体积
(2)常用单位:L/ml(或L·ml-1)。
(3)数值:在标准状况下(指温度为0℃,压强为101 kPa)约为22.4 L·ml-1。
(4)基本关系式:n=V/Vm=m/M=N/NA
(5)影响因素:气体摩尔体积的数值不是固定不变的,它决定于气体所处的温度和压强。
(6)适用对象:单一气体或互不反应的混合气体
【特别提醒】气体摩尔体积(22.4 L·ml-1)应用的“五大误区”
(1)使用“条件”是标准状况,即0 ℃、101 kPa,而不是常温、常压。
(2)使用对象必须是气体物质,可以是单一气体,也可以是混合气体。标准状况下不是气体而又常在题中出现的物质有:水、苯、SO3、HF、CCl4、己烷、CS2、CHCl3、Br2、乙醇等。
(3)标准状况下的气体摩尔体积约为22.4 L·ml-1,其他条件下Vm一般不是22.4 L·ml-1。
(4)22.4 L气体,在标准状况下的物质的量是1 ml,在非标准状况下,可能是1 ml,也可能不是1 ml。
(5)物质的质量、物质的量一定时,所含微粒数与物质处于何种条件无关。如常温常压下32 g O2所含的原子数目是2NA。注意不要形成定势思维,看到“常温常压”就排除选项。
(1)阿伏加德罗定律:在相同的温度和压强下,相同体积的任何气体,含有相同数目的粒子(或气体的物质的量相同)。
知识点3 阿伏加德罗定律及其推论
【名师提醒】可总结为:“三同”定“一同”,即同温、同压下,同体积的任何气体具有相同的分子数。
(2)阿伏加德罗定律的推论(以下用到的符号:ρ为密度,p为压强,n为物质的量,M为摩尔质量,m为质量,V为体积,T为热力学温度)
1、记忆方法:三正比、二反比、一连比。
2、应用阿伏加德罗定律推论时可通过pV=nRT及n=m/M、ρ=m/V导出。
考向1 气体摩尔体积
例1.CH4 与Cl2光照条件下充分反应生成一系列卤代烃,设NA为阿伏加德罗常数的值。下列说法正确的是( )A.标准状况下,22.4 L CHCl3含有的氯原子数为3NAB.标准状况下,22.4 L Cl2完全反应后得到的HCl分子数为2NAC.16 g CH4与足量Cl2充分反应后得到的卤代烃分子总数为NAD.1 ml CH4和1 ml Cl2充分反应可以得到CH3Cl的分子数为NA
【变式训练】已知:①6.72 L NH3(标准状况下)②1.204×1023个H2S分子 ③5.6 g CH4④0.5 ml HCl,下列关系正确的是( )A.体积大小:④>③>②>①B.原子数目:③>①>②>④C.密度大小:④>②>③>①D.质量大小:④>②>③>①
考向2 阿伏加德罗定律及应用
例2.如图Ⅰ,将质量均为m g的O2和SO2气体分别充入两个相同体积的密闭容器甲、乙中,下列说法正确的是( ) 图Ⅰ 图ⅡA.甲、乙中所含的氧原子物质的量之比为1∶2B.两者压强(p)与温度(T)的关系如图Ⅱ所示C.甲、乙中气体质子数之比为1∶2D.甲、乙中气体密度比为1∶2
【变式训练】三种气体X、Y、Z的相对分子质量关系为Mr(X)
相关课件
这是一份第01讲 物质的量 气体摩尔体积(练习)-备战2024年高考化学一轮复习精品课件+讲义+练习(新教材新高考),文件包含第01讲物质的量气体摩尔体积练习原卷版docx、第01讲物质的量气体摩尔体积练习解析版docx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。
这是一份第01讲 物质的量 气体摩尔体积(课件)-备战2024年高考化学一轮复习精品课件+讲义+练习(新教材新高考),共38页。PPT课件主要包含了复习目标,网络构建,知识梳理题型归纳,真题感悟,内容索引,考情分析,PARTONE等内容,欢迎下载使用。
这是一份第01讲 物质的量 气体摩尔体积(讲义)-备战2024年高考化学一轮复习精品课件+讲义+练习(新教材新高考),文件包含第01讲物质的量气体摩尔体积讲义原卷版-高考化学一轮复习讲练测新教材新高考docx、第01讲物质的量气体摩尔体积讲义解析版-高考化学一轮复习讲练测新教材新高考docx等2份课件配套教学资源,其中PPT共0页, 欢迎下载使用。








