
湖南省永州市2022-2023学年高一下学期期末质量监测化学试题(含解析)
展开湖南省永州市2022-2023学年高一下学期期末质量监测化学试题
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列变化中,属于物理变化的是
A.煤的液化 B.石油裂解 C.乙烯聚合 D.海水蒸馏制淡水
2.下列物质不属于有机高分子化合物的是
A.油脂 B.纤维素 C.天然橡胶 D.蛋白质
3.化学与人体健康及环境保护息息相关。下列叙述正确的是
A.食品加工时不可添加任何防腐剂 B.非处方药包装上印有“OTC”标识
C.掩埋废旧电池不会造成环境污染 D.使用含磷洗涤剂不会造成水体污染
4.下列有关物质用途说法不正确的是
A.液氨可用作制冷剂 B.二氧化硫可用作食品添加剂
C.聚氯乙烯可用于食品包装材料 D.二氧化硅可用来生产光导纤维
5.下列化学用语正确的是
A.羟基的电子式: B.聚丙烯的结构简式:
C.乙烯的结构简式: D.甲烷分子的球棍模型:
6.下列指定反应的离子方程式正确的是
A.铜丝插入热的浓硫酸中:
B.将通入溶液中:
C.向溶液中滴加少量
D.过量铁粉加入稀硝酸中:
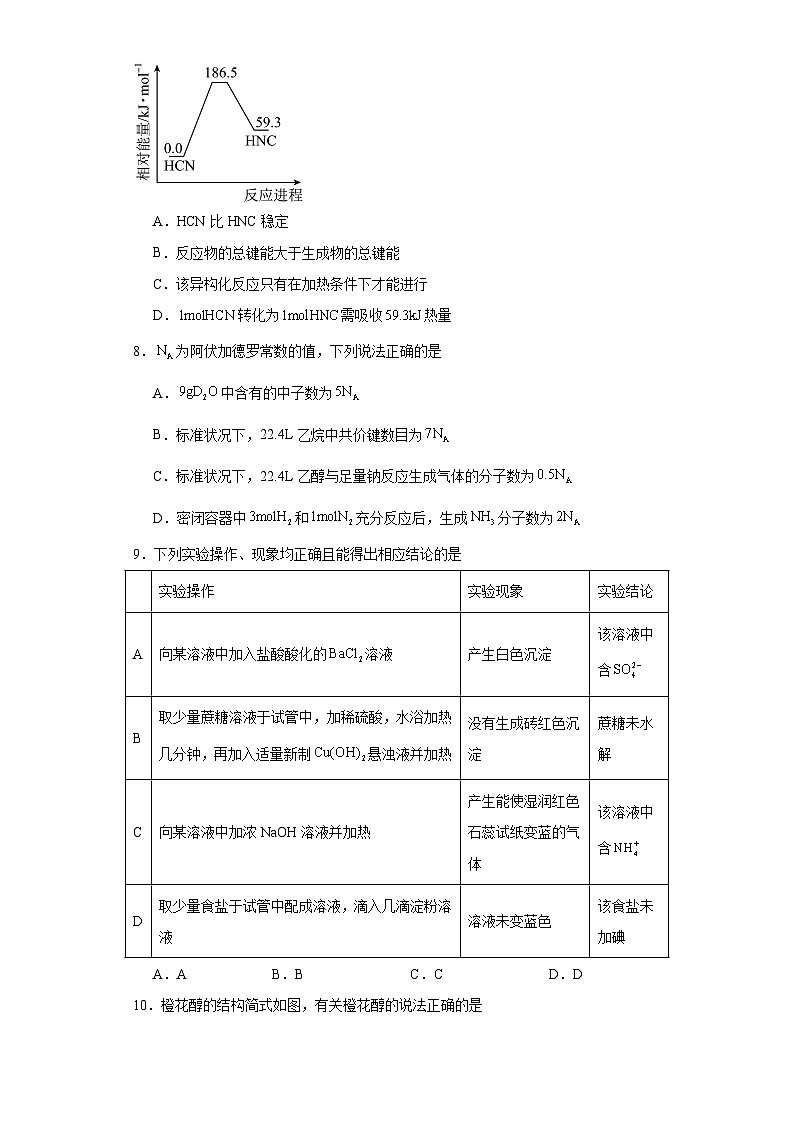
7.理论研究表明,在和下,异构化反应过程的能量变化如图所示。下列说法不正确的是
A.HCN比HNC稳定
B.反应物的总键能大于生成物的总键能
C.该异构化反应只有在加热条件下才能进行
D.转化为需吸收热量
8.为阿伏加德罗常数的值,下列说法正确的是
A.中含有的中子数为
B.标准状况下,22.4L乙烷中共价键数目为
C.标准状况下,22.4L乙醇与足量钠反应生成气体的分子数为
D.密闭容器中和充分反应后,生成分子数为
9.下列实验操作、现象均正确且能得出相应结论的是
实验操作
实验现象
实验结论
A
向某溶液中加入盐酸酸化的溶液
产生白色沉淀
该溶液中含
B
取少量蔗糖溶液于试管中,加稀硫酸,水浴加热几分钟,再加入适量新制悬浊液并加热
没有生成砖红色沉淀
蔗糖未水解
C
向某溶液中加浓NaOH溶液并加热
产生能使湿润红色石蕊试纸变蓝的气体
该溶液中含
D
取少量食盐于试管中配成溶液,滴入几滴淀粉溶液
溶液未变蓝色
该食盐未加碘
A.A B.B C.C D.D
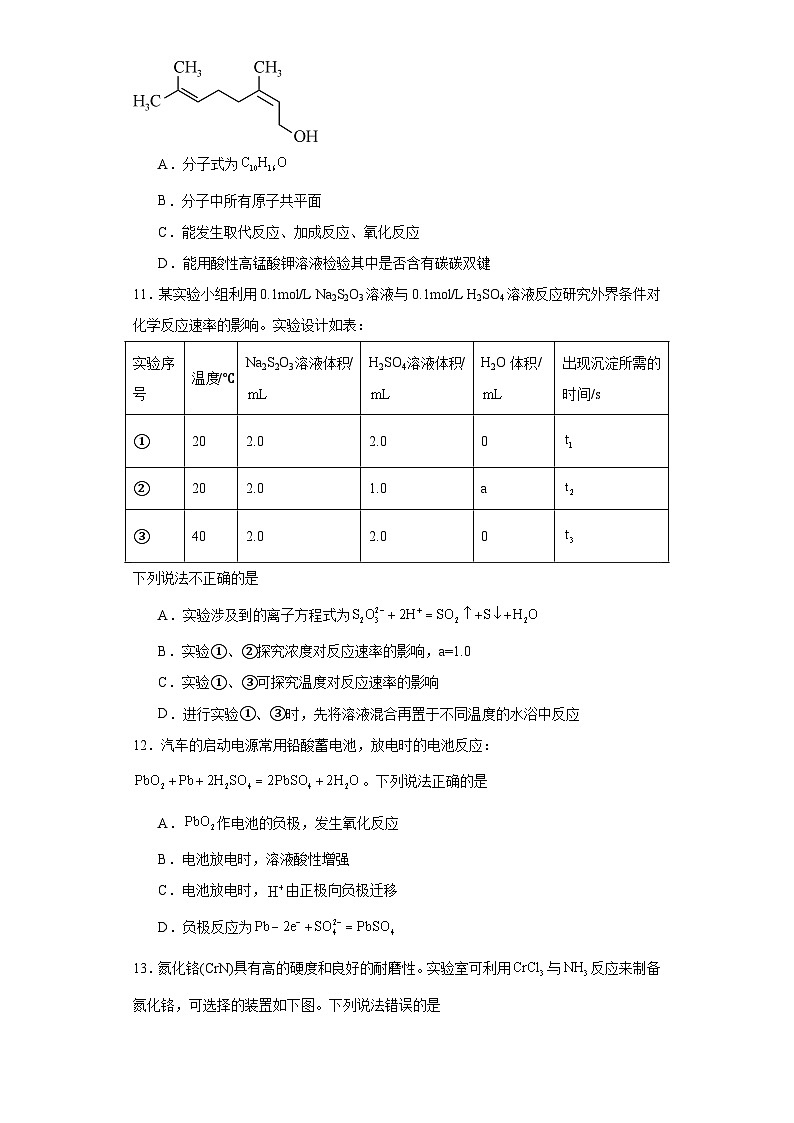
10.橙花醇的结构简式如图,有关橙花醇的说法正确的是
A.分子式为
B.分子中所有原子共平面
C.能发生取代反应、加成反应、氧化反应
D.能用酸性高锰酸钾溶液检验其中是否含有碳碳双键
11.某实验小组利用0.1mol/L Na2S2O3溶液与0.1mol/L H2SO4溶液反应研究外界条件对化学反应速率的影响。实验设计如表:
实验序号
温度/℃
Na2S2O3溶液体积/
H2SO4溶液体积/
H2O体积/
出现沉淀所需的时间/s
①
20
2.0
2.0
0
②
20
2.0
1.0
a
③
40
2.0
2.0
0
下列说法不正确的是
A.实验涉及到的离子方程式为
B.实验①、②探究浓度对反应速率的影响,a=1.0
C.实验①、③可探究温度对反应速率的影响
D.进行实验①、③时,先将溶液混合再置于不同温度的水浴中反应
12.汽车的启动电源常用铅酸蓄电池,放电时的电池反应:。下列说法正确的是
A.作电池的负极,发生氧化反应
B.电池放电时,溶液酸性增强
C.电池放电时,由正极向负极迁移
D.负极反应为
13.氮化铬(CrN)具有高的硬度和良好的耐磨性。实验室可利用与反应来制备氮化铬,可选择的装置如下图。下列说法错误的是
已知:为紫色单斜晶体,熔点为383℃,易升华,高温下易被氧气氧化,极易水解,CrN难溶于水,熔点1282℃
A.装置的连接顺序为:A→D→E→B→C→E
B.A装置中分液漏斗内盛放的是氯化铵溶液,圆底烧瓶中盛放的是氢氧化钠溶液
C.B与C之间采用粗玻璃管的目的是防止升华的冷凝堵塞导管
D.制得的CrN中往往含有少量,生成的化学方程式为:
14.将和的混合物16.28g加入到的稀硫酸中,待固体完全溶解后得到酸性溶液X。向溶液X中通入1568mL(已换算为标准状况)的得到溶液Y,此时溶液中的恰好被完全氧化。下列叙述正确的是
A.溶液X中的阳离子一定有,可能有
B.原混合物中FeO的质量为10.08g
C.向溶液Y中加入足量铁粉,充分反应后产生标准状况下224mL的
D.向溶液Y中加入8g铁粉,充分反应后得到不溶固体1.92g
二、工业流程题
15.海水是巨大的资源宝库,人类从海水中提取某些化工原料的简单流程如下:
已知:溴单质的沸点为,氧化镁的熔点为,氯化镁的熔点为。
请回答下列问题。
(1)流程中,试剂①和②适宜选用 。
试剂①
试剂②
A
NaOH溶液
盐酸
B
NaOH溶液
硫酸
C
石灰乳
盐酸
D
澄清石灰水
硝酸
(2)工业上采用电解熔融氯化镁而不用电解熔融氧化镁制金属镁,其原因是 。
(3)工业上利用制备金属Ti,该方法属于 。
A.热分解法 B.热还原法 C.电解法
(4)“吹出塔”中通入热空气吹出,利用了 的性质。
(5)“吸收塔”中发生反应的离子方程式为 。
(6)“蒸馏塔”中温度应控制在 。
A. B. C.100℃以上
三、原理综合题
16.的排放与燃烧化石燃料有很大的关系,所以对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝
(1)汽车尾气中生成过程中的能量变化如图所示。和完全反应生成NO会吸收 的能量。
(2)催化还原氮氧化物(SCR)技术是目前应用最广泛的脱硝技术,用Fe做催化剂时,在氨气足量的情况下,不同对应的脱氨率如图所示,当温度为 ℃, ,脱氮效果最佳。
Ⅱ.脱碳
(3)一定条件下和反应合成进行脱碳处理,其方程式为:。在2L密闭容器中,该反应过程中的部分数据如下表:
反应时间/
0
3
9
0
0
10
6
20
1.5
30
1.5
①,以的浓度变化表示反应的平均速率为 。
②下列情况能说明该反应达到化学平衡状态的是 。
A.浓度之比为 B.该密闭容器内压强保持不变
C. D.该密闭容器内混合气体的密度保持不变
③平衡时,的体积分数为 (结果保留三位有效数字)。
Ⅲ.脱硫
(4)将转化为重要的化工原料进行脱硫的原理示意图。
催化剂a表面的电极反应式为 ,若得到的硫酸质量分数仍为49%,则理论上参加反应的与加入的的物质的量之比为 。
四、填空题
17.某研究性学习小组对二氧化硫的制备、性质以及含量测定进行探究。
Ⅰ.制备二氧化硫
用70%的浓硫酸与固体反应制备气体。
(1)制备气体最合适的发生装置是 (填写字母),反应的化学方程式为 。
Ⅱ.探究的性质
在下图装置中先后三次加入相同浓度、相同体积、不同条件下的钡盐溶液,控制食用油油层厚度一致、打开开关K,通入流速一致。三次实验现象如下表:
①
②
③
已煮沸的溶液
未煮沸的溶液
己煮沸的溶液
无白色沉淀生成
有白色沉淀生成
有白色沉淀生成
三次实验分别得到如下图:
(2)A装置中覆盖食用油的目的是 。
(3)图中,曲线①呈缓慢下降趋势,这是因为 ;曲线②出现骤降,这是因为与溶液中溶解的 发生了氧化还原反应生成了;写出实验③中反应的离子方程式为 。
Ⅲ.测定空气中二氧化硫含量。
(4)将空气样品经过管道通入密闭容器中的的酸性溶液,若管道中空气流量为,经过溶液恰好褪色,假设样品中的可被溶液充分吸收。则该空气样品中的含量为 。
五、有机推断题
18.丁烯酸乙酯的用途非常广泛,可用于有机合成中间体、溶剂、油漆软化剂等。用乙烯合成2-丁烯酸乙酯的路线如下:
已知:
(1)A中含有的官能团的名称为 ,由B生成C的化学反应类型是 。
(2)的化学方程式为 。
(3)2-丁烯酸乙酯的结构简式为 。
(4)写出与2-丁烯酸具有相同官能团的同分异构体的结构简式 (不考虑立体异构)。
(5)实验室可用2-丁烯酸与乙醇制备2-丁烯酸乙酯。其实验步骤:
步骤1:在反应瓶中,加入2-丁烯酸21.5g、乙醇100mL(过量)和浓硫酸2mL,搅拌,加热回流一段时间;
步骤2:蒸出过量的乙醇:
步骤3:反应液冷却后,加入饱和溶液洗涤至中性,分离出有机相。
步骤4:有机相经无水干燥、过滤、蒸馏(如图,夹持仪器已略),得2-丁烯酸乙酯。
回答下列问题:
①图中仪器A的名称是 。
②步骤3中,用饱和溶液洗涤,其目的是 。
③本实验的产率是 (结果保留三位有效数字)。
参考答案:
1.D
【详解】A.煤的液化是将煤通过化学手段转化为液体燃料,有新物质生成,属于化学变化,故不选A;
B.石油裂解是用石油分馏的产品为原料,把大分子烃断裂为乙烯、丙烯等小分子烃,有新物质生成,属于化学变化,故不选B;
C.乙烯聚合生成聚乙烯,有新物质生成,属于化学变化,故不选C;
D.海水蒸馏制淡水,没有新物质生成,属于物理变化,故选D。
选D。
2.A
【详解】有机高分子化合物是由小分子通过聚合反应生成的,具有相对分子质量比较大的特点,常见的有机高分子有:蛋白质、纤维素、天然橡胶等,油脂相对分子质量较小,也不是由聚合反应生成的,不属于有机高分子化合物;
综上B、C、D错误,答案选A。
3.B
【详解】A.食品加工时,可适当添加食品添加剂和防腐剂等,如苯甲酸及亚硝酸钠等,A错误;
B.非处方药包装上印有“OTC”标识,B正确;
C.废旧电池中含有重金属等金属离子,会造成土壤污染、水体污染等,C错误;
D.含磷洗涤剂的排放,使水中磷过多,造成水中藻类疯长,消耗水中溶解的氧,水体变浑浊,D错误;
故选B。
4.C
【详解】A.氨气易液化,液氨汽化吸热,液氨可用作制冷剂,故A正确;
B.葡萄酒中用二氧化硫作防腐剂、看好氧化剂,二氧化硫可用作食品添加剂,故B正确;
C.聚乙烯可用于食品包装材料,聚氯乙烯不能用作食品包装材料,故C错误;
D.光导纤维的成分是二氧化硅,故D正确;
选C。
5.A
【详解】A.羟基的结构式为-O-H,O原子的最外层有1个成单电子,则其电子式为,A正确;
B.丙烯的结构简式为CH3-CH=CH2,则聚丙烯的结构简式为,B不正确;
C.乙烯的分子式为C2H4,书写结构简式时,碳碳双键不能省略,则其结构简式为CH2=CH2,C不正确;
D.是甲烷的空间填充模型,甲烷分子的球棍模型为,D不正确;
故选A。
6.B
【详解】A.铜丝插入热的浓硫酸中生成硫酸铜、二氧化硫、水,故A错误;
B.将通入溶液中生成硝酸钠、亚硝酸钠、水,反应的离子方程式是,故B正确;
C.向溶液中滴加少量,作双氧水分解的催化剂,反应方程式为,故C错误;
D.过量铁粉加入稀硝酸中生成硝酸亚铁、一氧化氮、水,反应的离子方程式是:,故D错误;
选B。
7.C
【详解】A.由图可知HCN能量低于HNC,物质能量越低越稳定,A正确;
B. 该反应为吸热反应,反应物的总键能大于生成物的总键能,B正确;
C.成物的总能量高于反应物的总能量,为吸热反应,但不一定需要加热才能发生,C错误;
D.由图可知转化为需吸收热量,D正确;
故选C。
8.B
【详解】A.D2O分子中含有10个中子,中含有的中子数为 ,故A错误;
B.1个乙烷分子中有7个共价键,标准状况下,22.4L乙烷的物质的量为1mol,共价键数目为,故B正确;
C.标准状况下乙醇是液体,22.4L乙醇的物质的量不是1mol,故C错误;
D.反应可逆,密闭容器中和充分反应后,生成分子数小于,故D错误;
选B。
9.C
【详解】A.向某溶液中加入盐酸酸化的溶液,产生白色沉淀,沉淀可能是硫酸钡或氯化银,该溶液中含或Ag+,故A错误;
B.检验蔗糖水解的产物,应先加氢氧化钠中和硫酸,再加入适量新制悬浊液并加热,故B错误;
C.向某溶液中加浓NaOH溶液并加热,产生能使湿润红色石蕊试纸变蓝的氨气,该溶液中含,故C正确;
D.加碘盐中加入的碘为碘酸钾,不是碘单质,取少量食盐于试管中配成溶液,滴入几滴淀粉溶液,溶液未变蓝色,不能说明该食盐未加碘,故D错误;
选C。
10.C
【详解】A.根据橙花醇的结构简式,可知分子式为,故A错误;
B.分子中含有单键碳原子,不可能所有原子共平面,故B错误;
C.含有碳碳双键、羟基,能发生取代反应、加成反应、氧化反应,故C正确;
D.碳碳双键、羟基都能使高锰酸钾溶液褪色,不能用酸性高锰酸钾溶液检验其中是否含有碳碳双键,故D错误;
选C。
11.D
【详解】A.实验中,0.1mol/L Na2S2O3溶液与0.1mol/L H2SO4溶液混合发生反应,生成Na2SO4、SO2、S等,则涉及到的离子方程式为,A正确;
B.实验①、②中,温度相同,Na2S2O3溶液的浓度相同,则溶液的总体积应相同,只有H2SO4的浓度不同,探究浓度对反应速率的影响,此时2.0+1.0+a=2.0+2.0,a=1.0,B正确;
C.实验①、③中,各物质的浓度都相同,只有温度不同,可探究温度对反应速率的影响,C正确;
D.进行实验①、③时,为保证时间测定的准确性,应先将0.1mol/L Na2S2O3溶液与0.1mol/L H2SO4溶液各两份分别放在20℃和40℃的水浴中调节温度,然后将相同温度的两份溶液同时混合发生反应,D不正确;
故选D。
12.D
【详解】A.中Pb元素化合价降低发生还原反应,作电池的正极,故A错误;
B.电池放电时,反应消耗硫酸,溶液酸性减弱,故B错误;
C.电池放电时,阳离子移向正极,由负极向正极迁移,故C错误;
D.负极Pb失电子生成硫酸铅,负极反应为,故D正确;
选D。
13.B
【分析】A中制备氨气,D装置用来控制NH3的流速以及检验后续装置是否堵塞,E装置干燥氨气,B装置中氨气和CrCl3反应制备氮化铬,由于易升华,粗导管是为了防止堵塞,CrCl3极易水解,E装置可防止空气中的水进入C中,故装置的连接顺序为A→D→E→B→C→E。
【详解】A.根据分析,装置的连接顺序为:A→D→E→B→C→E,A正确;
B.氯化铵溶液与氢氧化钠溶液反应制备氨气时需要加热,题中无加热装置,B错误;
C.根据分析,B与C之间采用粗玻璃管的目的是防止升华的冷凝堵塞导管,C正确;
D.制得的CrN中往往含有少量,根据杨阿虎还原反应原理,生成的化学方程式为:,D正确;
故选B。
14.C
【分析】将FeO和的混合物加入到稀硫酸中,二价铁被氧化,先后发生反应:
①,而后再通入448mL(已换算为标准状况)的Cl2,才将Fe2+恰好完全氧化,则通入Cl2之前溶液中含有Fe2+,整个反应过程中,氯气氧化的Fe2+为0.04mol,设有a mol FeO和b mol ,则①中被氧化的Fe2+为(a-0.04)mol且72a+188b=9.08,①中H+过量、少量,则2b mol完全消耗,由方程式①可知,结合72a+188b=9.08,求解可得a=0.1,b=0.01,据此分析解题:
【详解】A.由分析可知溶液X中的阳离子一定有Cu2+、Fe2+、H+、Fe3+,A错误;
B.由分析可知,原混合物中 FeO的物质的量为0.1mol,质量为7.2g,B错误;
C.由分析可知,溶液Y中剩余H+为0.3mol-0.2mol-0.02×4mol=0.02mol,加入足量铁粉,H+全部转化为H2,物质的量为0.01mol,C正确;
D.由分析可知,溶液Y中剩余的Fe3+为0.1mol、剩余H+为0.02mol、剩余的Cu2+为
0.01mol,根据反应方程式:Fe+2Fe3+=3Fe2+、Fe+2H+=Fe2++H2、
Fe+Cu2+=Fe2++Cu可知,可以消耗铁粉的物质的量为:0.05mol+0.01mol+0.01mol=0.07mol,即3.92gFe,加入8g铁粉,剩余固体为铁和铜,质量为8g-3.92g+0.01×64g=4.72g,D错误;
故选C。
15.(1)C
(2)氯化镁熔点远低于氧化镁,能耗低经济效益高
(3)B
(4)挥发性
(5)SO2+Br2+2H2O=2Br-++4H+
(6)B
【分析】浓缩海水中先加入石灰乳将镁离子沉淀,分离出后用盐酸溶解,经过操作获得无水氯化镁后利用电解的方法制镁;经过酸化的滤液先通入氯气将溴离子氧化为溴单质,经吹出塔利用空气吹出后进行吸收,在吸收塔中发生反应后再次通入氯气氧化,最后通过蒸馏得溴单质;
【详解】(1)工业制镁:利用海边贝壳制生石灰,与海水反应生成石灰乳,原料成本低;溶解氢氧化镁沉淀选择盐酸;
(2)结合题目信息,氯化镁熔点远低于氧化镁,可以减少能耗,节约成本;
(3)结合反应条件和反应类型可判断该方法为热还原法;
(4)结合溴的物理性质可知,溴单质易挥发,易于吹出;
(5)溴具有氧化性,二氧化硫具有还原性,二者发生氧化还原反应生成硫酸和氢溴酸,离子方程式:SO2+Br2+2H2O=2Br-++4H+;
(6)温度过高,大量水蒸气随溴蒸气排出,溴蒸气中水分含量增加;温度过低,溴不能完全蒸出,故温度应选择;
16.(1)180
(2) 300 1∶1
(3) 0.15 BC 16.7%
(4) SO2-2e-+2H2O=+4H+ 3∶20
【详解】(1)断裂1mol氮氮三键吸收946kJ的能量、断裂1mol氧氧双键吸收498kJ的能量、生成2mol氮氧键放出1264 kJ的能量,和完全反应生成2molNO,会吸收 (1264-946-498)kJ=180的能量。
(2)根据图示,当温度为300℃,1:1,脱氮率最高,脱氮效果最佳。
(3)①内消耗3mol氢气,以的浓度变化表示反应的平均速率为 0.15。
②A.的投料比大于系数比,所以浓度之比为为定值,浓度之比为,反应不一定平衡,故不选A;
B.反应前后气体系数和不同,压强是变量,该密闭容器内压强保持不变,反应一定达到平衡状态,故选B;
C.,正逆反应速率比等于系数比,反应一定达到平衡状态,故选C;
D.反应前后气体总质量不变、容器体积不变,密度是恒量,该密闭容器内混合气体的密度保持不变,反应不一定平衡,故不选D;
选BC。
③根据表格数据,20min时消耗1.5molCO2,消耗4.5mol氢气,反应生成1.5mol、1.5molH2O,20min时容器中CO2、H2、、H2O的物质的量分别是1.5mol、4.5mol、1.5mol、1.5mol,30min时水的物质的量为1.5mol,可知20min时反应达到平衡状态,的体积分数为。
(4)根据图示,催化剂a表面二氧化硫失电子生成硫酸根离子,电极反应式为SO2-2e-+2H2O=+4H+;设理论上参加反应的与加入的的物质的量分别为xmol、ymol,根据总反应方程式2SO2+O2+2H2O=2H2SO4,可知生成xmol硫酸、剩余(y-2x)mol水,则,x:y=3:20。
17.(1) B Na2SO3+H2SO4(浓) = Na2SO4+SO2↑+H2O
(2)隔绝空气,避免空气中的氧气干扰实验
(3) SO2不与BaCl2 反应,溶于水的 SO2 部分与水反应生成 H2SO3,H2SO3电离出氢离子,pH减小 氧气(O2) 3Ba2++3SO2++2H2O=3BaSO4↓+2NO+4H+
(4)或
【详解】(1)浓硫酸与固体的反应为固液不加热的反应,因此选择装置B,反应的方程式为Na2SO3+H2SO4(浓) = Na2SO4+SO2↑+H2O;
(2)A装置中覆盖食用油的目的是隔绝空气,防止氧气对实验造成干扰;
(3)图中,曲线①呈缓慢下降趋势,这是因为SO2不与BaCl2 反应,但溶于水的 SO2 部分与水反应生成 H2SO3,H2SO3电离出氢离子,导致pH减小;曲线②出现骤降,这是因为与溶液中溶解的氧气发生了氧化还原反应生成硫酸,硫酸为强酸,硫酸电离出氢离子,导致pH骤降;实验③中反应的方程式为3Ba2++3SO2++2H2O=3BaSO4↓+2NO+4H+;
(4)二氧化硫和酸性高锰酸钾反应的方程式为,由题目可知消耗的高锰酸钾的物质的量为,由此可知二氧化硫的物质的量为,则二氧化硫的质量为,空气的体积为ab L,由此可知该空气样品中的含量为。
18.(1) 羟基 加成反应
(2)2CH3CH2OH+O22CH3CHO+2H2O
(3)CH3CH=CHCOOCH2CH3
(4)CH2=CHCH2COOH、CH2=C(CH3)COOH
(5) 冷凝管(或直形冷凝管) 溶解乙醇,中和2-丁烯酸和硫酸,降低2-丁烯酸乙酯的溶解度 64.2%
【分析】乙烯和水发生加成反应生成乙醇,A是乙醇;乙醇催化氧化生成乙醛,2分子乙醛发生羟醛缩合生成C,C在一定条件下发生消去反应生成D,D氧化为2-丁烯酸,2-丁烯酸和乙醇发生酯化反应生成2-丁烯酸乙酯。
【详解】(1)A是乙醇,结构简式为CH3CH2OH,含有的官能团的名称为羟基,2分子乙醛发生羟醛缩合生成C,化学反应类型是加成反应。
(2)是乙醇发生催化氧化生成乙醛,反应的化学方程式为2CH3CH2OH+O22CH3CHO+2H2O;
(3)CH3CH=CHCOOH和乙醇发生酯化反应生成2-丁烯酸乙酯,2-丁烯酸乙酯的结构简式为CH3CH=CHCOOCH2CH3;
(4)2-丁烯酸含有碳碳双键、羧基,2-丁烯酸具有相同官能团的同分异构体的结构简式有CH2=CHCH2COOH、CH2=C(CH3)COOH。
(5)①根据装置图,可知仪器A的名称是直形冷凝管。
②步骤3中,用饱和溶液洗涤,其目的是溶解乙醇,中和2-丁烯酸和硫酸,降低2-丁烯酸乙酯的溶解度。
③21.5g 2-丁烯酸的物质的量为 ,理论上制取0.25mol2-丁烯酸乙酯,本实验的产率是。
湖南省永州市2023-2024学年高一上学期1月期末质量监测化学试题(含答案): 这是一份湖南省永州市2023-2024学年高一上学期1月期末质量监测化学试题(含答案),共11页。试卷主要包含了可能用到的相对原子质量,化学让生活更美好,下列叙述正确的是,下列化学用语不正确的是等内容,欢迎下载使用。
安徽省芜湖市2021-2022学年高一下学期期末质量监测化学试题含解析: 这是一份安徽省芜湖市2021-2022学年高一下学期期末质量监测化学试题含解析,共30页。
2022甘孜州高一下学期学业质量统一监测期末统考化学试题含解析: 这是一份2022甘孜州高一下学期学业质量统一监测期末统考化学试题含解析,文件包含四川省甘孜州2021-2022学年高一下学期学业质量统一监测期末统考化学试题含解析docx、四川省甘孜州2021-2022学年高一下学期学业质量统一监测期末统考化学试题无答案docx等2份试卷配套教学资源,其中试卷共22页, 欢迎下载使用。












