

高中化学苏教版 (2019)选择性必修1第三单元 化学平衡的移动同步训练题
展开
这是一份高中化学苏教版 (2019)选择性必修1第三单元 化学平衡的移动同步训练题,共14页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
2.3.3温度变化对化学平衡的影响同步练习-苏教版高中化学选择性必修1
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.一定条件下,通过下列反应可以制备特种陶瓷的原料MgO: MgSO4(s)+CO(g) MgO(s)+CO2(g)+SO2(g) △H>0,该反应在某密闭容器中达到平衡。下列分析正确的是
A.恒温恒容时,充入CO气体,达到新平衡时增大
B.容积不变时,升高温度,混合气体的平均相对分子质量减小
C.恒温恒容时,分离出部分SO2气体可提高MgSO4的转化率
D.恒温时,增大压强平衡逆向移动,平衡常数减小
2.工业上用接触法制备浓硫酸的原理如下:
已知:
下列说法错误的是
A.增大反应容器的体积可以提高煅烧速率
B.步骤④中产生的尾气经净化后循环利用可以提高原料利用率
C.温度过高不利于的催化氧化反应
D.步骤③中充入适当过量的空气能提高的转化率
3.碘钨灯具有亮度高、使用寿命长等特点,被广泛用作影视拍摄、舞台、工厂、大型建筑物、大型广场等的照明光源。碘钨灯的原理是:金属钨(W)在高温下发生缓慢升华,并与碘钨灯中封存的碘蒸气发生以下反应:,利用工作时灯泡壁与灯丝的温度差将沉积在灯泡壁上的钮“搬运”回灯丝上。下列有关理解不正确的是
A.碘钨灯工作时,电能可转化为光能和热能
B.碘钨灯工作时,在灯泡壁和灯丝上发生反应的平衡常数互为倒数
C.为放热反应
D.碘蒸气的作用是延长灯丝的使用寿命
4.为研究压强对化学平衡的影响,用注射器吸入和的混合气体(如图),将细管端用橡胶塞封闭,反复推拉活塞,如图观察管内混合气体颜色的变化,下列说法正确的是
A.往外拉注射器活塞,气体压强减小,混合气体颜色持续变深
B.该实验中的现象不符合勒夏特列原理
C.向内推注射器活塞.管内混合气体平均相对分子质量减小
D.实验中应注意避免因推拉活塞导致的温度变化对平衡移动的影响
5.下列事实能用勒夏特列原理解释的是
A.在合成氨(正反应是放热)的反应中,升温有利于氨的合成
B.H2、I2、HI 三者的平衡混合气,加压(缩小容器体积)后颜色变深
C.开启啤酒瓶后,瓶中立刻泛起大量泡沫
D.钢铁在潮湿的空气中更容易生锈
6.在一密闭容器中,反应 aA(g) bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
A.平衡向逆反应方向移动了 B.物质A的转化率减少了
C.物质B的质量分数增加了 D.a>b
7.将装入带活塞的密闭容器中,反应达到平衡状态,改变一个条件,下列叙述正确的是
A.慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍
B.慢慢压缩气体体积,平衡正向移动,混合气体颜色变浅
C.体积不变,升高温度气体颜色加深,则此反应为吸热
D.恒温、恒容时,充入惰性气体,压强增大,平衡正向移动,混合气体的颜色变浅
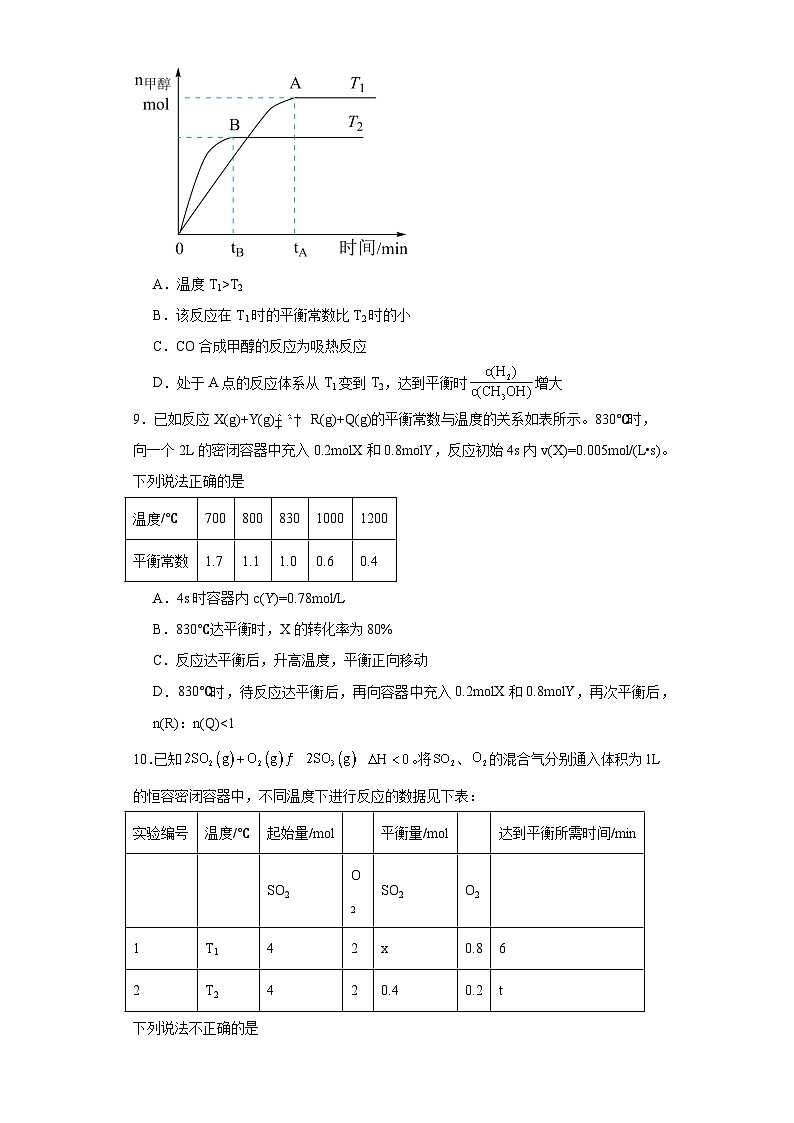
8.在恒容密闭容器中,由CO合成甲醇:CO(g)+2H2(g)CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是( )
A.温度T1>T2
B.该反应在T1时的平衡常数比T2时的小
C.CO合成甲醇的反应为吸热反应
D.处于A点的反应体系从T1变到T2,达到平衡时增大
9.已如反应X(g)+Y(g)R(g)+Q(g)的平衡常数与温度的关系如表所示。830℃时,向一个2L的密闭容器中充入0.2molX和0.8molY,反应初始4s内v(X)=0.005mol/(L•s)。下列说法正确的是
温度/℃
700
800
830
1000
1200
平衡常数
1.7
1.1
1.0
0.6
0.4
A.4s时容器内c(Y)=0.78mol/L
B.830℃达平衡时,X的转化率为80%
C.反应达平衡后,升高温度,平衡正向移动
D.830℃时,待反应达平衡后,再向容器中充入0.2molX和0.8molY,再次平衡后,n(R):n(Q)0,起始通入2molCO,达到平衡后,改变下列条件,则指定物质的浓度、百分含量(填“不变”“增大”“减小”)及平衡如何变化(填“正移”“逆移”“不移动”):
(1)增加C,平衡 ,c(CO) 。
(2)减小密闭容器的体积,保持温度不变,则平衡 ,c(CO2) 。
(3)通入N2,保持密闭容器的体积和温度不变,则平衡 ,c(CO2) 。
(4)保持密闭容器的体积不变,升高温度,则平衡 ,c(CO) 。
(5)恒压通入N2,CO2的百分含量 。
(6)保持密闭容器的体积和温度不变,加入催化剂,CO2的百分含量 。
15.373K时,某 1L密闭容器中加入1mol NH3发生如下可逆反应: 2NH3(g)N2(g)+ 3 H2(g)。其中物质H2的物质的量变化如下图所示。
(1)前 20 s内NH3(g)的平均反应速率为
(2)373K时该反应的平衡常数的值为
(3)若在此平衡体系中再加入 1mol的NH3,与原平衡比较,新平衡时 NH3的转化率 (填“增大”或“减小”,下同)。NH3的平衡浓度 。
(4)将原平衡升温至 473K,重新达平衡时(其他条件不变),H2的平衡浓度为NH3的2倍,该反应的正反应为(填“放热反应”或 “吸热反应”) ,为增大平衡体系中H2的物质的量,下列措施正确的是(其它条件相同)
a.升高温度 b.扩大容器的体积 c.加入合适的催化剂 d.再充入N2
16.和CO是常见的环境污染气体。
(1)对于反应来说,“”可作为此反应的催化剂。其总反应分两步进行:第一步为;则第二步为 (写化学方程式)。已知第二步反应几乎不影响总反应达到平衡所用的时间,由此推知,第一步反应的活化能 (填“大于”“小于”或“等于”)第二步反应的活化能。
(2)在四个不同容积的恒容密闭容器中按图甲充入相应的气体,发生反应:,容器I、II、III中的平衡转化率如图乙所示:
①该反应的 0(填“>”或“”或“”“=”或“K350 ℃,则ΔH 0(填“大于”、“小于”)。
(2)平衡时混合气体中三种气体的物质的量之比为 。(用“:”连接,如1:1:1)
(3)平衡时混合气体的压强是反应前混合气体的压强的 %(只填数字)。
20.光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
(1)实验室中常用来制备氯气的化学方程式为 。
(2)COCl2的分解反应为COCl2(g) = Cl2(g) + CO(g) △H = + 108 kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线未示出):
①计算反应在第8 min 时的平衡常数K = ;
②比较第2 min 反应温度T(2)与第8 min反应温度T(8)的高低:T(2) T(8)(填“<”、“>”或“=”);
③若12 min 时反应于温度T(8)下重新达到平衡,则此时c(COCl2) = mol·l-1;
④比较反应物COCl2在5~6 min和15~16 min时平均反应速率的大小v(5~6) v(12~13) (填“<”、“>”或“=”),原因是 。
三、实验题
21.Ⅰ.在恒温恒压下,向密闭容器中充入4 mol SO2和2 mol O2混合气体,2min后,反应达到平衡,生成SO3气体0.5 mol,同时放出热量QkJ。请回答下列问题:
(1)该反应的热化学方程式为 。
(2)在该条件下,反应前后容器的体积之比为 。
(3)若把“恒温恒压”改为“恒压绝热条件”反应,平衡后n(SO3) 0.5 mol (填“>”、“<”或“=”);
Ⅱ.氨的催化氧化:4NH3(g)+5O2(g)4NO(g)+6H2O(g)
是工业制硝酸的重要反应。
在1L密闭容器中充入4 mol NH3(g)和5 mol O2(g),保持其他条件不变,测得c(NO)与温度的关系如图所示。
(4)该反应的∆H (填“>”“<”或“=”)0;T0℃下,NH3的转化率为 。
22.某兴趣小组以重铬酸钾(K2Cr2O7)溶液为研究对象,结合所学反应原理的知识改变条件使其发生“色彩变幻”。
已知:①K2Cr2O7溶液存在平衡:Cr2O+H2O2CrO+2H+。
②含铬元素的离子在溶液中的颜色:Cr2O(橙色);CrO(黄色);Cr3+(绿色)。
(1)i可证明反应Cr2O+H2O2CrO+2H+的正反应是 (填“吸热”或“放热”)。
(2)ii是验证“只降低生成物的浓度,该平衡正向移动”,试剂a是 。
(3)iii的目的是要验证“增大生成物的浓度,该平衡逆向移动”,此实验是否能达到预期目的 (填“能”或“不能”),理由是 。
(4)根据实验Ⅱ中不同现象,可以得出的结论是 。
(5)继续实验
①解释溶液变黄的主要原因是 。
②溶液变绿色,该反应的离子方程式是 。
23.Ⅰ.过量铁片与100mL 0.01mol/L的稀盐酸反应,能量变化趋势,如图所示:
(1)该反应为 反应(填“吸热”或“放热”)。
(2)为了加快产生H2的速率而不改变H2的产量,可以使用如下方法中的
①加H2O ②加入几滴1mol/LHNO3溶液 ③滴入几滴浓盐酸
④加入一定量铁粉 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液
⑦适当升高温度(不考虑盐酸挥发) ⑧改用10mL0.1mol/L盐酸
A.②③⑥⑦⑧ B.③④7⑧ C. ③⑥⑦⑧ D.③⑥⑦
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜电极上发生的电极反应为 。
Ⅱ.某温度时,在5 L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题:
(1)分析有关数据,写出X、Y、Z的反应方程式 。
(2)该反应在3 种不同条件下进行,其中Y起始浓度相同,Z起始浓度为0,反应物X的浓度随反应时间的变化情况如下表:
①实验1中,在10~20 min内,以物质Y表示的平均反应速率为 mol/(L·min) ,50min时,实验3中Z的浓度 。
②0~20min内,其它条件一样实验2 和实验1的反应速率不同,其原因可能是 ;实验3 和实验1的反应速率不同,其原因是 。
参考答案:
1.C
2.A
3.B
4.D
5.C
6.C
7.A
8.D
9.B
10.C
11. 吸 < 增大 增大 增大 增大 不变 不变
12. P 增大反应速率 改变反应进行的限度 升高温度 增大压强
13.(1)高温
(2) 增大 增大 副反应的活化能低于主反应的活化能
(3)iii
14. 不移动 不变 逆移 增大 不移动 不变 正移 增大 减小 不变
15. 0.01mol/L·s 0.12 减小 增大 吸热 ab
16. CO+FeO+Fe++CO2 大于 > 0.0044 D>C>A 向逆反应方向
17. 2/3 mol/L·min(或0.67 mol/L·min) 2/3(或67%或66.7%) < ②③ 增大 体积减小,反应物的浓度增大,因而使反应速率增大
18.(1) < 随着温度的升高,c(NO)增大,说明平衡逆向移动,该反应为放热反应
(2)
相关试卷
这是一份化学选择性必修1第三单元 化学平衡的移动复习练习题,共26页。试卷主要包含了单选题,填空题,实验探究题等内容,欢迎下载使用。
这是一份苏教版 (2019)选择性必修1第三单元 化学平衡的移动练习,共28页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
这是一份苏教版 (2019)选择性必修1第三单元 化学平衡的移动课时作业,共21页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。










