






还剩19页未读,
继续阅读
所属成套资源:高一化学同步精品课件(苏教版2019必修第一册)
成套系列资料,整套一键下载
专题5 第2单元 课题2 分子间作用力 氢键 高一化学同步精品课件(苏教版2019必修第一册)
展开
这是一份专题5 第2单元 课题2 分子间作用力 氢键 高一化学同步精品课件(苏教版2019必修第一册),共27页。
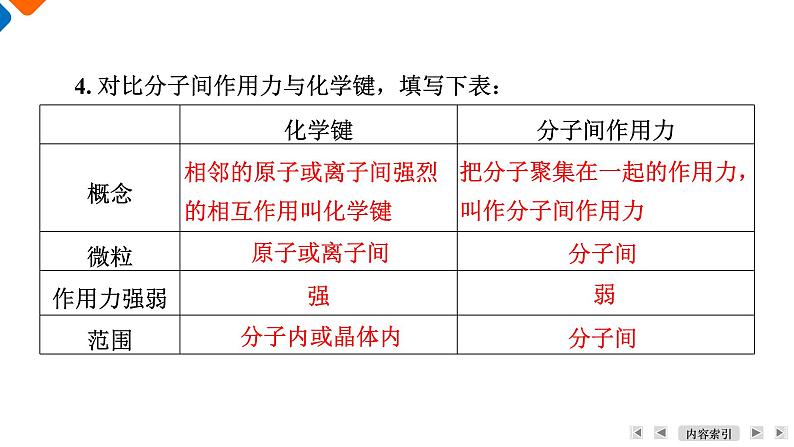
学 习 目 标1. 了解分子间作用力对分子物理性质的影响。2. 了解氢键的概念,能区别氢键、化学键、分子间作用力。3. 能用所学理论解释一些物质的物理性质。活 动 方 案1. 分子内的相邻原子间有较强的作用力,这种作用力是共价键,分子间也存在作用力,举例说明哪些现象说明分子间存在作用力?【答案】 干冰升华、液氯汽化、液氨汽化等吸热,降温后氯气、二氧化碳变成固态或液态,说明分子间存在使分子聚集在一起的作用力。2. 由分子构成的物质的熔、沸点和溶解性主要受分子间作用力影响。氯气在常温下为气态,溴在常温下为液态,碘单质在常温下为固态,这与什么有关?【答案】 与分子间作用力的大小有关,气态分子分子间作用力相对较弱,固态中分子间作用力相对较强。活动一:探究分子间的作用力3. 碘升华时,分子中碘原子之间的共价键是否被破坏?破坏的是什么?【答案】 碘升华时,分子中的化学键不会被破坏,只是破坏了分子间作用力。4. 对比分子间作用力与化学键,填写下表:相邻的原子或离子间强烈的相互作用叫化学键把分子聚集在一起的作用力,叫作分子间作用力原子或离子间分子间强弱分子内或晶体内分子间1. 由分子构成的物质在发生三态变化时,分子不发生改变,但为什么会伴随着能量的变化?【答案】 一般由分子构成的物质发生三态变化时,分子不改变,但会伴随能量变化,这是因为分子间作用力发生变化。活动二:探究氢键和氢键对物质性质的影响2. 在分子构成的物质中,水的沸点相对较高,达到100 ℃,这是为什么?水结成冰体积为什么会膨胀?【答案】 因为水中除存在水分子间作用力,还存在水分子间的氢键。氢键的作用力比分子间作用力大得多,但不是化学键,作用力比化学键弱得多,所以水的沸点高。水变成冰体积膨胀也是因为水分子间的氢键使水形成晶体即冰结构疏松,所以体积膨胀。3. 将水加热到100 ℃时,水便会沸腾,而要使水分解成氢气和氧气,却需要将水加热至1 000 ℃这样的高温,才会有部分水分解,为什么?【答案】 水分解生成氢气和氧气,不仅仅破坏分子间作用力和氢键,更需破坏作用力较强的分子中的共价键,所以水分解的温度高达1 000多度。4. 除水分子间存在氢键外,CH3CH2OH、NH3等分子间也能形成氢键,分子间氢键可使它们的沸点升高,它们不仅分子间形成氢键,还可以与水分子间形成氢键,所以它们都易溶于水。根据以上对氢键的描述,解释氨气为什么极易溶于水?乙醇与水为什么互溶?【答案】 氨气极易溶于水是因为氨气分子与水分子间能形成氢键;乙醇与水互溶是因为乙醇分子和水分子间能形成氢键,溶解性增强。5. 物质中的微粒间作用力类型与物质性质有密切关系。解释干冰为什么受热易升华,而加热却不易分解?氯化钠固态时不导电,在熔融状态下为什么能导电?【答案】 干冰受热易升华,是因为干冰分子间的作用力弱,受热后作用力被破坏,所以升华为气体,而CO2分子中碳原子和氧原子之间的共价键作用力较强,所以干冰在加热条件下不会分解。氯化钠中存在的作用力是离子键,作用力较强,所以固态氯化钠不导电,但在熔融状态下,离子键被削弱,所以氯离子和钠离子可以自由移动,则能导电。课 堂 反 馈2451379681. 共价键、离子键和分子间作用力是构成物质的微粒间的不同作用方式,下列物质中,只含有上述一种作用力的是( )A. 干冰 B. 氯化钠 C. 氢氧化钠 D. 碘【解析】 干冰与碘都是由分子构成的物质,分子间存在着分子间作用力,分子内存在共价键。氯化钠是离子化合物,晶体中只存在离子键。氢氧化钠是离子化合物,它不仅存在离子键,其“OH—”中还存在共价键。【答案】 B2451379682. 下列说法正确的是( )A. ⅠA族元素的金属性比ⅡA族元素的金属性强B. ⅥA族元素的氢化物中,稳定性最好的其沸点也最高C. 同周期非金属的氧化物对应的水化物的酸性从左到右依次增强D. 第三周期元素的离子半径从左到右逐渐减小【答案】 B245379683. 下列变化中,不需要破坏化学键的是( )A. 氯化氢溶于水 B. 加热碘化氢气体使其分解C. 冰融化 D. 加热纯碱晶体使之熔化1【答案】 C245379684. 下列变化中,不需要破坏化学键的是( )A. 碘升华 B. 碳酸氢钠受热分解C. 溴化氢溶于水 D. 氯化钠熔化【答案】 A 1245379685. 下列实验事实的解释正确的是( )1【答案】 B245379686. 现有短周期主族元素X、Y、Z、R、T,R原子的最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Y与T同主族。五种元素原子半径与原子序数之间的关系如图所示。下列推断正确的是( )A. 离子半径:Y<Z B. 氢化物的沸点:Y<TC. 最高价氧化物对应的水化物的酸性:T<R D. 由X、Y、Z、R四种元素组成的常见化合物中含有离子键1245379681【解析】 Y与Z能形成Z2Y、Z2Y2型离子化合物,Z是Na元素、Y是O元素;Y与T同主族,Y的原子序数小于T,所以T是S元素。R的原子序数小于O,R原子的最外层电子数是电子层数的2倍,R是C元素;X的半径、原子序数都小于C原子,所以X是H元素。电子层数相同,质子数越多半径越小,离子半径:Na+<O2-,A错误;水分子间形成氢键,氢化物的沸点:H2S<H2O,B错误;S的非金属性大于C,其最高价氧化物对应的水化物的酸性:H2CO3<H2SO4,C错误;由H、O、Na、C四种元素组成的常见化合物NaHCO3中含有离子键,D正确。【答案】 D245379687. X、Y、Z、W均为短周期元素,它们在元素周期表中的相对位置如图所示。若Z原子的最外层电子数是第一层电子数的3倍,下列说法正确的是( )A. X的最常见气态氢化物的水溶液显酸性B. Z、W常见气态氢化物的稳定性:W>ZC. Z的单质与氢气反应比Y的单质与氢气反应剧烈D. X的原子半径小于Y1245379681【解析】 X、Y、Z、W均为短周期元素,Z原子的最外层电子数是第一层电子数的3倍,Z的第一层电子数为2,则最外层电子数为6,所以Z应为S,结合位置可知,Y为O,X为N,W为Cl。X的最常见气态氢化物为氨气,其水溶液显碱性,A错误;W的非金属性比Z强,气态氢化物的稳定性:HCl>H2S,B正确;非金属性:O>S,所以Y的单质与氢气反应较Z剧烈,C错误;同周期从左向右原子半径减小,则X的原子半径大于Y,D错误。【答案】 B245379688. 下列的说法不正确的是( )A. HF的沸点比HCl的沸点高是由于HF分子间存在氢键B. 水在结冰时体积膨胀,是由于水分子之间存在氢键C. NH3的稳定性很强,是因为其分子间能形成氢键D. 在氨水中水分子和氨分子之间也存在着氢键【答案】 C 1245379689. (2023·南通如东高一期末)X、Y、Z、W、Q、R是原子序数依次增大的短周期主族元素,这些元素的主要化合价和原子半径的相关信息如下:1(1) 元素Q在元素周期表中的位置是__________________,其最高价氧化物对应的水化物和烧碱溶液反应的离子方程式为_________________________________。第三周期ⅢA族245379681(2) 相关比较(填“<”或“>”):①元素Y、Z最高价氧化物对应的水化物酸性:Y______Z。②元素W、Q简单离子半径:r(W)______r(Q)。(3) 写出由X、Y、Z、W四种元素共同组成的物质的化学式:______________________________________,其中所含化学键的类型有__________________。(4) Y、Z、W分别与X组成含10个电子的分子的化学式分别为__________、__________、__________。<>NH4HCO3或(NH4)2CO3离子键、共价键CH4NH3H2O谢谢观看Thank you for watching
学 习 目 标1. 了解分子间作用力对分子物理性质的影响。2. 了解氢键的概念,能区别氢键、化学键、分子间作用力。3. 能用所学理论解释一些物质的物理性质。活 动 方 案1. 分子内的相邻原子间有较强的作用力,这种作用力是共价键,分子间也存在作用力,举例说明哪些现象说明分子间存在作用力?【答案】 干冰升华、液氯汽化、液氨汽化等吸热,降温后氯气、二氧化碳变成固态或液态,说明分子间存在使分子聚集在一起的作用力。2. 由分子构成的物质的熔、沸点和溶解性主要受分子间作用力影响。氯气在常温下为气态,溴在常温下为液态,碘单质在常温下为固态,这与什么有关?【答案】 与分子间作用力的大小有关,气态分子分子间作用力相对较弱,固态中分子间作用力相对较强。活动一:探究分子间的作用力3. 碘升华时,分子中碘原子之间的共价键是否被破坏?破坏的是什么?【答案】 碘升华时,分子中的化学键不会被破坏,只是破坏了分子间作用力。4. 对比分子间作用力与化学键,填写下表:相邻的原子或离子间强烈的相互作用叫化学键把分子聚集在一起的作用力,叫作分子间作用力原子或离子间分子间强弱分子内或晶体内分子间1. 由分子构成的物质在发生三态变化时,分子不发生改变,但为什么会伴随着能量的变化?【答案】 一般由分子构成的物质发生三态变化时,分子不改变,但会伴随能量变化,这是因为分子间作用力发生变化。活动二:探究氢键和氢键对物质性质的影响2. 在分子构成的物质中,水的沸点相对较高,达到100 ℃,这是为什么?水结成冰体积为什么会膨胀?【答案】 因为水中除存在水分子间作用力,还存在水分子间的氢键。氢键的作用力比分子间作用力大得多,但不是化学键,作用力比化学键弱得多,所以水的沸点高。水变成冰体积膨胀也是因为水分子间的氢键使水形成晶体即冰结构疏松,所以体积膨胀。3. 将水加热到100 ℃时,水便会沸腾,而要使水分解成氢气和氧气,却需要将水加热至1 000 ℃这样的高温,才会有部分水分解,为什么?【答案】 水分解生成氢气和氧气,不仅仅破坏分子间作用力和氢键,更需破坏作用力较强的分子中的共价键,所以水分解的温度高达1 000多度。4. 除水分子间存在氢键外,CH3CH2OH、NH3等分子间也能形成氢键,分子间氢键可使它们的沸点升高,它们不仅分子间形成氢键,还可以与水分子间形成氢键,所以它们都易溶于水。根据以上对氢键的描述,解释氨气为什么极易溶于水?乙醇与水为什么互溶?【答案】 氨气极易溶于水是因为氨气分子与水分子间能形成氢键;乙醇与水互溶是因为乙醇分子和水分子间能形成氢键,溶解性增强。5. 物质中的微粒间作用力类型与物质性质有密切关系。解释干冰为什么受热易升华,而加热却不易分解?氯化钠固态时不导电,在熔融状态下为什么能导电?【答案】 干冰受热易升华,是因为干冰分子间的作用力弱,受热后作用力被破坏,所以升华为气体,而CO2分子中碳原子和氧原子之间的共价键作用力较强,所以干冰在加热条件下不会分解。氯化钠中存在的作用力是离子键,作用力较强,所以固态氯化钠不导电,但在熔融状态下,离子键被削弱,所以氯离子和钠离子可以自由移动,则能导电。课 堂 反 馈2451379681. 共价键、离子键和分子间作用力是构成物质的微粒间的不同作用方式,下列物质中,只含有上述一种作用力的是( )A. 干冰 B. 氯化钠 C. 氢氧化钠 D. 碘【解析】 干冰与碘都是由分子构成的物质,分子间存在着分子间作用力,分子内存在共价键。氯化钠是离子化合物,晶体中只存在离子键。氢氧化钠是离子化合物,它不仅存在离子键,其“OH—”中还存在共价键。【答案】 B2451379682. 下列说法正确的是( )A. ⅠA族元素的金属性比ⅡA族元素的金属性强B. ⅥA族元素的氢化物中,稳定性最好的其沸点也最高C. 同周期非金属的氧化物对应的水化物的酸性从左到右依次增强D. 第三周期元素的离子半径从左到右逐渐减小【答案】 B245379683. 下列变化中,不需要破坏化学键的是( )A. 氯化氢溶于水 B. 加热碘化氢气体使其分解C. 冰融化 D. 加热纯碱晶体使之熔化1【答案】 C245379684. 下列变化中,不需要破坏化学键的是( )A. 碘升华 B. 碳酸氢钠受热分解C. 溴化氢溶于水 D. 氯化钠熔化【答案】 A 1245379685. 下列实验事实的解释正确的是( )1【答案】 B245379686. 现有短周期主族元素X、Y、Z、R、T,R原子的最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Y与T同主族。五种元素原子半径与原子序数之间的关系如图所示。下列推断正确的是( )A. 离子半径:Y<Z B. 氢化物的沸点:Y<TC. 最高价氧化物对应的水化物的酸性:T<R D. 由X、Y、Z、R四种元素组成的常见化合物中含有离子键1245379681【解析】 Y与Z能形成Z2Y、Z2Y2型离子化合物,Z是Na元素、Y是O元素;Y与T同主族,Y的原子序数小于T,所以T是S元素。R的原子序数小于O,R原子的最外层电子数是电子层数的2倍,R是C元素;X的半径、原子序数都小于C原子,所以X是H元素。电子层数相同,质子数越多半径越小,离子半径:Na+<O2-,A错误;水分子间形成氢键,氢化物的沸点:H2S<H2O,B错误;S的非金属性大于C,其最高价氧化物对应的水化物的酸性:H2CO3<H2SO4,C错误;由H、O、Na、C四种元素组成的常见化合物NaHCO3中含有离子键,D正确。【答案】 D245379687. X、Y、Z、W均为短周期元素,它们在元素周期表中的相对位置如图所示。若Z原子的最外层电子数是第一层电子数的3倍,下列说法正确的是( )A. X的最常见气态氢化物的水溶液显酸性B. Z、W常见气态氢化物的稳定性:W>ZC. Z的单质与氢气反应比Y的单质与氢气反应剧烈D. X的原子半径小于Y1245379681【解析】 X、Y、Z、W均为短周期元素,Z原子的最外层电子数是第一层电子数的3倍,Z的第一层电子数为2,则最外层电子数为6,所以Z应为S,结合位置可知,Y为O,X为N,W为Cl。X的最常见气态氢化物为氨气,其水溶液显碱性,A错误;W的非金属性比Z强,气态氢化物的稳定性:HCl>H2S,B正确;非金属性:O>S,所以Y的单质与氢气反应较Z剧烈,C错误;同周期从左向右原子半径减小,则X的原子半径大于Y,D错误。【答案】 B245379688. 下列的说法不正确的是( )A. HF的沸点比HCl的沸点高是由于HF分子间存在氢键B. 水在结冰时体积膨胀,是由于水分子之间存在氢键C. NH3的稳定性很强,是因为其分子间能形成氢键D. 在氨水中水分子和氨分子之间也存在着氢键【答案】 C 1245379689. (2023·南通如东高一期末)X、Y、Z、W、Q、R是原子序数依次增大的短周期主族元素,这些元素的主要化合价和原子半径的相关信息如下:1(1) 元素Q在元素周期表中的位置是__________________,其最高价氧化物对应的水化物和烧碱溶液反应的离子方程式为_________________________________。第三周期ⅢA族245379681(2) 相关比较(填“<”或“>”):①元素Y、Z最高价氧化物对应的水化物酸性:Y______Z。②元素W、Q简单离子半径:r(W)______r(Q)。(3) 写出由X、Y、Z、W四种元素共同组成的物质的化学式:______________________________________,其中所含化学键的类型有__________________。(4) Y、Z、W分别与X组成含10个电子的分子的化学式分别为__________、__________、__________。<>NH4HCO3或(NH4)2CO3离子键、共价键CH4NH3H2O谢谢观看Thank you for watching
相关资料
更多









