







人教版 (2019)选择性必修2第一节 共价键精品第一课时教案设计
展开(人教版高中化学选择性必修2)
《共价键》第一课时 教学设计
课题名 | 《共价键 》第一课时 |
教材分析 | 本节课在必修课程的基础上,运用第一章学过的原子轨道的概念,从原子轨道重叠的视角来进一步认识共价键的本质和特征,通过图片的方式描述了原子轨道重叠并形成共价键的过程,很形象地引出了共价键的主要类型σ键和π键。 |
核心素养 | 宏观辨识与微观探析:认识原子间通过原子轨道的重叠形成共价键,了解共价键具有饱和性、方向性。知道根据原子轨道的重叠方式,共价键可分为σ键和π键等类型。 证据推理与模型认知:理解共价键中σ键和π键的区别,建立判断σ键和π键的思维模型,熟练判断分子中σ键和π键的存在及个数。 科学探究与创新意识:从化学键的角度去认识有关物质,培养学生抽象思维能力,体现化学学科的魅力。 |
教学重点 | 理解共价键中σ键和π键的区别,建立判断σ键和π键的思维模型。 |
教学难点 | 熟练判断分子中σ键和π键的存在及个数。 |
教学方法 | 讲解,举例 |
教学准备 | 教师准备:PPT 学生准备:预习课本 |
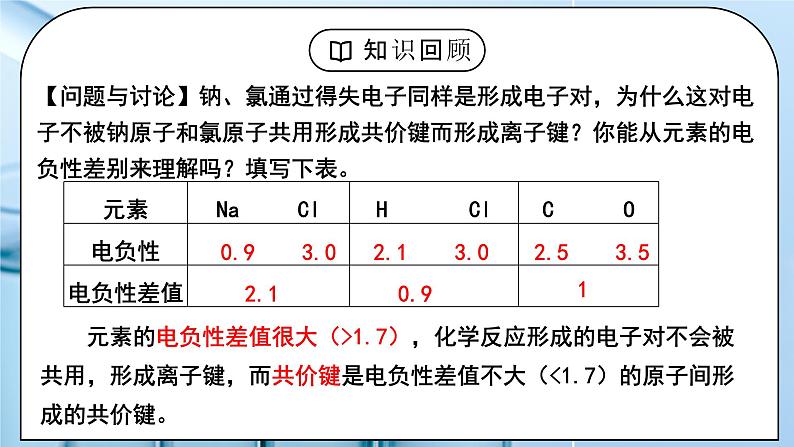
教学过程 | 一、新课导入 1.【问题与讨论】钠、氯通过得失电子同样是形成电子对,为什么这对电子不被钠原子和氯原子共用形成共价键而形成离子键?你能从元素的电负性差别来理解吗?填写下表。 教师: 元素的电负性差值很大(>1.7),化学反应形成的电子对不会被共用,形成离子键,而共价键是电负性差值不大(<1.7)的原子间形成的共价键。 学生:判断共价键和离子键 [设计意图]从电子得失和电负性的角度认识共价键和离子键 二、探究新知 1.一、共价键 教师:1、概念:原子间通过共用电子对所形成的相互作用。 2、本质:原子间通过共用电子对(即电子云重叠)产生的强烈作用。 3、成键粒子:原子。 4、形成条件:一般非金属元素构成+AlCl3、BeCl2 注意:氯化铝属于共价化合物,铵盐属于离子化合物,铵根和阴离子之间是离子键。 【思考与交流】 H2、HCl、Cl2均通过共用电子对相结合,为什么难以形成H3、H2Cl、Cl3等分子? 5.共价键的特征 (1)共价键具有饱和性:按照共用电子对理论, 一个原子有几个未成对电子,便可和几个自旋相反的电子配对成键,这就是共价键的“饱和性”;如果原子没有未成对电子,则不能形成共价键。 而H原子、Cl原子都只有一个未成对电子,因而只能形成H2、HCl、Cl2分子,不能形成H3、H2Cl、Cl3等分子。 共价键的饱和性决定了共价化合物的分子组成。 (2)共价键具有方向性: 除s轨道是球形对称外。其他原子轨道在空间都具有一定的形状,在形成共价键时,原子轨道重叠的越多,电子在核间出现的概率越大,所形成的共价键就越牢固,因此共价键将尽可能沿着电子出现概率最大的方向形成,所以共价键必然具有方向性。 共价键的方向性决定着分子的空间结构 注意:并非所有共价键都有方向性,如只有s轨道重叠形成的共价键。
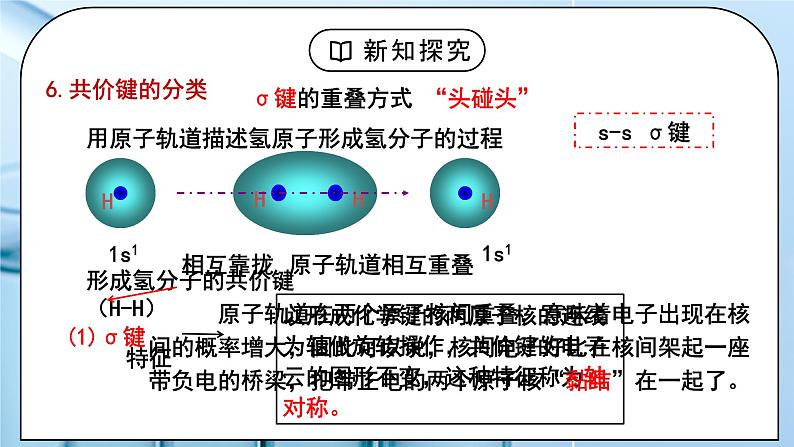
(1)σ键 σ键的重叠方式 “头碰头” 用原子轨道描述氢原子形成氢分子的过程:s-s σ键 H―Cl的s-p σ键形成:s-p σ键 Cl―Cl的p-p σ键形成:p-p σ键 (2)π键 π键是有两个原子的p轨道“肩并肩” 特征:每个π键的电子云有两块组成,它们互为镜像,这种特征称为镜面对称。 注意:没有s-sπ键和s-pπ键。因为s能级只有一个轨道。 N2中N≡N里的p-pσ键和p-pπ键的形成过程 O2 中O=O的 p-p σ键和 p-p π键的形成过程 (3)σ 键特征: ①轴对称:以形成化学键的两原子核的连线为轴作旋转操作,共价键②强度大:“头碰头”重叠形成σ键的原子轨道重叠程度较大,故σ键有较强稳定性。 电子云的图形不变,这种特征称为轴对称。 ③可旋转:以形成σ键的两原子核的连线为轴,任何一个原子均可以旋转,旋转时并不破坏σ键的结构。 π 键特征: ①镜面对称:每个π键的电子云由两块组成,分别位于由两原子核 构成平面的两侧,如果以它们之间包含原子核的平面为镜面,它们互为镜像,这种特征称为镜面对称。 ②强度小:形成π键时电子云重叠程度比σ键小,π键不如σ键牢固,易断裂(如乙烯、乙炔易发生加成反应)。特例:N2分子中的π键比σ键稳定。 ③不能旋转:以形成π键的两个原子核的连线为轴,任意一个原子并不能单独旋转,若单独旋转则会破坏π键,如以py-py π键为例,若旋转其中一个成键原子,则两原子的py轨道不再平行,也就无法“肩并肩”。 (4)判断σ键、π键的一般规律 ①s-s电子、s-p电子只形成σ键;p-p电子既形成σ键,又形成π键;且 p-p电子先形成σ键,后形成π键。 ②共价单键是σ键;共价双键中有一个σ键,另一个是π键;共价三键由一个σ键和两个π键构成。 探究: [问题与预测](1)观察乙烷、乙烯和乙炔的分子结构,它们的分子中的共价键分别由几个σ键和几个π键构成? (2)解释乙烯分子中π键是如何形成的,预测乙炔分子中π键是如何形成的。 乙烯分子中π键由一个2p轨道重叠形成的 解析:乙烯分子的碳原子采取sp2轨道杂化,2个碳原子各以2个sp2杂化轨道与氢原子形成2个碳氢σ键,而2个碳原子之间又各以1个sp2杂化轨道形成1个碳碳σ键,除此之外,2个碳原子中未参加杂化的p轨道形成了1个π键,因此,乙烯的双键中有1个σ键和1个π键。乙炔分子的碳原子采取sp轨道杂化,2个碳原子各以1个sp杂化轨道与氢原子形成1个碳氢σ键,同时又各以其另一个sp杂化轨道形成1个碳碳σ键,除此之外,每个碳原子通过2个未参加杂化的p轨道形成了2个π键 (暂不作要求) [绘制图示]模仿图2-3,绘制乙炔分子中的π键。 (3)乙烯和乙炔的化学性质为什么比乙烷活泼? 解析:乙烯分子中的碳碳双键和乙炔分子中的碳碳三键中分别含有1个和2个π键,π键原子轨道重叠程度较小,不稳定,容易断裂。而乙烷分子中没有π键,σ键原子轨道重叠程度大,比较稳定,不易断裂。 (4)在气体单质分子中,一定含有σ键,可能含有π键吗? 解析:稀有气体的单质分子中不含化学键;多原子分子中一定含有σ键,可能含有π键 学生:练习1、下列说法正确的是( ) A.Cl2是双原子分子,H2S是三原子分子,这是由共价键的方向性决定的 B.H2O与H2S的空间结构一样是由共价键的饱和性决定的 C.并非所有的共价键都有方向性 D.两原子轨道发生重叠后,电子在两核间出现的概率减小 练习2、判断正误 (1)所有共价键都有饱和性( ) (2)N2分子中σ键与π键的个数比是2∶1( ) (3)CO2分子中有一个σ键和一个π键( ) (4)一般来说,σ键比π键强度大,更稳定( ) (5)形成Cl2分子时,p轨道的重叠方式可以为 ( ) (6)σ键和π键都只存在于共价化合物中( ) (7)共价键的饱和性是由成键原子的未成对电子数决定的( ) (8)共价键的方向性是由成键原子轨道的方向性决定的( ) (9)原子轨道在空间都具有方向性( ) (10)成键后体系能量降低,趋于稳定( ) 练习3、下列说法对σ键和π键的认识不正确的是( ) A.分子中只要含有共价键,则至少含有一个σ键 B.s-s σ键、p-p σ键与s-p σ键都是轴对称的 C.p-p σ键和p-p π键的重叠方式是相同的 D.含有π键的分子在反应时,π键一般是化学反应的积极参与者 练习4、
(1)分子中σ键和π键的比例为______。 (2)已知反应N2O4(l)+2N2H4(l)===3N2(g)+4H2O(l),若该反应中有4 mol N—H断裂,则形成的π键的数目为______。 练习5、
(1)1 mol HCHO含σ键的数目为______。(NA为阿伏加德罗常数)。 (2)CS2分子中的共价键的类型有______。 (3)Ni(CO)4是正四面体化合物,1 mol Ni(CO)4中含有______mol σ键。 (4)石墨烯是由单层碳原子构成的平面结构新型材料,下图中1号C与相邻C形成σ键的个数为 ______。 [设计意图]从原子轨道重叠的视角来重新认识共价键,知道共价键的主要类型σ键和π键。 |
板书设计 | 一、共价键 1、概念: 2、本质: 3、成键粒子: 4、形成条件: 5.共价键的特征 饱和性、方向性 6.共价键的分类 (1)σ键:①轴对称②强度大③可旋转 (2)π键:①镜面对称②强度小③不能旋转 (3)判断σ键、π键的一般规律 |
课后作业 |
练习册上相关习题。 |
教学反思 | 亮点:在必修课已经对共价键进行了初步学习的基础上,本节内容从原子轨道重叠的视角来重新认识共价键,通过图片和动画的方式描述了原子轨道重叠并形成共价键的过程,很形象地引出了共价键的主要类型σ键和π键。 课堂教学建议:本节课要求学生认识原子间通过原子轨道的重叠形成共价键,了解共价键具有饱和性、方向性。知道根据原子轨道的重叠方式,共价键可分为σ键和π键等类型。理解共价键中σ键和π键的区别,建立判断σ键和π键的思维模型,熟练判断分子中σ键和π键的存在及个数。本节课内容较抽象,教师应结合图片,动画模拟帮助学生理解。 |
人教版 (2019)选择性必修2第三章 晶体结构与性质第四节 配合物与超分子精品教学设计及反思: 这是一份人教版 (2019)选择性必修2第三章 晶体结构与性质第四节 配合物与超分子精品教学设计及反思,文件包含核心素养人教版高中化学选修二《配合物与超分子》课件pptx、核心素养人教版高中化学选修二《配合物与超分子》教学设计含教学反思docx等2份教案配套教学资源,其中教案共12页, 欢迎下载使用。
高中化学人教版 (2019)选择性必修2第二节 分子晶体与共价晶体优质第一课时教案: 这是一份高中化学人教版 (2019)选择性必修2第二节 分子晶体与共价晶体优质第一课时教案,文件包含核心素养人教版高中化学选修二《分子晶体与共价晶体》第一课时课件pptx、核心素养人教版高中化学选修二《分子晶体与共价晶体》第一课时教学设计含教学反思docx等2份教案配套教学资源,其中教案共7页, 欢迎下载使用。
化学选择性必修2第二节 分子的空间结构优秀第一课时教案: 这是一份化学选择性必修2第二节 分子的空间结构优秀第一课时教案,文件包含核心素养人教版高中化学选修二《分子的空间结构》第一课时课件pptx、核心素养人教版高中化学选修二《分子的空间结构》第一课时教学设计含教学反思docx等2份教案配套教学资源,其中教案共8页, 欢迎下载使用。














