



2024届高三化学高考备考一轮复习专题:原子结构 核外电子排布课件
展开导航•课标要求 1.结合有关数据和实验事实认识原子结构,知道元素、核素的涵义。2.了解原子核外电子的排布,能画出 1~20 号元素的原子结构示意图。3.知道原子核外电子的能级高低顺序,了解构造原理,能结合能量最低原理、泡利不相容原理、洪特规则书写1~36 号元素基态原子的核外电子排布式和轨道表示式。4.能说明微观粒子的运动状态与宏观物体运动特点的差异。
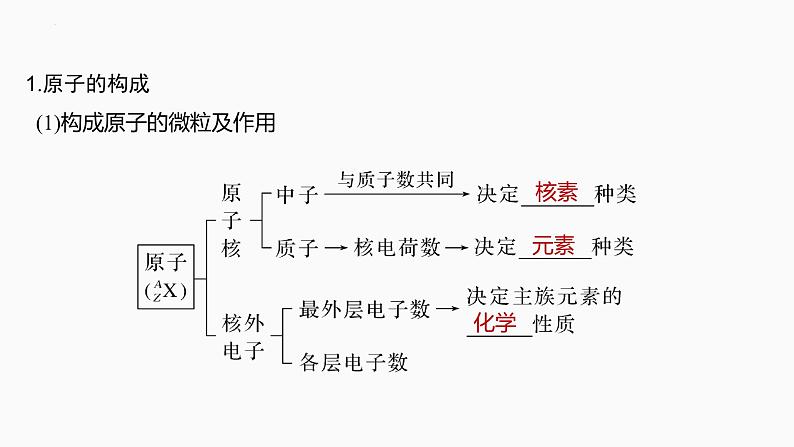
1.原子的构成 (1)构成原子的微粒及作用
(2)微粒之间的数量关系①原子中:质子数(Z)=核电荷数=____________;②质量数(A)=________ (Z)+________ (N);③阳离子的核外电子数=质子数____阳离子所带的电荷数;④阴离子的核外电子数=质子数____阴离子所带的电荷数。
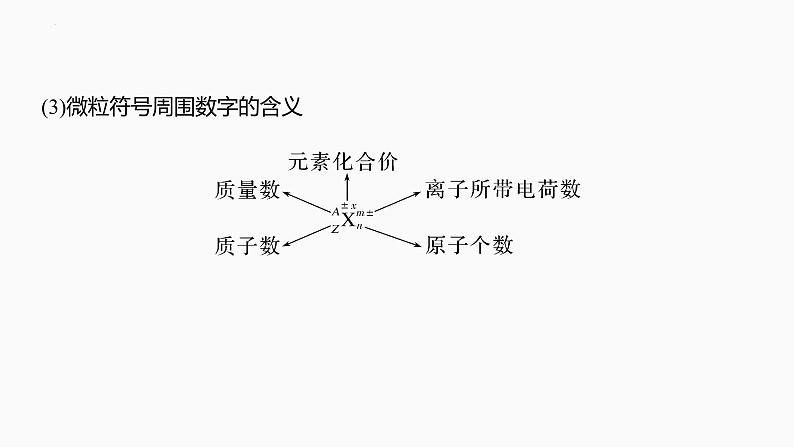
(3)微粒符号周围数字的含义
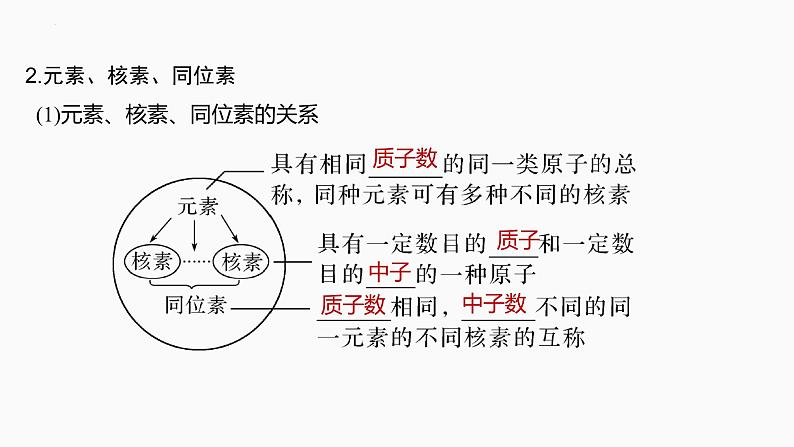
2.元素、核素、同位素 (1)元素、核素、同位素的关系
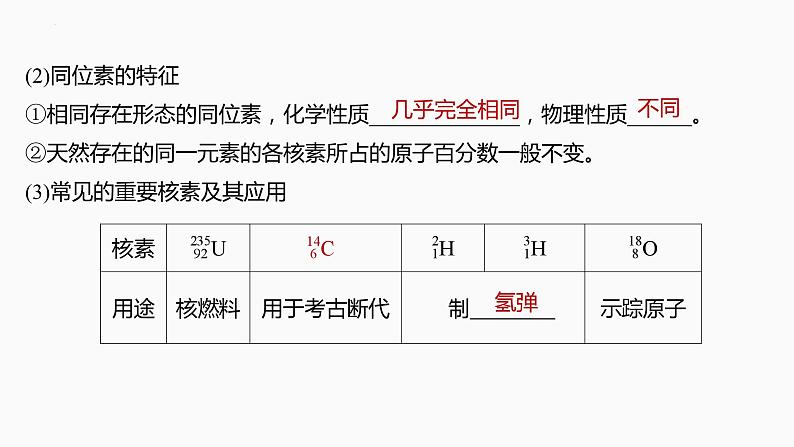
(2)同位素的特征①相同存在形态的同位素,化学性质______________,物理性质______。②天然存在的同一元素的各核素所占的原子百分数一般不变。(3)常见的重要核素及其应用
【判一判】 正误判断(正确打“√”,错误打“×”)。
答案 (1)× (2)× (3)× (4)× (5)√
题组一 微粒中“粒子数”的确定1.质子数和中子数之和为A,核内中子数为N的R2+与16O所形成的W g氧化物中 所含质子的物质的量为( )
2.某元素的一种同位素X原子的质量数为A,它与2H原子组成2HmX分子,此分子 含N个中子,在a g 2HmX中所含电子的物质的量是( )
【课堂点拨】 求一定质量的某物质中粒子数的答题模板
4.下列说法正确的是( )
【课堂点拨】 抓住描述对象突破“四同”判断
1.核外电子排布(电子层模型) (1)核外电子排布规律
2.能层(电子层)与能级 (1)能层:原子核外电子是分层排布的,根据电子的______不同,可将核外电子分成不同的能层。 (2)能级:同一能层电子的能量也可能不同,又将其分成不同的能级,通常用 ________________表示。能级种类数等于所在能层的能层序数。3.电子云与原子轨道 (1)电子云:处于一定空间运动状态的电子在原子核外空间的______________的形象化描述。
(2)原子轨道——电子云轮廓图
(1)电子自旋在空间有顺时针和逆时针两种取向,简称自旋相反,常用上下箭头(↑和↓)表示自旋______的电子。(2)能量相同的原子轨道(简并轨道),箭头表示一种__________的电子,“↑↓”称电子对,“↑”或“↓”称单电子(或称未成对电子)。箭头同向的单电子称自旋______。
5.基态原子的核外电子排布 (1)排布原则
(2)特例:当能量相同的原子轨道在全充满(p6、d10、f14)、半充满(p3、d5、f7)、全空(p0、d0、f0)时原子的能量最低,如24Cr的电子排布式为[Ar]3d54s1,29Cu的电子排布式为[Ar]3d104s1。(3)填充顺序——构造原理以光谱学事实为基础,从氢开始,随核电荷数递增,新增电子填入能级的顺序称为构造原理。
6.电子的跃迁与原子光谱 (1)电子的跃迁
(2)不同元素原子的电子发生跃迁时会______或______不同的光,可以用光谱仪摄取各种元素原子的吸收光谱或发射光谱,总称原子光谱。
答案 (1)× (2)× (3)× (4)× (5)× (6)×
题组一 核外电子排布特点及规律1.下列说法错误的是( )
A.电子排布式为1s22s22p63s23p1的元素, 其价态为+3时最稳定B.在同一能级上运动的电子,其运动状态肯定不同C.碳原子核外能量最高的电子云轮廓图如图所示D.钠原子由1s22s22p63p1→1s22s22p63s1时,吸收能量,由激发态转化成基态
2.下列电子排布式或电子排布图正确的是( )
题组二 核外电子排布的表示方法3.(1)基态F原子核外电子的运动状态有________种。
(2)基态硅原子最外层的电子排布图为__________________,(3)在KH2PO4的四种组成元素各自所能形成的简单离子中,核外电子排布相同的是________(填离子符号)。(4)Zn原子核外电子排布式为________________。(5)基态原子核外电子排布式为________________。(6)基态Ge原子的核外电子排布式为[Ar]__________________,有________________个未成对电子。
(7)镍元素基态原子的电子排布式为________________,3d能级上的未成对电子数为________________。(8)写出基态As原子的核外电子排布式:________________。
4.根据原子核外电子排布规则,回答下列问题:
(1)写出基态S原子的核外电子排布式:________________,写出基态24Cr原子的价层电子排布式:________________。(2)写出基态N原子的轨道表示式:________________。(3)若将基态14Si的电子排布式写成1s22s22p63s33p1,则它违背了_________________________。(4)Fe3+比Fe2+的稳定性更________(填“强”或“弱”),从结构上分析原因是______________________________。
(1)原子的电子排布式①简单原子:按照构造原理将电子依次填充到能量逐渐升高的能级中。如:14Si:1s22s22p63s23p2。②复杂原子:先按构造原理从低到高排列,然后将同能层的能级移到一起。如26Fe,先排列为:1s22s22p63s23p64s23d6,然后将同一能层的能级排到一起,即该原子的电子排布式为1s22s22p63s23p63d64s2。
(2)离子的电子排布式①判断该原子变成离子时会得到或失去多少个电子。②原子失去电子时,总是从能量高的能级失去电子,即失去电子的顺序是由外向里。一般来说,主族元素只失去它们的最外层电子,而副族和第Ⅷ族元素可能还会进一步向里失去内层电子。③原子得到电子而形成阴离子,则得到的电子填充在最外一个能层的某一个能级上。
(3)简化电子排布式如K:1s22s22p63s23p64s1,其简化电子排布式可表示为[Ar]4s1,其中[Ar]代表Ar的核外电子排布式,即1s22s22p63s23p6。(4)价层电子排布式如K:1s22s22p63s23p64s1,其价层电子排布式可表示为4s1。
6.已知A、B、C、D四种物质均是由短周期元素原子组成的,它们之间有如图所示的转化关系,且A是一种含有18电子的微粒,C是一种含有10电子的微粒。请完成下列各题:
(4)若A、B均是含2个原子核的微粒,其中B中含有10个电子,D中含有18个电子,则A、B之间发生的离子反应方程式为____________________________。(5)若D是一种含有22电子的分子,则符合如图关系的A的物质有____________(写物质的化学式,如果是有机物则写相应的结构简式)。答案 (4)HS-+OH-===S2-+H2O(5)CH3CH3、CH3OH
(1)寻找“10电子”微粒
(2)寻找“18电子”微粒
5.1 原子结构 原子核外电子排布(课件)-2024年高考化学一轮复习课件(全国通用): 这是一份5.1 原子结构 原子核外电子排布(课件)-2024年高考化学一轮复习课件(全国通用),共39页。PPT课件主要包含了链接高考等内容,欢迎下载使用。
2024届高考化学一轮复习原子结构 核外电子排布规律课件: 这是一份2024届高考化学一轮复习原子结构 核外电子排布规律课件,共60页。PPT课件主要包含了专项突破,归纳整合,p轨道,d轨道,f轨道,为什么等内容,欢迎下载使用。
2024年高考化学一轮总复习 第10单元 第1讲 原子结构 核外电子排布 课件: 这是一份2024年高考化学一轮总复习 第10单元 第1讲 原子结构 核外电子排布 课件,共60页。PPT课件主要包含了A-Z,核电荷数,核外电子数,元素化合价,质量数,离子所带电荷数,质子数,原子个数,考点二核外电子排布,能量不同等内容,欢迎下载使用。












