

人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第三节 盐类的水解第3课时学案
展开
这是一份人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第三节 盐类的水解第3课时学案,共12页。
1.了解盐类水解在生产生活、化学实验、科学研究中的应用。
2.能够对盐类水解的知识进行拓展迁移,解决类盐水解问题。
一、盐类水解的应用
1.在化学实验中的应用
2.在生产生活中的应用
3.盐溶液蒸干灼烧后所得产物的判断
(1)盐溶液水解生成难挥发性酸时,蒸干后一般得原物质,如CuSO4(aq)蒸干得CuSO4(s)。
(2)盐溶液水解生成易挥发性酸时,蒸干灼烧后一般得到对应的氧化物,如AlCl3(aq)蒸干得Al(OH)3,灼烧得Al2O3。
(3)考虑盐受热时是否分解。
(4)还原性盐在蒸干时会被O2氧化。如Na2SO3(aq)蒸干得Na2SO4(s)。
(1)盐溶液都可用磨口玻璃塞的试剂瓶盛放( )
(2)由于CH3COO-和NHeq \\al(+,4)相互促进水解,所以没有CH3COONH4溶液( )
(3)等浓度等体积的CH3COOH与NaOH溶液混合,恰好呈中性( )
1.实验室中如何用FeCl3晶体配制FeCl3溶液?为什么?
________________________________________________________________________________________________________________________________________________________________
2.Na2CO3不能用磨口玻璃塞的试剂瓶储存,还有哪些试剂不能?
________________________________________________________________________________________________________________________________________________________________
3.已知Cu2+、Fe2+、Fe3+完全水解时,溶液的pH分别为6.4、9.6、3.7。如何除去CuCl2溶液中的Fe3+、Fe2+?
________________________________________________________________________________________________________________________________________________________________
1.下列事实,其中与盐类的水解有关的是________(填序号)。
①NaHSO4溶液呈酸性
②长期使用(NH4)2SO4化肥会使土壤酸性增大,发生板结
③配制CuCl2溶液,用稀盐酸溶解CuCl2固体
④实验室盛放纯碱溶液的试剂瓶不能用磨口玻璃塞
⑤加热FeCl3·6H2O晶体,往往得不到FeCl3固体
2.将下列固体物质溶于水,再将其溶液加热、蒸发结晶,再灼烧,得到化学组成与原固体物质相同的是______(填序号)。
①胆矾 ②氯化铝 ③硫酸铝 ④氯化铜 ⑤硫酸亚铁 ⑥碳酸钠 ⑦亚硫酸钠 ⑧NH4Cl ⑨KMnO4 ⑩Ca(HCO3)2
二、广义水解
广义的盐类水解观认为就是某化合物与水发生复分解,化合物中显正价的离子结合OH-,显负价的离子结合H+。包括盐类水解和类盐水解,类盐虽然不是由酸碱中和后得到的生成物,但也具有盐的水解等性质的一类化合物。
1.类盐水解通式为:AmBn+mnH2OmA(OH)n+nHmB
2.中学阶段常见的类盐水解反应
(1)金属氢化物
NaH+H2O===________________________________________________
CaH2+2H2O===______________________________________________
(2)金属氮化物、磷化物
Li3N+3H2O===______________________________________________
Ca3P2+6H2O===______________________________________________
AlP+3H2O===__________________________________________________
(3)金属碳化物
CaC2+2H2O===_________________________________________________
Al4C3+12H2O===________________________________________________
Mg2C3+4H2O===________________________________________________
(4)卤素互化物
IBr+H2O===______________________________________________________
IF5+3H2O===_____________________________________________________
(5)非金属元素的卤化物
NH2Cl+H2O__________________________________________________
NCl3+3H2O===_____________________________________________________
BCl3+3H2O===______________________________________________________
PCl3+3H2O===______________________________________________________
PCl5+4H2O===______________________________________________________
SiCl4+4H2O===______________________________________________________
1.(2022·郑州高二月考)广义的水解观认为:无论是盐的水解还是非盐的水解,其最终结果是反应中各物质和水分别解离成两部分,然后两两重新组合成新的物质。根据上述观点,下列说法错误的是( )
A.BaO2的水解产物是Ba(OH)2和H2O2
B.PCl3的水解产物是HClO和H3PO3
C.Al4C3的水解产物是Al(OH)3和CH4
D.CH3COCl的水解产物是两种酸
2.(2022·绵阳高二检测)实验室可利用SbCl3的水解反应制取Sb2O3:
(1)SbCl3水解的化学方程式为_______________________________________________。
(2)为得到较多较纯的Sb2O3,操作时将SbCl3徐徐加入大量水中,反应后期还要加入少量________(填字母)。
A.氨水 B.盐酸 C.醋酸
(3)SOCl2是一种液态化合物,将其滴入水中,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味气体逸出,该气体可使品红溶液褪色。
①根据实验现象写出SOCl2和H2O反应的化学方程式:_______________________。
②利用AlCl3·6H2O制备无水AlCl3时,可用SOCl2和AlCl3·6H2O混合共热,试解释原因:
________________________________________________________________________
________________________________________________________________________。
第3课时 盐类水解的应用及广义水解
[核心素养发展目标] 1.了解盐类水解在生产生活、化学实验、科学研究中的应用。2.能够对盐类水解的知识进行拓展迁移,解决类盐水解问题。
一、盐类水解的应用
1.在化学实验中的应用
2.在生产生活中的应用
3.盐溶液蒸干灼烧后所得产物的判断
(1)盐溶液水解生成难挥发性酸时,蒸干后一般得原物质,如CuSO4(aq)蒸干得CuSO4(s)。
(2)盐溶液水解生成易挥发性酸时,蒸干灼烧后一般得到对应的氧化物,如AlCl3(aq)蒸干得Al(OH)3,灼烧得Al2O3。
(3)考虑盐受热时是否分解。
(4)还原性盐在蒸干时会被O2氧化。如Na2SO3(aq)蒸干得Na2SO4(s)。
(1)盐溶液都可用磨口玻璃塞的试剂瓶盛放( )
(2)由于CH3COO-和NHeq \\al(+,4)相互促进水解,所以没有CH3COONH4溶液( )
(3)等浓度等体积的CH3COOH与NaOH溶液混合,恰好呈中性( )
答案 (1)× (2)× (3)×
1.实验室中如何用FeCl3晶体配制FeCl3溶液?为什么?
提示 将FeCl3晶体溶于较浓的盐酸中,然后加水稀释到所需的浓度;加酸抑制FeCl3水解。
2.Na2CO3不能用磨口玻璃塞的试剂瓶储存,还有哪些试剂不能?
提示 因为玻璃的主要成分是SiO2,SiO2能和碱反应,因此碱溶液及水解呈碱性的盐溶液,如NaOH、KOH、Na2S、Na2SiO3等都不能用磨口玻璃塞的试剂瓶储存。
3.已知Cu2+、Fe2+、Fe3+完全水解时,溶液的pH分别为6.4、9.6、3.7。如何除去CuCl2溶液中的Fe3+、Fe2+?
提示 因Fe2+比Cu2+难水解,应先加入氧化剂(如H2O2)把Fe2+氧化为Fe3+,再加入CuO、Cu(OH)2、CuCO3或Cu2(OH)2CO3等,促进Fe3+水解生成Fe(OH)3沉淀而除去。
1.下列事实,其中与盐类的水解有关的是________(填序号)。
①NaHSO4溶液呈酸性
②长期使用(NH4)2SO4化肥会使土壤酸性增大,发生板结
③配制CuCl2溶液,用稀盐酸溶解CuCl2固体
④实验室盛放纯碱溶液的试剂瓶不能用磨口玻璃塞
⑤加热FeCl3·6H2O晶体,往往得不到FeCl3固体
答案 ②③④⑤
解析 ①中NaHSO4为强酸强碱的酸式盐,不发生水解,显酸性是因为在溶液中电离出的H+所致;②中是NHeq \\al(+,4)水解显酸性所致;③中HCl会抑制Cu2+水解;④中碳酸钠水解呈碱性;⑤加热时FeCl3会发生水解。
2.将下列固体物质溶于水,再将其溶液加热、蒸发结晶,再灼烧,得到化学组成与原固体物质相同的是______(填序号)。
①胆矾 ②氯化铝 ③硫酸铝 ④氯化铜 ⑤硫酸亚铁 ⑥碳酸钠 ⑦亚硫酸钠 ⑧NH4Cl ⑨KMnO4 ⑩Ca(HCO3)2
答案 ③⑥
解析 ①胆矾(CuSO4·5H2O)溶于水得CuSO4溶液,因硫酸难挥发,蒸发结晶,再灼烧得CuSO4;②AlCl3、④CuCl2发生水解:AlCl3+3H2OAl(OH)3+3HCl、CuCl2+2H2OCu(OH)2+2HCl,加热时HCl不断挥发,平衡右移,不断生成Al(OH)3、Cu(OH)2沉淀,灼烧得Al2O3、CuO;③Al2(SO4)3+6H2O2Al(OH)3+3H2SO4,硫酸难挥发,最终仍得Al2(SO4)3;⑤硫酸亚铁在蒸干过程中易被氧化;⑦亚硫酸钠易被氧化生成硫酸钠;⑧NH4Cl、⑨KMnO4、⑩Ca(HCO3)2蒸干灼烧过程中分解。
二、广义水解
广义的盐类水解观认为就是某化合物与水发生复分解,化合物中显正价的离子结合OH-,显负价的离子结合H+。包括盐类水解和类盐水解,类盐虽然不是由酸碱中和后得到的生成物,但也具有盐的水解等性质的一类化合物。
1.类盐水解通式为:AmBn+mnH2OmA(OH)n+nHmB
2.中学阶段常见的类盐水解反应
(1)金属氢化物
NaH+H2O===NaOH+H2↑
CaH2+2H2O===Ca(OH)2+2H2↑
(2)金属氮化物、磷化物
Li3N +3H2O===3LiOH_+NH3↑
Ca3P2+6H2O===3Ca(OH)2+2PH3↑
AlP+3H2O===Al(OH)3↓+PH3↑
(3)金属碳化物
CaC2+2H2O===Ca(OH)2+C2H2↑
Al4C3+12H2O===4Al(OH)3↓+3CH4↑
Mg2C3+4H2O===2Mg(OH)2↓+C3H4↑
(4)卤素互化物
IBr+H2O===HIO+HBr
IF5+3H2O===HIO3+5HF
(5)非金属元素的卤化物
NH2Cl + H2ONH3+HClO
NCl3+3H2O===3HClO+NH3
BCl3+3H2O===H3BO3+3HCl
PCl3+3H2O===H3PO3+3HCl
PCl5+4H2O===H3PO4+5HCl
SiCl4+4H2O===H4SiO4↓+4HCl
1.(2022·郑州高二月考)广义的水解观认为:无论是盐的水解还是非盐的水解,其最终结果是反应中各物质和水分别解离成两部分,然后两两重新组合成新的物质。根据上述观点,下列说法错误的是( )
A.BaO2的水解产物是Ba(OH)2和H2O2
B.PCl3的水解产物是HClO和H3PO3
C.Al4C3的水解产物是Al(OH)3和CH4
D.CH3COCl的水解产物是两种酸
答案 B
解析 水解是反应中各物质和水分别解离成两部分,然后两两重新组合成新的物质,该反应相当于复分解反应,反应过程中没有电子转移,其特征是没有元素化合价升降。BaO2的水解产物是Ba(OH)2和H2O2,该反应中没有元素化合价升降,符合水解原理,A项正确;该反应中Cl元素化合价由-1变为+1,有电子转移,不符合水解原理,B项错误;Al4C3水解得到氢氧化铝和甲烷,符合水解原理,C项正确;CH3COCl的水解产物是CH3COOH和HCl,符合水解原理,D项正确。
2.(2022·绵阳高二检测)实验室可利用SbCl3的水解反应制取Sb2O3:
(1)SbCl3水解的化学方程式为_______________________________________________。
(2)为得到较多较纯的Sb2O3,操作时将SbCl3徐徐加入大量水中,反应后期还要加入少量________(填字母)。
A.氨水 B.盐酸 C.醋酸
(3)SOCl2是一种液态化合物,将其滴入水中,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味气体逸出,该气体可使品红溶液褪色。
①根据实验现象写出SOCl2和H2O反应的化学方程式:________________________。
②利用AlCl3·6H2O制备无水AlCl3时,可用SOCl2和AlCl3·6H2O混合共热,试解释原因:________________________________________________________________________
________________________________________________________________________。
答案 (1)2SbCl3+3H2OSb2O3+6HCl (2)A
(3)①SOCl2+H2O===SO2↑+2HCl↑ ②SOCl2和结晶水反应既能消耗水,生成的酸又能抑制AlCl3水解
解析 (2)水解产生HCl的H+浓度越高,水解反应越难进行,加多点水pH越接近7,有利于水解反应的进行;而后期Sb3+浓度很低,靠单纯的水解很难再反应下去,已经达到水解平衡,所以要加NH3·H2O促进水解。
(3)①SOCl2和水剧烈反应,液面上有白雾生成,说明生成的气体遇水蒸气能形成小液滴,则气体中含有HCl;还生成气体,该气体能使品红溶液褪色,说明该气体具有漂白性,生成物中含有二氧化硫,所以该反应的化学方程式为SOCl2+H2O===SO2↑+2HCl↑。②SOCl2与水剧烈反应生成HCl而抑制铝离子水解,且SOCl2与水反应又减少了水的量,所以能得到氯化铝固体。
应用
举例
判断溶液的酸碱性(谁强显谁性,同强显中性)
FeCl3溶液显酸性,原因是_______________________
判断酸性强弱
相同浓度的NaX、NaY、NaZ溶液的pH分别为8、9、10,则酸性:
配制或贮存易水解的盐溶液
配制CuSO4溶液时,加入少量 ,抑制Cu2+水解;贮存Na2CO3溶液不能用 玻璃塞
胶体的制取
制取Fe(OH)3胶体的离子反应:_________________
制备无水盐
将挥发性酸的弱碱盐如AlCl3、FeCl3溶液蒸干时,在通HCl的气流中加热蒸干
判断离子是否共存
Al3+与COeq \\al(2-,3)、HCOeq \\al(-,3)、S2-、HS-、AlOeq \\al(-,2);Fe3+与HCOeq \\al(-,3)、COeq \\al(2-,3)、AlOeq \\al(-,2);NHeq \\al(+,4)与AlOeq \\al(-,2)、SiOeq \\al(2-,3)因相互促进水解强烈而不能大量共存
判断中和反应至中性的试剂用量
如NH3·H2O与HCl反应至中性时, 过量,CH3COOH与NaOH反应至中性时, 过量
制备无机化合物
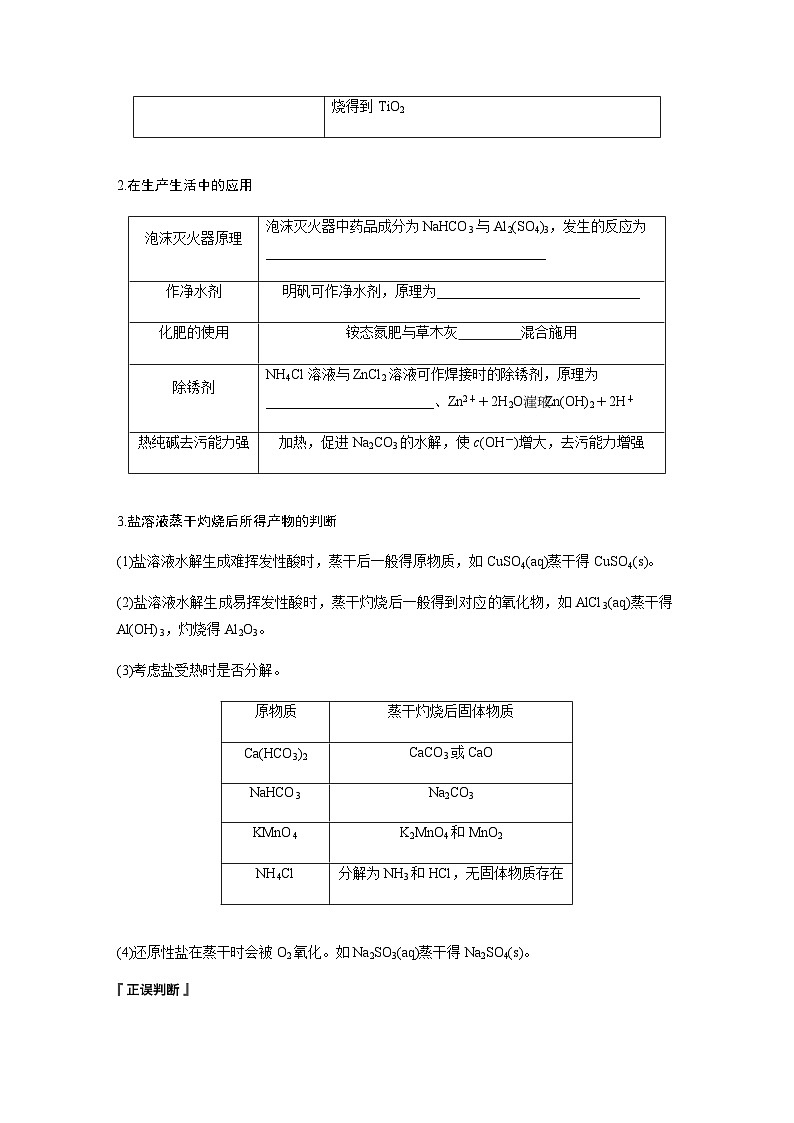
如用TiCl4制备TiO2,其反应的化学方程式为_______________________________,加入大量的水,同时加热,促使水解趋于完全,所得TiO2·xH2O经焙烧得到TiO2
泡沫灭火器原理
泡沫灭火器中药品成分为NaHCO3与Al2(SO4)3,发生的反应为________________________________________
作净水剂
明矾可作净水剂,原理为_____________________________
化肥的使用
铵态氮肥与草木灰 混合施用
除锈剂
NH4Cl溶液与ZnCl2溶液可作焊接时的除锈剂,原理为________________________、Zn2++2H2OZn(OH)2+2H+
热纯碱去污能力强
加热,促进Na2CO3的水解,使c(OH-)增大,去污能力增强
原物质
蒸干灼烧后固体物质
Ca(HCO3)2
CaCO3或CaO
NaHCO3
Na2CO3
KMnO4
K2MnO4和MnO2
NH4Cl
分解为NH3和HCl,无固体物质存在
应用
举例
判断溶液的酸碱性(谁强显谁性,同强显中性)
FeCl3溶液显酸性,原因是Fe3++3H2OFe(OH)3+3H+
判断酸性强弱
相同浓度的NaX、NaY、NaZ溶液的pH分别为8、9、10,则酸性:HX>HY>HZ
配制或贮存易水解的盐溶液
配制CuSO4溶液时,加入少量H2SO4,抑制Cu2+水解;贮存Na2CO3溶液不能用磨口玻璃塞
胶体的制取
制取Fe(OH)3胶体的离子反应:Fe3++3H2Oeq \(=====,\s\up7(△))Fe(OH)3(胶体)+3H+
制备无水盐
将挥发性酸的弱碱盐如AlCl3、FeCl3溶液蒸干时,在通HCl的气流中加热蒸干
判断离子是否共存
Al3+与COeq \\al(2-,3)、HCOeq \\al(-,3)、S2-、HS-、AlOeq \\al(-,2);Fe3+与HCOeq \\al(-,3)、COeq \\al(2-,3)、AlOeq \\al(-,2);NHeq \\al(+,4)与AlOeq \\al(-,2)、SiOeq \\al(2-,3)因相互促进水解强烈而不能大量共存
判断中和反应至中性的试剂用量
如NH3·H2O与HCl反应至中性时,NH3·H2O过量,CH3COOH与NaOH反应至中性时,CH3COOH过量
制备无机化合物
如用TiCl4制备TiO2,其反应的化学方程式为TiCl4+(x+2)H2O===TiO2·xH2O↓+4HCl,加入大量的水,同时加热,促使水解趋于完全,所得TiO2·xH2O经焙烧得到TiO2
泡沫灭火器原理
泡沫灭火器中药品成分为NaHCO3与Al2(SO4)3,发生的反应为Al3++3HCOeq \\al(-,3)===Al(OH)3↓+3CO2↑
作净水剂
明矾可作净水剂,原理为Al3++3H2OAl(OH)3(胶体)+3H+
化肥的使用
铵态氮肥与草木灰不能混合施用
除锈剂
NH4Cl溶液与ZnCl2溶液可作焊接时的除锈剂,原理为NHeq \\al(+,4)+H2ONH3·H2O+H+、Zn2++2H2OZn(OH)2+2H+
热纯碱去污能力强
加热,促进Na2CO3的水解,使c(OH-)增大,去污能力增强
原物质
蒸干灼烧后固体物质
Ca(HCO3)2
CaCO3或CaO
NaHCO3
Na2CO3
KMnO4
K2MnO4和MnO2
NH4Cl
分解为NH3和HCl,无固体物质存在
相关学案
这是一份人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第三节 盐类的水解第2课时学案,共14页。
这是一份高中化学人教版 (2019)选择性必修1第三节 盐类的水解第1课时导学案,共12页。
这是一份化学选择性必修1第三章 水溶液中的离子反应与平衡实验活动3 盐类水解的应用精品学案,共5页。学案主要包含了影响盐类水解的外界因素,盐类水解的应用等内容,欢迎下载使用。










