






第五讲 离子共存、离子检验与推断(课件)-【大一轮课堂】2024年高考化学大一轮复习课件+习题
展开这是一份第五讲 离子共存、离子检验与推断(课件)-【大一轮课堂】2024年高考化学大一轮复习课件+习题,共60页。PPT课件主要包含了复习目标,离子共存,思想在线,特别提醒,离子的检验与推断,离子检验操作现象描述,真题验收制胜高考,知能训练素养落实等内容,欢迎下载使用。
1.掌握离子共存的条件,会判断溶液中离子能否大量共存。2.了解常见离子的检验方法。3.能利用典型代表物的性质和反应,进行离子的推断和设计常见物质检验的方案。
考点二 离子的检验与推断
考点三 答题规范-离子检验操作现象描述
几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
2.判断离子能否大量共存的“四个要点”
判断多种离子能否大量共存于同一溶液中,归纳起来是一色、二性、三特殊、四反应。
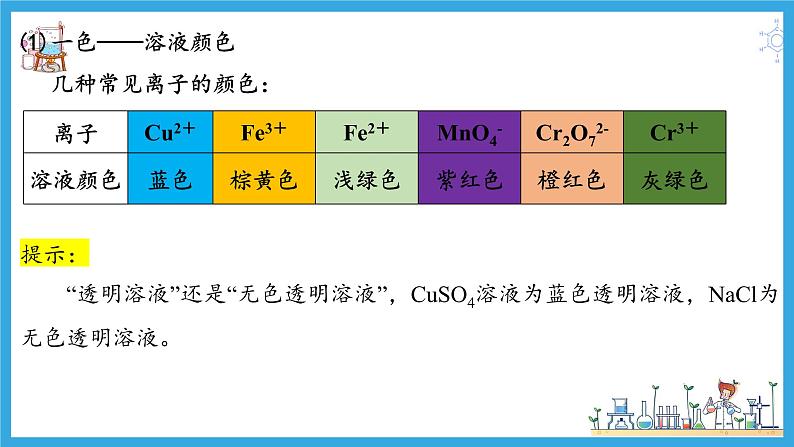
(1)一色——溶液颜色 几种常见离子的颜色:
提示: “透明溶液”还是“无色透明溶液”,CuSO4溶液为蓝色透明溶液,NaCl为无色透明溶液。
(2)二性——溶液的酸碱性①在强酸性溶液中,OH-及弱酸酸根离子(如CO32-、SO32-、S2-、CH3COO-等)不能大量存在。②在强碱性溶液中,H+及弱碱阳离子(如NH4+、Al3+、Fe3+等)不能大量存在
(3)三特殊——三种特殊情况①AlO2-与HCO3-不能大量共存: AlO2-+HCO3-+H2O===Al(OH)3↓+CO32-。②“NO3-+H+”组合具有强氧化性,能与S2-、Fe2+、I-、SO32-等还原性的离子发生氧化还原反应而不能大量共存。③NH4+与CH3COO-、CO32-等组合中,虽然两种离子都能水解且水解相互促进,但总的水解程度仍很小,它们在溶液中仍能大量共存。
(4)四反应——四种反应类型①复分解反应:如Ba2+与SO42-,NH4+与OH-,H+与CH3COO-等。
a、因生成难电离的物质或气体不能大量共存
b、因生成沉淀(或微溶性物质)不能大量共存
Fe2+、Pb2+、Cu2+、Ag+
Mg2+、Pb2+、Zn2+、Cu2+、Fe2+
Cu2+、Fe2+、Fe3+、Al3+
【思维在线】强氧化性与强还原性的离子(或分子)在溶液中会发生氧化还原反应不能大量共存。判断下表中所列离子能否发生氧化还原反应,能反应的打“√”,不能反应的打“×”。
③相互促进的水解反应:
①Al3+与 、 、 、 、②Fe3+与 、 、
④络合反应: Fe3+与SCN-因生成Fe(SCN)3而不能大量共存; Ag+与NH3·H2O因生成[Ag(NH3)2]+而不能大量共存; Cu2+与NH3·H2O因生成 [Cu(NH3)4]2+ 而不能大量共存。
【例】.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
在做有关离子共存题目时,还应注意题干中的“关键词”,如①“一定大量共存”还是“可能大量共存”。②“透明溶液”还是“无色透明溶液”, CuSO4溶液为蓝色透明溶液,NaCl为无色透明溶液。③“酸性”“碱性”或其他指定离子。
一、判断离子共存,注意附加条件1.下列溶液中,离子一定能大量共存的有哪些?
答案 (6)、(9)、(11)
二、因氧化还原反应不能大量共存的离子判断2.(1)S2-与 ,Cl—与ClO-在碱性条件下能否大量共存:______(填“能”或“不能”)。写出上述两组离子在酸性条件下反应的离子方程式:__________________________________、_______________________________。(2)判断下列几组离子能否大量共存,不能大量共存的说明理由。
+6H+===3S↓+3H2O
Cl-+ClO-+2H+===Cl2↑+H2O
不能,H2O2在酸性条件下
氧化Fe2+,离子方程式为2Fe2++H2O2+2H+===2Fe3++2H2O
3.(2023·湖北新高考联考协作体测试)常温时下列各组离子在指定溶液中一定能 大量共存的是( )
1.常见阳离子的检验与推断依据根据离子性质不同而在实验中所表现出的现象不同,可以把检验离子的方法归纳为三种类型: ①生成沉淀;②生成气体;③显现特殊颜色。(1)依据生成的沉淀检验或推断
(2)依据生成的气体检验或推断 产生使湿润的红色石蕊试纸 的气体。
2.常见阴离子的检验与推断依据(1)依据生成的沉淀检验或推断
(2)依据生成的气体检验或推断
(3)依据显示特殊颜色检验或推断
橙红色,表明有_____紫红色,表明有___
溶液变 ,表明有____
3.离子推断的“四原则”
1.向某溶液中加入BaCl2溶液,有白色沉淀生成,再加入稀盐酸,沉淀不消失,则溶液中一定存在 ( )2.向某溶液中加入Ba(NO3)2溶液,产生不溶于稀HNO3的白色沉淀,则溶液中一定存在 ( )3.向某溶液中加入Ca(OH)2溶液,有白色沉淀生成,则溶液中一定存在 ( )4.某溶液的焰色反应呈黄色,则溶液中一定有钠元素,不能确定是否有钾元素( )5.无色溶液加入CCl4无现象,滴加氯水后CCl4层呈紫红色,则溶液中一定存在I-( )6.向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的气体,溶液中一定存在 ( )
1.下列关于离子检验的说法正确的是A.检验溶液中是否含有Ba2+:取少量待测液,向其中加入少量稀硫酸,若有白色沉淀 产生,则溶液中含有Ba2+B.检验用硫酸亚铁制得的硫酸铁中是否含有硫酸亚铁,可选用的试剂是酸性KMnO4 溶液C.检验溶液中是否含有 :取少量待测液,向其中加入适量稀盐酸,观察是否有 大量气泡产生D.在未知溶液中滴加BaCl2溶液出现白色沉淀,加稀硝酸,沉淀不溶解,说明该未知 溶液中存在
一、常见离子的检验及干扰因素的识别
2.下列离子在未知溶液中的检验方法正确的是
离子检验中的常见干扰离子以及排除措施
实验操作(取少量或适量待检溶液于试管中,加入…试剂,再加入…试剂)⇓现象描述(①溶液由……变为……,②若有……生成,③若没有……等)⇓得出结论(如“若……说明……,若……说明……”)
(NH4)2SO4是常用的化肥和化工原料,受热易分解。某兴趣小组拟探究其分解产物。【查阅资料】(NH4)2SO4在260 ℃和400 ℃时分解产物不同。【实验探究】该小组拟选用下图所示装置进行实验(夹持和加热装置略)。
连接装置A-D-B,检查气密性,按图示重新加入试剂。通入N2排尽空气后,于400 ℃加热装置A至(NH4)2SO4完全分解无残留物,停止加热,冷却,停止通入N2。观察到装置A、D之间的导气管内有少量白色固体。经检验,该白色固体和装置D内溶液中有 。进一步研究发现,气体产物中无氮氧化物。检验装置D内溶液中有 的实验操作和现象是_____________________________________________________________________________________________________________________。
试管中,滴加BaCl2溶液,生成白色沉淀,加入足量稀盐酸后,沉淀完全溶解,放出无色有刺激性气味的气体
1.按要求回答下列问题:(1)结晶析出Na2S2O3·5H2O,其中可能含有Na2SO3、Na2SO4等杂质。利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作、现象和结论:____________________________________________________________________________________________________________________________________。已知Na2S2O3·5H2O遇酸易分解: +2H+===S↓+SO2↑+H2O供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液
取少量产品溶于足量稀盐酸,静置,取上层溶液(或过滤,取滤液)于一试管中,滴加BaCl2溶液,若产生白色沉淀则说明含有Na2SO4杂质(合理即可)
(2)榴石矿石可以看作由CaO、FeO、Fe2O3、Al2O3、SiO2组成。试设计实验证明榴石矿石中含有FeO(试剂任选,说明实验操作与现象):_______________________________________________________________________________________________________________。
取矿石少许,加稀硫酸充分
溶解后,向其中滴加酸性高锰酸钾溶液,若紫色褪去,证明矿石中含有FeO(不能加盐酸溶解)
2.(2022·全国乙卷,9)某白色粉末样品,可能含有Na2SO4、Na2SO3、Na2S2O3和Na2CO3。取少量样品进行如下实验:①溶于水,得到无色透明溶液;②向①的溶液中滴加过量稀盐酸,溶液变浑浊,有刺激性气体逸出,离心分离;③取②的上层清液,向其中滴加BaCl2溶液有沉淀生成。该样品中确定存在的是A.Na2SO4、Na2S2O3 B.Na2SO3、Na2S2O3C.Na2SO4、Na2CO3 D.Na2SO3、Na2CO3
3.(2022·广东,4)实验室进行粗盐提纯时,需除去Ca2+、Mg2+和 ,所用试剂包括BaCl2以及A.Na2CO3、NaOH、HClB.Na2CO3、HCl、KOHC.K2CO3、HNO3、NaOHD.Na2CO3、NaOH、HNO3
4.(2021·湖南卷)对下列粒子组在溶液中能否大量共存的判断和分析均正确的 是( )
5.(2020·全国卷Ⅱ,8)某白色固体混合物由NaCl、KCl、MgSO4、CaCO3中的两种组成,进行如下实验:①混合物溶于水,得到澄清透明溶液;②做焰色反应,通过钴玻璃可观察到紫色;③向溶液中加碱,产生白色沉淀。根据实验现象可判断其组成为A.KCl、NaCl B.KCl、MgSO4C.KCl、CaCO3 D.MgSO4、NaCl
6.(2021·福建卷)室温下,下列各组离子一定能与指定溶液共存的是( )
7.(2021·天津卷)常温下,下列各组离子在给定溶液中能大量共存的是( )
1.(2023·河南豫西名校测试)某溶液中含有下列离子,通入足量NO2后,离子依然能大量共存的是( )
3.(2022·黑龙江牡丹江市第二高级中学月考)下列离子可以在指定溶液中大量共存的是
4.在给定条件下,下列离子组能否大量共存的判断及对应的离子方程式书写不正确的是
5.(2022·广东实验中学高三月考)孔雀石的主要成分是Cu2(OH)2CO3(含Fe2O3、FeCO3、Al2O3、SiO2杂质),工业上用孔雀石制备硫酸铜的第一步用过量硫酸溶解并过滤。常温下,分别取滤液并向其中加入指定物质,反应后的溶液中大量存在的一组离子正确的是
6.某白色粉末由两种物质组成,为鉴别其成分进行如下实验:
①取少量样品加入足量水仍有部分固体未溶解;再加入足量稀盐酸,有气泡产生,固体全部溶解;②取少量样品加入足量稀硫酸有气泡产生,振荡后仍有固体存在。该白色粉末可能为( )A.NaHCO3、Al(OH)3 B.AgCl、NaHCO3C.Na2SO3、BaCO3 D.Na2CO3、CuSO4
7.根据下列实验内容得出的结论正确的是( )
8.某无色溶液可能由K2CO3、MgCl2、NaHCO3、BaCl2溶液中的一种或几种组成。取样,向溶液中加入烧碱溶液出现白色沉淀;另取样,加入稀硫酸也出现白色沉淀并放出气体。据此分析,下列判断中正确的是A.一定有MgCl2B.一定有MgCl2和NaHCO3C.一定有K2CO3D.一定有BaCl2和NaHCO3
9.经检测,某化工厂排出的废水呈酸性,且其中含有大量 Na+、Cu2+、H+ 、Cl-、 。回答下列问题:(1)下列离子中,能大量存在于该废水中的是____(填字母)。A.Ag+ B.Mg2+ C.OH- D.(2)取100 mL该废水于烧杯中,逐滴加入NaOH溶液至呈碱性过程中,原废水中存在的离子的量会发生变化的是Na+、___________(用离子符号表示)。
(3)某化学社团小组成员欲除去废水样品中的Cu2+和 ,最终得到中性溶液,设计的方案流程如图:①试剂c为__________(填化学式);溶液3所含溶质离子有Cl-、___________。
②“分离操作”的名称是_______,需用到的玻璃仪器主要有____________________。③向“白色沉淀2”中加入足量盐酸,发生反应的离子方程式为____________________________________。
BaCO3+2H+===
Ba2++H2O+CO2↑
10.今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、 、Cl-、 、 ,现取三份100 mL溶液进行如下实验:第一份加入AgNO3溶液有沉淀产生;第二份加入足量NaOH溶液加热后,只收集到气体0.02 ml,无沉淀生成,同时得到溶液甲;向溶液甲中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02 g;第三份加入足量BaCl2溶液后,得白色沉淀,沉淀经足量盐酸洗涤、干燥后,质量为11.65 g。已知:NaAlO2+2H2O+CO2===NaHCO3+Al(OH)3↓。根据上述实验回答:
(1)一定不存在的离子是_________________________,不能确定是否存在的离子是_____。(2)试确定溶液中肯定存在的离子及其浓度:①离子符号_____,浓度____________;②离子符号_____,浓度____________;③离子符号______,浓度____________。
(3)试确定K+是否存在?_____(填“是”或“否”),判断的理由是____________________________________。
14.有一未知的无色溶液,只可能含有以下离子中的若干种:H+、 、K+、Mg2+、Cu2+、Al3+、 ,现取三份100 mL溶液进行如下实验:①第一份加入足量AgNO3溶液后,有白色沉淀产生。②第二份加入足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99 g。③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图所示。
相关课件
这是一份2024届高考化学复习专题离子共存、离子的检验和推断课件,共20页。PPT课件主要包含了常见离子的检验方法,题组演练,答案C,考点二离子共存,答案A等内容,欢迎下载使用。
这是一份2024年高考化学一轮复习 第6讲 离子共存、离子检验与推断课件PPT,共60页。PPT课件主要包含了离子共存的判断,归纳整合,专项突破,离子的检验与推断,离子检验操作现象描述,真题演练明确考向,课时精练等内容,欢迎下载使用。
这是一份高中化学5 离子共存 离子的检验和推断-课件 2021届高三高考化学一轮复习,共26页。PPT课件主要包含了离子共存,OH-,Ag+,Ca2+,S2-,弱碱阳离子,Fe3+,Al3+,易错辨析,随堂练习等内容,欢迎下载使用。












