




2023届高考化学二轮复习专题五化学反应速率与化学平衡课件
展开这是一份2023届高考化学二轮复习专题五化学反应速率与化学平衡课件,共60页。PPT课件主要包含了高考调研明晰考向,答案C,答案D,核心整合热点突破,答案B等内容,欢迎下载使用。
专题五 化学反应速率与化学平衡
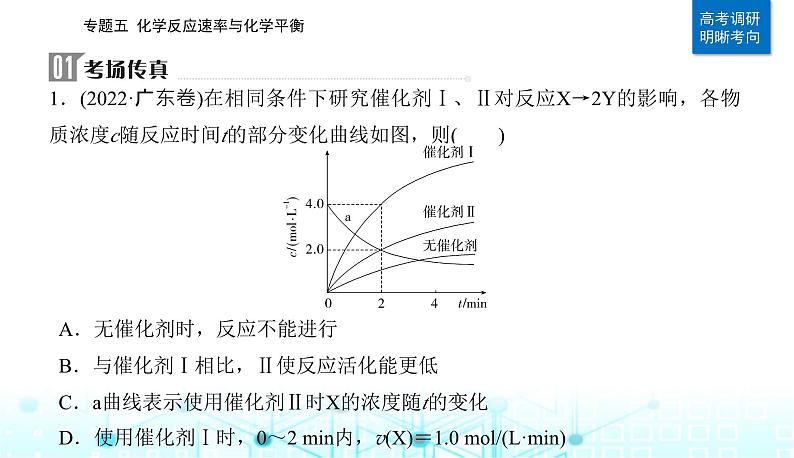
1.(2022·广东卷)在相同条件下研究催化剂Ⅰ、Ⅱ对反应X→2Y的影响,各物质浓度c随反应时间t的部分变化曲线如图,则( )
A.无催化剂时,反应不能进行B.与催化剂Ⅰ相比,Ⅱ使反应活化能更低C.a曲线表示使用催化剂Ⅱ时X的浓度随t的变化D.使用催化剂Ⅰ时,0~2 min内,v(X)=1.0 ml/(L·min)
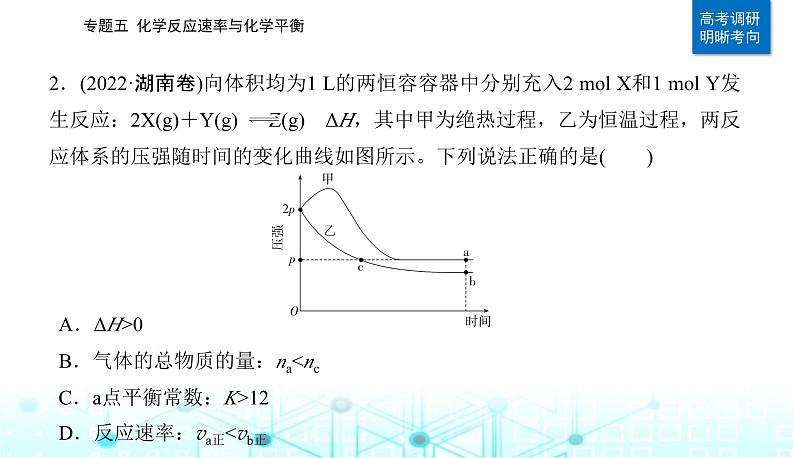
2.(2022·湖南卷)向体积均为1 L的两恒容容器中分别充入2 ml X和1 ml Y发生反应:2X(g)+Y(g) Z(g) ΔH,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。下列说法正确的是( )
A.ΔH>0B.气体的总物质的量:na
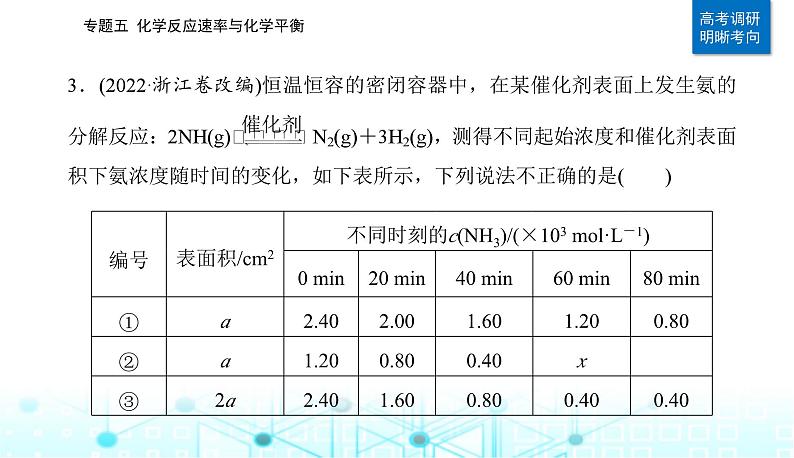
A.实验①,0~20 min,v(N2)=1.00×10-5 ml/(L·min)B.实验②,60 min时处于平衡状态,x≠0.40C.相同条件下,增加氨的浓度,反应速率增大D.相同条件下,增加催化剂的表面积,反应速率增大
4.00×10-4ml·L-1,则实验①达到平衡时氨浓度也为4.00×10-4ml·L-1,而恒温恒容条件下,实验②相对于实验①为减小压强,平衡正向移动,因此实验②60 min时处于平衡状态,x<0.4,即x≠0.4,B项正确;实验①、实验②中0~20 min、20 min~40 min氨浓度变化量都是4.00×10-4ml·L-1,实验②中60 min时反应达到平衡状态,实验①和实验②催化剂表面积相同,实验①中氨初始浓度是实验②中氨初始浓度的两倍,实验①60 min时反应未达到平衡状态,相同条件下,增加氨浓度,反应速率并没有增大,C项错误;对比实验①和实验③,氨浓度相同,实验③中催化剂表面积是实验①中催化剂表面积的2倍,实验③先达到平衡状态,实验③的反应速率大,说明相同条件下,增加催化剂的表面积,反应速率增大,D项正确。故选C。
4.(2021·广东卷)反应X===2Z经历两步:①X→Y;②Y→2Z。反应体系中X、Y、Z的浓度c随时间t的变化曲线如图所示。下列说法不正确的是( )
A.a为c(X)随t的变化曲线B.t1时,c(X)=c(Y)=c(Z)C.t2时,Y的消耗速率大于生成速率D.t3后,c(Z)=2c0-c(Y)
解析:由题中信息可知,反应X===2Z经历两步:①X→Y;②Y→2Z。因此,题图中呈不断减小趋势的a线为X的浓度c随时间t的变化曲线,呈不断增加趋势的线为Z的浓度c随时间t的变化曲线,先增加后减小的线为Y的浓度c随时间t的变化曲线。X是唯一的反应物,随着反应的发生,其浓度不断减小,因此,由题图可知,a为c(X)随t的变化曲线,A项正确;由图可知,分别代表3种不同物质的曲线相交于t1时刻,因此,t1时c(X)=c(Y)=c(Z),B项正确;由题图中信息可知,t2时刻以后,Y的浓度仍在不断减小,说明t2时刻反应两步仍在向正反应方向发生,而且反应①生成Y的速率小于反应②消耗Y的速率,即t2时Y的消耗速率大于生成速率,C项正确;由图可知,t3时刻反应①完成,X完全转化为Y,若无反应②发生,则c(Y)=c0,由于反应②Y→2Z的发生,t3时刻Y浓度的变化量为c0-c(Y),变化量之比等于化学计量数之比,所以Z的浓度的变化量为2[c0-c(Y)],这种关系在t3后仍成立, 因此,D项不正确。故选D。
5.(2021·浙江卷)含硫化合物是实验室和工业上的常用化学品。请回答下列问题:(1)实验室可用铜与浓硫酸反应制备少量SO2:Cu(s)+2H2SO4(l)===CuSO4(s)+SO2(g)+2H2O(l) ΔH=-11.9 kJ·ml-1。判断该反应的自发性并说明理由:_____________________________________________________________________________________________________________________________________。(2)已知2SO2(g)+O2(g) 2SO3(g) ΔH=-198 kJ·ml-1。850 K时,在一恒容密闭反应器中充入一定量的SO2和O2,当反应达到平衡后测得SO2、O2和SO3的浓度分别为6.0×10-3 ml·L-1、8.0×10-3 ml·L-1和4.4×10-2 ml·L-1。①该温度下反应的平衡常数为________。②平衡时SO2的转化率为________。
解析:(1)实验室可用铜与浓硫酸反应制备少量SO2的反应为Cu(s)+2H2SO4(l)===CuSO4(s)+SO2(g)+2H2O(l)ΔH=-11.9 kJ·ml-1,由于该反应ΔH<0、ΔS>0,因此该反应在任何温度下都能自发进行。
答案:(1)不同温度下都能自发进行,因为ΔH<0、ΔS>0(2)①6.7×103 ml-1·L ②88%
化学平衡是重要的化学基本原理,是中学化学的重点和难点,也是考查学生能力的重要载体,是高考历久不衰的热点。化学平衡是包含溶解平衡、电离平衡、水解平衡等的一个平衡理论体系,而化学平衡则是这一体系的核心,是分析其他平衡移动的基础。通过对历年试卷的分析可以看出化学反应速率和化学平衡是历年高考的重点和热点,其重视程度呈加强趋势。题型主要是填空题,试题重点考查化学平衡的基本概念和影响平衡移动的条件;化学反应速率和化学平衡的实验分析和设计;速率和平衡计算及读图、析图,获取信息,采集处理数据等。需特别关注平衡常数表达式的简单计算及应用。
请判断下列说法正误(正确的打“√”,错误的打“×”)。(1)参加反应的物质的性质是影响化学反应速率的主要因素。( )(2)化学反应达到最大限度时,正、逆反应速率也达到最大且相等。( )(3)正催化剂能降低化学反应的活化能,增大反应速率,提高生产效率。( )(4)不管什么反应,增大浓度、加热、加压、使用催化剂都可以增大反应速率。( )(5)5 ml/(L· min)的反应速率一定比1 ml/(L· min)的反应速率大。( )(6)平衡时,其他条件不变,分离出固体生成物,v(正)减慢。( )(7)化学平衡发生移动,化学反应速率一定改变;化学反应速率改变,化学平衡也一定发生移动。( )
答案:(1)√ (2)× (3)√ (4)× (5)× (6)× (7)× (8)× (9)√ (10)×
(2)纯液体、固体对化学反应速率的影响。在化学反应中,纯液体和固态物质的浓度为常数,故不能用固态物质的浓度变化来表示反应速率,但是固态反应物颗粒的大小是影响反应速率的条件之一,如煤粉由于表面积大,燃烧时比煤块快得多。(3)外界条件对可逆反应的正、逆反应速率的影响方向是一致的,但影响程度不一定相同。
3.活化分子、有效碰撞与反应速率的关系
1.解答化学反应速率及影响因素试题的思维建模
2.化学反应速率常数拓展对于一个基元反应:αA+βD===γG+hH其化学反应速率常数数学表达式为:v=kcα(A)cβ(D)上式中的k称为反应速率常数又称速率常数。k的物理意义:在一定的条件下(温度、催化剂),反应物浓度为1 ml·L-1时的反应速率。k与反应物浓度无关。其特征有:(1)反应不同,k值不同。(2)同一反应,温度不同k值不同。(3)同一反应,温度一定时,有无催化剂k也是不同的。不同反应有不同的速率常数,速率常数与反应温度、反应介质(溶剂)、催化剂等有关,甚至会随反应器的形状、性质而异。与浓度无关,但受温度、催化剂、固体表面性质等因素的影响。
在分析外界条件对化学反应速率的影响时,一定要和平衡移动区分开,速率比较的是快慢,而平衡移动取决于v(正)和v(逆)的相对大小。例如对于一个放热反应,降低温度,平衡正向移动,v(正)>v(逆),但是v(正)和v(逆)较原平衡均是减小的;另外需要注意的是不能用物质的量的变化量计算反应速率;比较速率大小时要注意用同一反应物或生成物的速率比较,单位要一致。
2.下列措施是为了增大化学反应速率的是( )A.含氯消毒剂避光保存B.谷物酿酒时使用酒曲C.葡萄酒中添加二氧化硫D.航海轮船船底镶嵌锌块
解析:含氯消毒剂避光保存是为了防止次氯酸见光分解,而造成含氯消毒剂失效,A项不符合题意;酒曲是催化葡萄糖分解为酒精的催化剂,可以增大谷物酿酒的速率,B项符合题意;葡萄酒中添加二氧化硫是利用SO2的还原性来延长葡萄酒的保质期,即减小葡萄酒变质的速率,C项不符合题意;由于锌比铁活泼,航海轮船船底镶嵌锌块是为了延缓船体钢铁的腐蚀速率,D项不符合题意。故选B。
3.一定温度下,在密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图所示。下列叙述正确的是( )
A.溶液中c(M)=c(N)+c(Y)B.0~10 min内,A的平均反应速率为0.04 ml/(L·min)C.18 min时,反应①与反应②中B的转化率之比为2∶3D.反应①的活化能比反应②的活化能大
6.某温度下,降冰片烯在钛杂环丁烷催化下聚合,反应物浓度与催化剂浓度及时间关系如图。已知反应物消耗一半所需的时间称为半衰期,下列说法错误的是( )
A.其他条件相同时,催化剂浓度越大,反应速率越大B.其他条件相同时,降冰片烯浓度越大,反应速率越大C.条件①,0~250 min,反应速率为0.012 ml/(L·min)D.条件②,降冰片烯起始浓度为3.0 ml·L-1时,半衰期为62.5 min
考点二 化学平衡状态1.化学平衡状态一定条件下的可逆反应达到v(正)=v(逆)的状态。达到化学平衡状态时:v(正)=v(逆)>0;各组分的浓度保持不变。2.化学平衡移动原理(1)勒夏特列原理(又称平衡移动原理)的内容:如果改变影响平衡的一个因素(如温度、压强及参加反应的物质的浓度),平衡就向着能够减弱这种改变的方向移动。关键字“减弱”有两层含义:与改变条件相反的方向;平衡移动不能抵消这种改变。
(2)平衡移动方向的判断方法:①依据勒夏特列原理判断。②根据图像中v(正)和v(逆)的相对大小判断,v(正)>v(逆)平衡正向移动,v(正)
判断化学平衡状态的理论依据是v(正)=v(逆);判断化学反应进行的方向和平衡移动的依据还是v(正)、v(逆)是否相等,即v(正)>v(逆),反应正向进行,平衡正向移动;v(正)
了;C项,合成氨反应是气体体积减小的反应,高压有利于平衡向生成氨的方向移动;D项,合成氨反应是放热反应,根据勒夏特列原理,降温有利于合成氨反应,但是工业生产不仅要考虑转化率,还要考虑反应速率,500 ℃是综合因素,因此不能用勒夏特列原理解释。故选D。
考点三 化学平衡常数和化学平衡计算1.化学平衡常数(K)只受温度影响。2.对于有气体参加的反应,只改变浓度、压强,平衡移动,平衡常数(K)不变。3.对于同类型的反应,K值越大,表示反应进行的程度越大,K值越小,表示反应进行的程度越小。4.在等温条件下,对于一个已达到化学平衡的反应,当改变反应物或生成物的浓度时,根据浓度商与平衡常数的大小关系,可以判断化学平衡移动的方向。Q=K,平衡状态;Q>K,反应逆向进行;Q
其中hν表示一个光子能量,NOCl*表示NOCl的激发态。可知,分解1 ml的NOCl 需要吸收________ml的光子。
即lg Kp1(T1)+lg Kp2(T1)>lg Kp1(T2)+lg Kp2(T2),lg [Kp1(T1)·Kp2(T1)]>lg [Kp1(T2)·Kp2(T2)],则Kp1(T1)·Kp2(T1)>Kp1(T2)·Kp2(T2),则K(T1)>K(T2),即温度升高,K增大,则ΔH>0。
(4)Ⅰ.NOCl+hν―→NOCl*;Ⅱ.NOCl+NOCl*―→2NO+Cl2,根据盖斯定律,Ⅰ+Ⅱ得总反应为2NOCl+hν===2NO+Cl2,因此2 ml NOCl分解需要吸收1 ml光子能量,则分解1 ml NOCl需要吸收0.5 ml光子。
化学平衡常数是指某一具体反应的平衡常数,若化学反应方程式中的计量数发生变化,平衡常数也相应改变;涉及平衡常数的计算常用“三段式”求解;有气体参加的反应,常用平衡分压代替平衡浓度进行计算。
考点四 化学平衡图像1.常见的平衡图像:v-t图像;c-t图像;c-p图像;v-T图像等。2.平衡图像的分析方法:一看面:看清图像中横坐标和纵坐标的含义;二看线:弄清图像中线的斜率或线走势的意义;三看点:明确曲线的起点、终点、交点及拐点等;四看是否需要辅助线。
A.反应在0~50 s的平均速率v(C)=1.6×10-3 ml/(L·s)B.该温度下,反应的平衡常数K=0.025C.保持其他条件不变,升高温度,平衡时c(B)=0.09 ml·L-1,则该反应的ΔH<0D.反应达平衡后,再向容器中充入1 ml A,该温度下再达到平衡时,A的转化率不变
0.10 ml·L-1,则平衡逆向移动,该反应的ΔH<0,C项正确;反应达平衡后,再向容器中充入1 ml A,相当于加压,平衡不发生移动,A的转化率不变,D项正确。故选B。
有关反应速率和化学平衡图像题的解题方法:首先应弄懂曲线所代表的是哪种物理量;其次看懂曲线的形状和走势;第三明确曲线的起点、交点、拐点及零点;最后结合题中给定的化学反应和数据进行推理和判断。
A.表示CH3CH2OH组分的曲线是ⅢB.图中曲线交点a对应H2的转化率大于交点bC.图中曲线交点a、b对应反应平衡常数Ka<KbD.若使用催化剂,则b点向上移动
解析:该反应为气体体积减小的放热反应,升高温度,平衡逆向移动,CH3CH2OH、H2O的体积分数逐渐减小,CO2、H2的体积分数逐渐增大,且化学计量数越大,体积分数变化越大,由题图可知,曲线Ⅰ表示H2,曲线Ⅱ表示CO2,曲线Ⅲ为H2O,曲线Ⅳ为CH3CH2OH。由上述分析可知,表示CH3CH2OH组分的曲线是Ⅳ,故A项错误;该反应为气体体积减小的放热反应,升高温度,平衡逆向移动,H2的转化率降低,交点a的温度高于交点b,则交
点a对应H2的转化率小于交点b,故B项错误;因为平衡常数仅与温度有关,该反应为放热反应,升高温度,平衡向逆反应方向移动,所以温度越低,K越大,则Ka
A.m=n=1B.t1时,c(X)=c(Y)C.反应的活化能:①<②D.t2时,X的消耗速率等于Z的生成速率
解析:由题图可知,最终X的浓度变为0,完全反应,反应生成Y、Z的浓度之和等于X的起始浓度,则反应均为气体分子数不变的反应,故m=n=1,A项正确;由图可知,t1时,X、Y的浓度曲线相交,c(X)=c(Y),B项正确;两个反应同时发生,反应结束是Y含量更高,反应速率更快,说明反应①活化能较低,故活化能:①<②,C项正确;t2时,反应②中X的消耗速率等于Z的生成速率,而X还要发生反应①,故X的消耗速率大于Z的生成速率,D项错误。故选D。
A.0~5 min,共放出19.8 kJ的热量B.CO2和H2的转化率相等时,反应达到平衡C.9 min时,改变的外界条件可能是降温D.平衡常数Kb一定大于Ka
解析:不确定容器的体积,不能确定反应的二氧化碳的物质的量,不能计算反应放出热量数值,A项错误;反应中CO2和H2按反应的化学计量数比投料,则两者的转化率一直相等,不能用来判断反应是否达到平衡,B项错误;题给反应为放热反应,降低温度平衡正向移动,二氧化碳的浓度减小,符合图像,C项正确;对于确定反应,平衡常数只受温度的影响,不确定是否温度一定改变,则不能判断两者K值的大小,D项错误。故选C。
A.图甲中ω1>1B.图乙中,线Ⅰ表示正反应的平衡常数C.在恒容容器中进行,压强不变时反应达到平衡状态D.当温度为T1、ω=2时,Cl2的转化率约为33.3%
解析:增大氯气的浓度,平衡向正反应方向移动,丙烯的体积分数减小,由题图可知,丙烯的体积分数ω1大于ω2,则ω1<1,故A项错误;由题图甲可知,温度升高,丙烯的体积分数增大,说明平衡向逆反应方向移动,该反应为放热反应,升高温度,放热反应的平衡常数减小,则题图乙中,线Ⅱ表示正反应的平衡常数,故B项错误;该反应是一个气体体积不变的可逆反应,无论是否达到平衡,压强始终不变,则在恒容容器中进行,压强不变时不能说明反
应达到平衡状态,故C项错误;设温度为T1、ω=2时,容器体积为1 L,CH2===CHCH3的起始物质的量为1 ml,消耗物质的量为x ml,由题意建立如下“三段式”:
相关课件
这是一份专题五 选择题专攻 3.化学反应速率、化学平衡图像分析 2024年高考化学二轮复习课件+讲义,文件包含专题五选择题专攻3化学反应速率化学平衡图像分析pptx、专题五选择题专攻3化学反应速率化学平衡图像分析教师版docx、专题五选择题专攻3化学反应速率化学平衡图像分析docx等3份课件配套教学资源,其中PPT共37页, 欢迎下载使用。
这是一份专题五 热化学 化学反应速率与平衡 选择题专攻 3.化学反应速率、化学平衡图像分析 课件-2024年高考化学二轮复习,共43页。PPT课件主要包含了核心精讲,化学平衡与平衡转化率,真题演练,考向预测等内容,欢迎下载使用。
这是一份专题五 热化学 化学反应速率与平衡 选择题专攻 3.化学反应速率、化学平衡图像分析 课件-2024年高考化学二轮复习,共43页。PPT课件主要包含了核心精讲,化学平衡与平衡转化率,真题演练,考向预测等内容,欢迎下载使用。












