





还剩12页未读,
继续阅读
成套系列资料,整套一键下载
- 江苏专用2023_2024学年新教材高中化学专题5微观结构与物质的多样性第一单元元素周期律和元素周期表第一课时元素周期律课件苏教版必修第一册 课件 0 次下载
- 江苏专用2023_2024学年新教材高中化学专题5微观结构与物质的多样性第一单元元素周期律和元素周期表第二课时元素周期表课件苏教版必修第一册 课件 0 次下载
- 江苏专用2023_2024学年新教材高中化学专题5微观结构与物质的多样性第一单元元素周期律和元素周期表第四课时元素周期表的应用课件苏教版必修第一册 课件 0 次下载
- 江苏专用2023_2024学年新教材高中化学专题5微观结构与物质的多样性第二单元微粒之间的相互作用力第一课时离子键课件苏教版必修第一册 课件 0 次下载
- 江苏专用2023_2024学年新教材高中化学专题5微观结构与物质的多样性第二单元微粒之间的相互作用力第二课时共价键分子间作用力课件苏教版必修第一册 课件 0 次下载
江苏专用2023_2024学年新教材高中化学专题5微观结构与物质的多样性第一单元元素周期律和元素周期表第三课时同主族元素的性质课件苏教版必修第一册
展开
这是一份江苏专用2023_2024学年新教材高中化学专题5微观结构与物质的多样性第一单元元素周期律和元素周期表第三课时同主族元素的性质课件苏教版必修第一册,共20页。
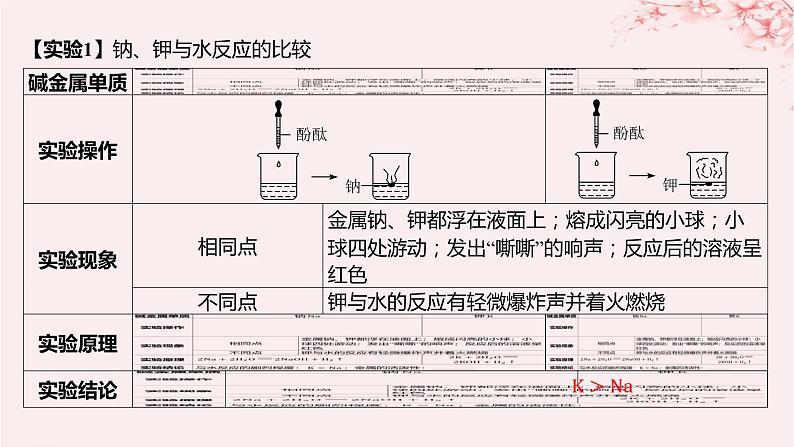
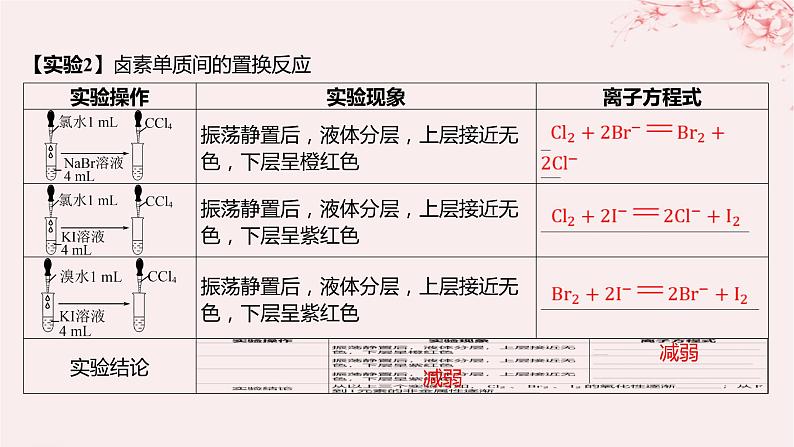
第一单元 元素周期律和元素周期表第3课时 同主族元素的性质1教材预习·必备知识全过关2要点归纳·能力素养全提升01教材预习·必备知识全过关【实验1】钠、钾与水反应的比较 【实验2】卤素单质间的置换反应 减弱减弱【结论】(1)同周期主族元素从左到右(稀有气体元素除外),元素的金属性依次______,非金属性依次______,原子半径依次______。(2)同主族从上到下,元素的金属性依次______,非金属性依次______,原子或离子半径依次______。碱金属元素包括________________________,随着核电荷数增大,电子层数逐渐_____,原子半径逐渐______,失电子能力逐渐______,金属性逐渐______,单质还原性逐渐______,氢氧化物的碱性逐渐______。卤族元素包括____________________,随着核电荷数增大,电子层数逐渐______,原子半径逐渐______,得电子能力逐渐______,非金属性逐渐______,单质的氧化性逐渐______,与氢气化合的能力逐渐______,气态氢化物稳定性逐渐______。减弱增强减小增强减弱增大锂、钠、钾、铷、铯、钫增加增大增强增强增强增强氟、氯、溴、碘、砹增加增大减弱减弱减弱减弱减弱02要点归纳·能力素养全提升要点一 碱金属元素原子结构与性质1.碱金属元素原子结构与性质之间的关系(1)相似性 2.结构与性质的关系例1 下列关于碱金属元素的说法错误的是( ) AA.碱金属单质都能与水剧烈反应B.碱金属单质都能与水反应生成碱和氢气C.随着核电荷数的增多,碱金属元素的阳离子氧化性逐渐减弱D.碱金属是典型的活泼金属,其原因是原子最外层都只有一个电子,化学反应中容易失去电子[解析] 锂与水反应不剧烈,A项错误;碱金属都能与水反应,生成对应的碱,B项正确;随着核电荷数的增多,碱金属阳离子得到电子的能力即氧化性逐渐减弱,C项正确;碱金属是活泼金属,与容易失去最外层的1个电子有关,D项正确。对点演练1 根据碱金属元素在空气中燃烧及与水反应的剧烈程度的不同,可以得到的正确结论是( ) DA.同主族元素自上而下,金属性减弱B.同主族元素自上而下,得电子能力增强C.同主族元素自上而下,原子半径变小D.同主族元素自上而下,元素的金属性增强 对点演练2 下图表示ⅠA族金属元素(又称为碱金属)的某些性质与核电荷数的变化关系,则下列各性质中不符合图示关系的是( ) CA.金属性 B.与水反应的剧烈程度C.阳离子的氧化性 D.原子半径[解析] 随着核电荷数的增大,碱金属的金属性逐渐增强;其单质与水反应剧烈程度增大;其原子半径逐渐增大,A、B、D三项不符合题目要求。随碱金属核电荷数的递增,其阳离子的氧化性逐渐减弱,该性质与图示不符,C项符合题目要求。要点二 卤族元素原子结构与性质1.卤素原子结构及其性质续表2.卤素原子结构与性质之间的关系 BA.单质的熔、沸点逐渐降低 B.卤素阴离子的还原性逐渐增强C.气态氢化物的稳定性逐渐增强 D.单质的氧化性逐渐增强 对点演练3 下列说法不能作为比较卤族元素非金属性强弱依据的是( ) D [解析] 比较元素非金属性强弱的依据有①单质与氢气化合的难易程度;②气态氢化物的稳定性强弱;③最高价氧化物对应水化物的酸性强弱;④对应单质的氧化性强弱等。不能用氢化物水溶液的酸性强弱判断元素非金属性强弱,故A、B正确,D错误;一般来说单质的氧化性越强,其对应的简单阴离子的还原性越弱,对应元素的非金属性越强,即C正确。对点演练4 关于卤素单质及其化合物性质的下列比较,不正确的是( ) C
第一单元 元素周期律和元素周期表第3课时 同主族元素的性质1教材预习·必备知识全过关2要点归纳·能力素养全提升01教材预习·必备知识全过关【实验1】钠、钾与水反应的比较 【实验2】卤素单质间的置换反应 减弱减弱【结论】(1)同周期主族元素从左到右(稀有气体元素除外),元素的金属性依次______,非金属性依次______,原子半径依次______。(2)同主族从上到下,元素的金属性依次______,非金属性依次______,原子或离子半径依次______。碱金属元素包括________________________,随着核电荷数增大,电子层数逐渐_____,原子半径逐渐______,失电子能力逐渐______,金属性逐渐______,单质还原性逐渐______,氢氧化物的碱性逐渐______。卤族元素包括____________________,随着核电荷数增大,电子层数逐渐______,原子半径逐渐______,得电子能力逐渐______,非金属性逐渐______,单质的氧化性逐渐______,与氢气化合的能力逐渐______,气态氢化物稳定性逐渐______。减弱增强减小增强减弱增大锂、钠、钾、铷、铯、钫增加增大增强增强增强增强氟、氯、溴、碘、砹增加增大减弱减弱减弱减弱减弱02要点归纳·能力素养全提升要点一 碱金属元素原子结构与性质1.碱金属元素原子结构与性质之间的关系(1)相似性 2.结构与性质的关系例1 下列关于碱金属元素的说法错误的是( ) AA.碱金属单质都能与水剧烈反应B.碱金属单质都能与水反应生成碱和氢气C.随着核电荷数的增多,碱金属元素的阳离子氧化性逐渐减弱D.碱金属是典型的活泼金属,其原因是原子最外层都只有一个电子,化学反应中容易失去电子[解析] 锂与水反应不剧烈,A项错误;碱金属都能与水反应,生成对应的碱,B项正确;随着核电荷数的增多,碱金属阳离子得到电子的能力即氧化性逐渐减弱,C项正确;碱金属是活泼金属,与容易失去最外层的1个电子有关,D项正确。对点演练1 根据碱金属元素在空气中燃烧及与水反应的剧烈程度的不同,可以得到的正确结论是( ) DA.同主族元素自上而下,金属性减弱B.同主族元素自上而下,得电子能力增强C.同主族元素自上而下,原子半径变小D.同主族元素自上而下,元素的金属性增强 对点演练2 下图表示ⅠA族金属元素(又称为碱金属)的某些性质与核电荷数的变化关系,则下列各性质中不符合图示关系的是( ) CA.金属性 B.与水反应的剧烈程度C.阳离子的氧化性 D.原子半径[解析] 随着核电荷数的增大,碱金属的金属性逐渐增强;其单质与水反应剧烈程度增大;其原子半径逐渐增大,A、B、D三项不符合题目要求。随碱金属核电荷数的递增,其阳离子的氧化性逐渐减弱,该性质与图示不符,C项符合题目要求。要点二 卤族元素原子结构与性质1.卤素原子结构及其性质续表2.卤素原子结构与性质之间的关系 BA.单质的熔、沸点逐渐降低 B.卤素阴离子的还原性逐渐增强C.气态氢化物的稳定性逐渐增强 D.单质的氧化性逐渐增强 对点演练3 下列说法不能作为比较卤族元素非金属性强弱依据的是( ) D [解析] 比较元素非金属性强弱的依据有①单质与氢气化合的难易程度;②气态氢化物的稳定性强弱;③最高价氧化物对应水化物的酸性强弱;④对应单质的氧化性强弱等。不能用氢化物水溶液的酸性强弱判断元素非金属性强弱,故A、B正确,D错误;一般来说单质的氧化性越强,其对应的简单阴离子的还原性越弱,对应元素的非金属性越强,即C正确。对点演练4 关于卤素单质及其化合物性质的下列比较,不正确的是( ) C
相关资料
更多









