
所属成套资源:2023秋高中化学(苏教2019)选择性必修1 分层作业 和 专题 测评 (解析版)
高中化学苏教版 (2019)选择性必修1第三单元 金属的腐蚀与防护课堂检测
展开
这是一份高中化学苏教版 (2019)选择性必修1第三单元 金属的腐蚀与防护课堂检测,共12页。试卷主要包含了如图所示装置中都盛有0等内容,欢迎下载使用。
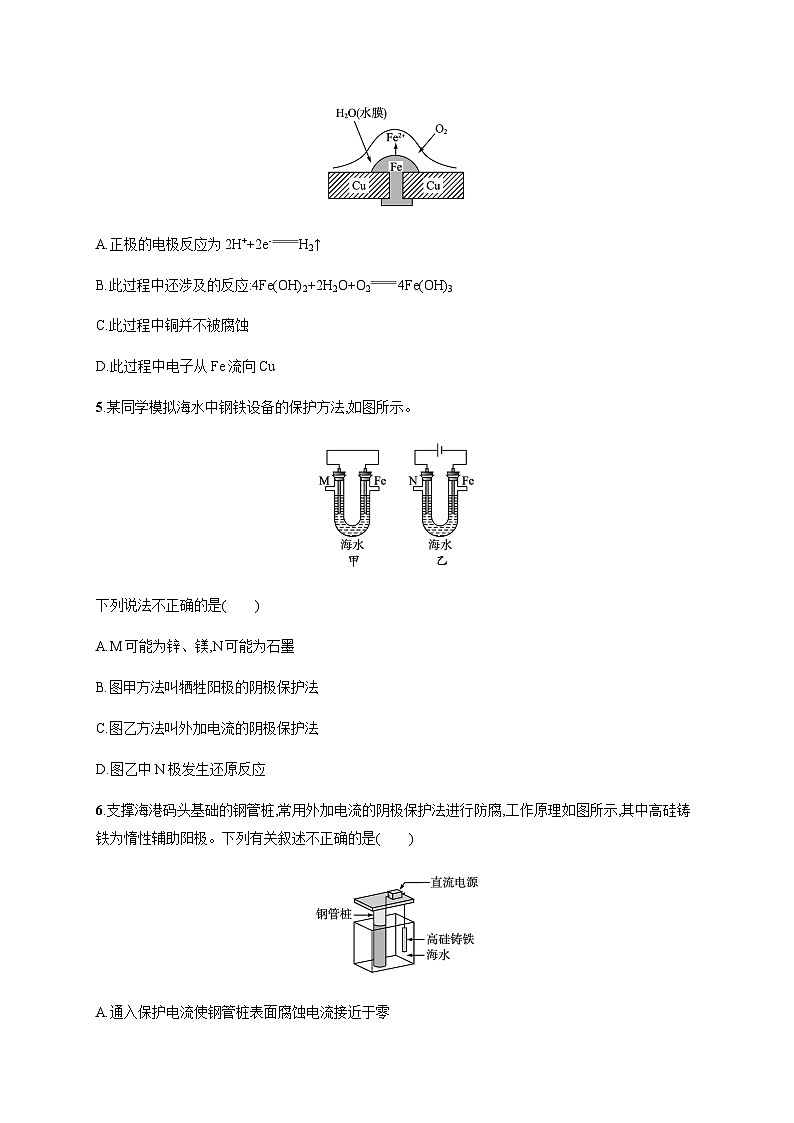
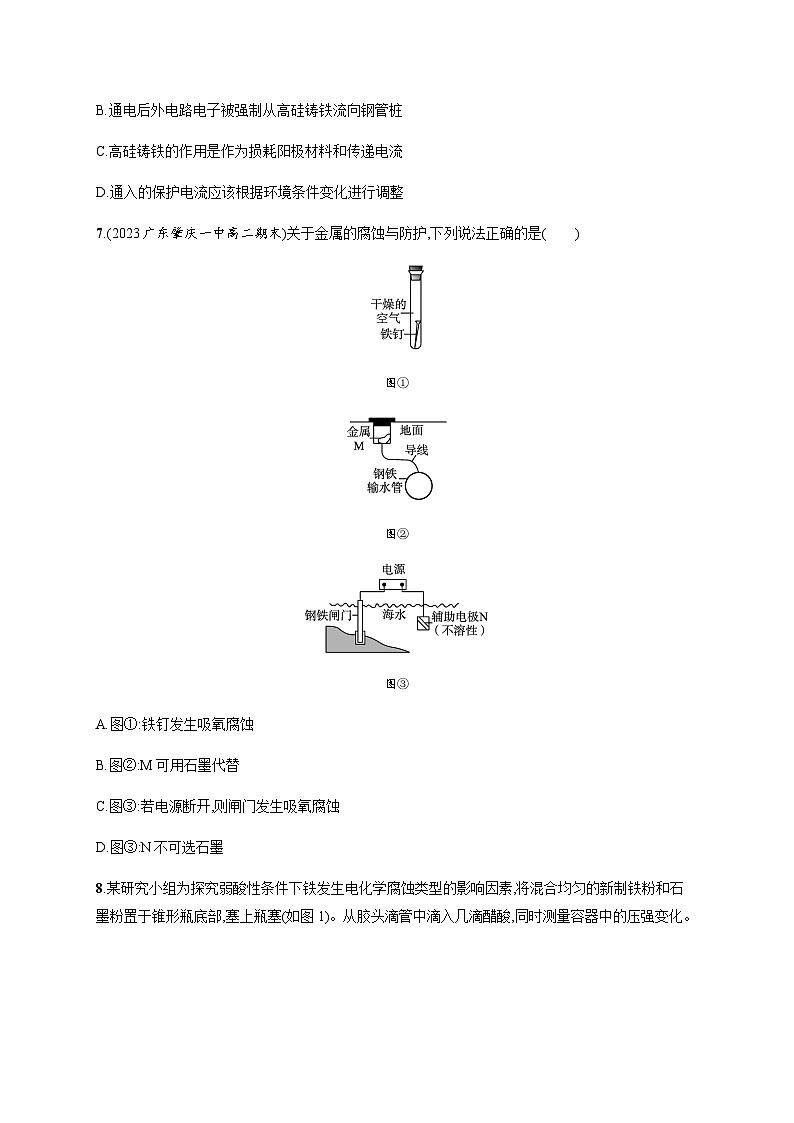
专题1分层作业7 金属的腐蚀与防护A级 必备知识基础练1.为防止钢铁锈蚀,下列防护方法正确的是( )A.在精密机床的铁床上安装铜螺钉B.在排放海水的钢铁阀门上用导线连接一块石墨,一同浸入海水中C.在海轮舷上用铁丝系住锌板浸在海水里D.在电动输油管的铸铁管上接直流电源的正极2.下列金属防腐的措施中,使用外加电流的阴极保护法的是( )A.水中的钢闸门连接电源的负极B.金属器皿表面喷涂高分子膜C.汽车底盘喷涂高分子膜D.地下钢管连接镁块3.如图所示装置中都盛有0.1 mol· L-1的NaCl溶液,放置一定时间后,装置中的四块相同锌片,腐蚀速率由快到慢的正确顺序是( )A.③①④② B.①②④③C.②③④① D.②①④③4.铜板上的铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法不正确的是( )A.正极的电极反应为2H++2e-H2↑B.此过程中还涉及的反应:4Fe(OH)2+2H2O+O24Fe(OH)3C.此过程中铜并不被腐蚀D.此过程中电子从Fe流向Cu5.某同学模拟海水中钢铁设备的保护方法,如图所示。下列说法不正确的是( )A.M可能为锌、镁,N可能为石墨B.图甲方法叫牺牲阳极的阴极保护法C.图乙方法叫外加电流的阴极保护法D.图乙中N极发生还原反应6.支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关叙述不正确的是( )A.通入保护电流使钢管桩表面腐蚀电流接近于零B.通电后外电路电子被强制从高硅铸铁流向钢管桩C.高硅铸铁的作用是作为损耗阳极材料和传递电流D.通入的保护电流应该根据环境条件变化进行调整7.(2023广东肇庆一中高二期末)关于金属的腐蚀与防护,下列说法正确的是( )图①图②图③A.图①:铁钉发生吸氧腐蚀B.图②:M可用石墨代替C.图③:若电源断开,则闸门发生吸氧腐蚀D.图③:N不可选石墨8.某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和石墨粉置于锥形瓶底部,塞上瓶塞(如图1)。从胶头滴管中滴入几滴醋酸,同时测量容器中的压强变化。(1)请完成以下实验设计表(表中不要留空格):编号实验目的石墨粉/g铁粉/g醋酸/%①为以下实验作参照0.52.090.0②醋酸浓度的影响0.5 36.0③ 0.22.090.0 (2)编号①实验测得容器中压强随时间变化如图2。t2时,容器中压强明显小于起始压强,其原因是铁发生了 腐蚀,请在图3中用箭头标出发生该腐蚀时电子流动方向;此时,石墨粉表面发生了 (填“氧化”或“还原”)反应,其电极反应式是 。 (3)该小组对图2中O~t1时压强变大的原因提出了如下假设,请你完成假设二。假设一:发生析氢腐蚀产生了气体;假设二: 。 B级 关键能力提升练9.下列关于金属的腐蚀及防腐说法错误的是( )A.马口铁(镀锡铁)镀层破损铁的腐蚀速率加快B.为了防止钢铁设备腐蚀,利用外加电流的阴极保护法,应另附加一惰性电极,惰性电极作阴极C.可以采用改变金属组成或结构的方法防止金属腐蚀D.为保护海轮的船壳,利用牺牲阳极的阴极保护法,常在船壳上镶入锌块10.将两根铁钉分别缠绕上铜丝和镁条,放入滴有混合溶液的容器中,如图所示,下列叙述不正确的是( )A.a中铜丝附近有气泡产生B.a中铁钉附近出现蓝色沉淀C.b中铁钉附近呈现红色D.b中发生吸氧腐蚀11.下列各种措施中,能对金属起到防止或减缓腐蚀作用的是( )①金属表面涂抹油漆 ②改变金属内部结构③保持金属表面清洁干燥 ④金属表面进行电镀 ⑤使金属表面形成致密的氧化物薄膜A.仅有①②③④B.仅有③④⑤C.仅有①②④⑤D.全部12.水库的闸门由钢质材料制作,长期浸泡于水中,通常采用如图装置对闸门进行保护。下列说法不正确的是 ( )A.a、b间用导线连接时,则X可以是锌B.a、b间接入电源时,钢闸门发生反应Fe-2e-Fe2+C.若a、b间断开则钢闸门腐蚀过程中会消耗环境中的氧气D.a、b间接入电源时,a应连在电源的负极上13.探究铁钉在不同溶液中的腐蚀情况。实验装置与数据如下:实验装置实验数据下列说法不正确的是( )A.①的负极反应:Fe-3e-Fe3+B.③的正极反应:O2+2H2O+4e-4OH-C.②可能同时发生析氢腐蚀和吸氧腐蚀D.金属的电化学腐蚀以哪种类型为主与溶液的pH有关14.K2FeO4是水的处理剂,也是高能电池的正极材料。(1)利用A装置制备高铁酸钾(K2FeO4)。阳极的电极反应式为 ; 电解过程中阴极区电解质溶液的pH将 (填“增大”“减小”或“不变”)。 (2)锌铁碱性电池的装置示意图如B所示。电池反应式为2K2FeO4+3Zn+2KOH+8H2O2Fe(OH)3+3K2[Zn(OH)4]负极的电极反应式为 。 在电解质溶液中OH-向 (填“正”或“负”)极迁移。 (3)钢铁电化学腐蚀的主要类型是 (填“吸氧腐蚀”或“析氢腐蚀”)。 某同学设计如下实验方案探究钢铁腐蚀的外界影响因素:实验序号钢铁片食盐水/10 mL温度/KⅠ10 g5%298Ⅱ10 g10%298Ⅲ10 g10%308该方案可以探究 (填“温度”“压强”“接触面”“催化剂”或“浓度”,可多选)对钢铁腐蚀的影响。 15.金属腐蚀现象在生产生活中普遍存在,依据下列2种腐蚀现象回答下列问题:(1)图1中,被腐蚀的金属为 ,其腐蚀类型属于 (填字母,下同);图2中金属腐蚀类型属于 。 A.化学腐蚀 B.电化学腐蚀C.析氢腐蚀 D.吸氧腐蚀(2)图1中Cu的作用是 ,结合电极反应、电子移动、离子移动等,分析金属被腐蚀的原理 。 (3)图2中铁的生锈过程:Fe→Fe(OH)2→Fe(OH)3→Fe2O3·nH2O,将Fe转变为Fe(OH)2的反应补充完整:正极反应为 ,负极反应为 ,总反应为 。 (4)下列防止铁制品生锈的措施合理的是 (填字母)。 A.在铁闸门表面涂油漆B.在地下铁管道上安装若干镁合金C.将铁罐与浓硫酸等强氧化剂接触,使之发生钝化C级 学科素养拔高练16.下列根据实验操作及现象进行的分析和推断不正确的是( )操作现象一段时间后:①中,铁钉裸露在外的附近区域变红;②中……A.NaCl的琼脂水溶液作为离子迁移的通路B.①中变红是因为发生反应2H2O+2e-H2↑+2OH-C.②中可观察到铁钉裸露在外的附近区域变蓝,铜丝附近区域变红D.①和②中发生的氧化反应均可表示为M-2e-M2+(M代表锌或铁)
参考答案专题1 分层作业7 金属的腐蚀与防护1.C 解析 铜、铁形成原电池时,铁作为负极,加速铁的腐蚀,A项错误;铁、石墨形成原电池时,铁作为负极,加速铁的腐蚀,B项错误;锌比铁活泼,铁作为正极被保护,C项正确;铸铁管作为阳极,加速铁的腐蚀,D项错误。2.A 解析 外加电流的阴极保护法是指把要保护的金属连接在直流电源的负极上,使其作为电解池的阴极被保护,A项符合题意;金属表面涂漆或喷涂高分子膜是防止金属与其他物质接触发生反应,B、C选项不符合题意;地下钢管连接镁块,是牺牲阳极的阴极保护法,D项不符合题意。3.D 解析 ①铜锌构成原电池,锌为负极失电子,发生电化学腐蚀,加快锌的腐蚀;②外加电源,构成电解池,锌接正极,为阳极,失电子,加快腐蚀且由电解池引起的腐蚀速率大于原电池引起的腐蚀速率;③图中构成电解池,锌接负极,为阴极,得电子,为外加电流的阴极保护法,锌不易被腐蚀;④为锌的化学腐蚀;腐蚀速率由快到慢的顺序为②①④③,D项正确。4.A 解析 题图表示吸氧腐蚀,其中铁铆钉为负极,电极反应为Fe-2e-Fe2+,铜板为正极,电极反应为O2+2H2O+4e-4OH-,当形成Fe(OH)2后,还发生反应4Fe(OH)2+O2+2H2O4Fe(OH)3,故A项错误。5.D 解析 A项,M的金属活动性比铁强,M为负极,N可能为惰性电极,正确;B项,图甲装置,M被腐蚀,铁被保护,正确;C项,图乙装置外接电源,铁极发生还原反应,正确;D项,图乙中N极发生氧化反应,错误。6.C 解析 由图示知,该装置通过外加电流的阴极保护法进行防腐,因此需外加强大的电流抑制金属发生电化学腐蚀产生电流,即通入保护电流使钢管桩表面腐蚀电流接近于零,A项正确;通电后,被保护的钢管桩作为阴极,高硅铸铁作为阳极,因此通电后外电路电子被强制从高硅铸铁流向钢管桩,B项正确;高硅铸铁为惰性辅助阳极,所以高硅铸铁不会被损耗,C项错误;外加电流的目的是抑制金属发生电化学腐蚀产生电流,因此通入的保护电流应该根据环境条件变化进行调整,D项正确。7.C 解析 铁钉发生吸氧腐蚀也需要水参加,图①干燥的空气中没有水分,故A错误;图②采用的是牺牲阳极的阴极保护法,金属M必须比铁活泼才可以,则M不可用石墨代替,故B错误;图③采用的是外加电流的阴极保护法,若电源断开,则钢铁闸门和周围的海水形成原电池,发生的是吸氧腐蚀,故C正确;图③采用的是外加电流的阴极保护法,辅助电极N为阳极,可以是惰性电极石墨,则N可选石墨,故D错误。8.答案 (1)2.0 石墨粉含量的影响 (2)吸氧 如图:还原 2H2O+O2+4e-4OH-(3)反应放热,温度升高9.B 解析 铁比锡活泼,马口铁(镀锡铁)的表面一旦破损,构成原电池,Fe为负极,则铁腐蚀加快,A项正确;电解池中,阳极被腐蚀,阴极被保护,故应将钢铁的设备作为阴极,惰性电极作为阳极,B项错误;将金属制成合金,即改变金属的组成和结构,能起到很好的防止腐蚀的作用,C项正确;海轮外壳镶嵌锌块,此时铁作为原电池的正极金属而被保护,不易腐蚀,是采用了牺牲阳极的阴极保护法,D项正确。10.C 解析 a中装置构成原电池,Fe易失电子作为负极、Cu作为正极;b装置也构成原电池,Mg作为负极、Fe作为正极,Fe被保护。Cu作为正极,该原电池发生析氢腐蚀,Cu上电极反应式为2H++2e-H2↑,所以a中铜丝附近有气泡产生,A项正确;a中Fe电极发生反应Fe-2e-Fe2+,亚铁离子和K3[Fe(CN)6]反应生成蓝色沉淀,所以a中铁钉附近出现蓝色沉淀,B项正确;b中Fe作为正极被保护,Fe不参加反应,没有铁离子生成,所以铁钉附近不呈现红色,C项错误;强酸性条件下的腐蚀为析氢腐蚀,弱酸性或中性条件下发生吸氧腐蚀,D项正确。11.D 解析 金属的腐蚀主要是电化学腐蚀,①③④⑤中的方法都可以达到避免金属和电解质溶液接触形成原电池的目的;②中如在金属中加入某些其他元素改变金属内部结构也可以起到防腐蚀的效果。12.B 解析 采用原电池原理保护钢闸门时,a、b间用导线连接,则电极X是活泼性比Fe强的金属,可以是锌、铝等,A正确;a、b间接入电源时,a应该连接电源的负极,作阴极,b连接电源的正极作阳极,Fe得到保护,不发生氧化反应,B错误;若a、b间断开,则在钢闸门腐蚀过程中,在正极上溶解在河水中的氧气得到电子发生还原反应,因此会消耗环境中的氧气,C正确;要采用电解原理保护钢闸门,则a、b间接入电源时,a应连在电源的负极上,钢闸门作阴极,Fe不能失去电子,因而得到了保护,D正确。13.A 解析 铁钉在强酸性环境下发生析氢腐蚀,生成氢气,装置压强增大;在弱酸性、中性或碱性环境下发生吸氧腐蚀,消耗氧气,装置内气压下降。①发生析氢腐蚀,负极反应:Fe-2e-Fe2+,A项错误;③发生吸氧腐蚀,正极氧气得电子:O2+2H2O+4e-4OH-,B项正确;相比于中性和强酸性环境,②的压强变化介于两者之间,故可能同时发生析氢腐蚀和吸氧腐蚀,C项正确;根据实验数据可知,金属的电化学腐蚀以哪种类型为主与溶液的pH有关,D项正确。14.答案 (1)Fe-6e-+8OH-Fe+4H2O 增大(2)Zn-2e-+4OH-[Zn(OH)4]2- 负(3)吸氧腐蚀 温度、浓度解析 (1)电解法制备高铁酸钾,阳极上铁发生氧化反应,电极反应式为Fe-6e-+8OH-Fe+4H2O,阴极上发生还原反应,电极反应式为6H2O+6e-6OH-+3H2↑。电池反应为Fe+2KOH+2H2OK2FeO4+3H2↑。(2)锌铁电池的负极反应式为Zn-2e-+4OH-[Zn(OH)4]2-。(3)钢铁在空气中主要发生吸氧腐蚀,从方案可看出,能探究温度、电解质溶液浓度对钢铁电化学腐蚀的影响。15.答案 (1)铁(或Fe) BC BD(2)作为正极材料,导电 铜作为正极,氢离子在内电路移向正极,得到电子,生成氢气;铁作为负极失去电子,电子在外电路从负极移向正极,金属铁被腐蚀成亚铁离子(3)O2+4e-+2H2O4OH- 2Fe-4e-2Fe2+ 2Fe+O2+2H2O2Fe(OH)2 (4)ABC解析 (1)析氢腐蚀发生的条件为较强酸性环境,图1为二氧化硫的水溶液,酸性较强,与铁、铜形成电化学腐蚀中的析氢腐蚀;图2为碱性环境,碱性或中性或酸性较弱环境易发生吸氧腐蚀,腐蚀类型属于电化学腐蚀中的吸氧腐蚀。(2)图1中Cu的作用是作为正极材料,导电(不参与反应),结合电极反应、电子移动、离子移动等,可得出图1金属被腐蚀的原理为铜作为正极,氢离子在内电路移向正极,得到电子生成氢气,铁作为负极失去电子,电子在外电路从负极移向正极,金属铁被腐蚀成亚铁离子。(3)图2发生吸氧腐蚀,正极反应为氧气得电子,电极反应式为O2+4e-+2H2O4OH-,负极反应为铁失电子,反应式为2Fe-4e-2Fe2+,总反应为2Fe+O2+2H2O2Fe(OH)2。(4)防止铁制品生锈的措施:可以在铁闸门表面涂一层保护膜如油漆等;也可以在地下铁管道上安装若干镁合金或锌合金(比铁活泼),利用牺牲阳极的阴极保护法来防止铁生锈;可将铁罐与浓硫酸等强氧化剂接触,使之发生钝化,在铁表面形成致密氧化膜来防止铁生锈。16.B 解析 原电池的形成条件之一是形成闭合回路,①和②实验中,NaCl的琼脂水溶液作用是形成闭合回路,即NaCl的琼脂水溶液作为离子迁移的通路,A项正确;中性或碱性条件下,Zn、Fe形成原电池,发生吸氧腐蚀,Zn比Fe活泼,Zn作为负极、Fe作为正极,正极上反应为2H2O+O2+4e-4OH-,则①中变红,B项错误;②中NaCl溶液、Cu、Fe形成原电池,Fe比Cu活泼,Fe作为负极、Cu作为正极,负极反应为Fe-2e-Fe2+,正极反应为2H2O+O2+4e-4OH-,所以铁钉裸露在外的附近区域生成蓝色沉淀,铜丝附近区域酚酞遇到碱而变红,C项正确;①中Zn和②中Fe均作为负极,均失去2e-生成+2价的阳离子(Zn2+和Fe2+),发生氧化反应,所以Zn、Fe发生的氧化反应可表示为M-2e-M2+(M代表锌或铁),D项正确。
相关试卷
这是一份苏教版 (2019)选择性必修1专题3 水溶液中的离子反应第三单元 盐类的水解当堂检测题,共13页。试卷主要包含了下列做法与盐类水解知识无关的是,1 ml·L-1的硫酸铵溶液中,某温度时,向20 mL 0,常温下,分别向10 mL 0等内容,欢迎下载使用。
这是一份高中苏教版 (2019)第二单元 溶液的酸碱性同步训练题,共12页。试卷主要包含了现用0,用0,准确移取20,25 ℃时,向20等内容,欢迎下载使用。
这是一份高中化学苏教版 (2019)选择性必修1专题3 水溶液中的离子反应第二单元 溶液的酸碱性课时练习,共10页。试卷主要包含了25 ℃时在c=0,1 ml·L-1,下列说法中正确的是,已知,25 ℃时,把1 mL 0,将浓度为0等内容,欢迎下载使用。









