
所属成套资源:2023秋高中化学(苏教2019)选择性必修1 分层作业 和 专题 测评 (解析版)
高中化学苏教版 (2019)选择性必修1第二单元 化学能与电能的转化同步练习题
展开
这是一份高中化学苏教版 (2019)选择性必修1第二单元 化学能与电能的转化同步练习题,共15页。试卷主要包含了下列装置不可以组成原电池的是,关于下列装置的说法正确的是,下列有关装置的说法正确的是,64 g时,电解质溶液中有0等内容,欢迎下载使用。
专题1分层作业4 原电池的工作原理
A级 必备知识基础练
1.(2023河北保定高二期末)下列设备工作时,将化学能转化为电能的是( )
A
B
C
D
锂离子电池
硅太阳能电池
电饭煲
风力发电器
2.在理论上不能用于设计原电池的化学反应是( )
A.HCl+NaOHNaCl+H2O
B.2CH3OH+3O22CO2+4H2O
C.4Fe(OH)2+2H2O+O24Fe(OH)3
D.2H2+O22H2O
3.下列装置不可以组成原电池的是( )
4.铜锌原电池装置如图所示,下列说法不正确的是( )
A.电子从锌片经外电路流向铜片
B.盐桥中K+向负极移动
C.锌电极上发生的反应:Zn-2e-Zn2+
D.该装置实现了氧化反应和还原反应分开进行
5.关于下列装置的说法正确的是( )
A.装置①中,盐桥中的K+移向CuSO4溶液
B.装置①中,Zn为负极,发生还原反应
C.装置②中的Fe得到电子
D.装置②中电子由Fe流向石墨,然后再经溶液流向Fe
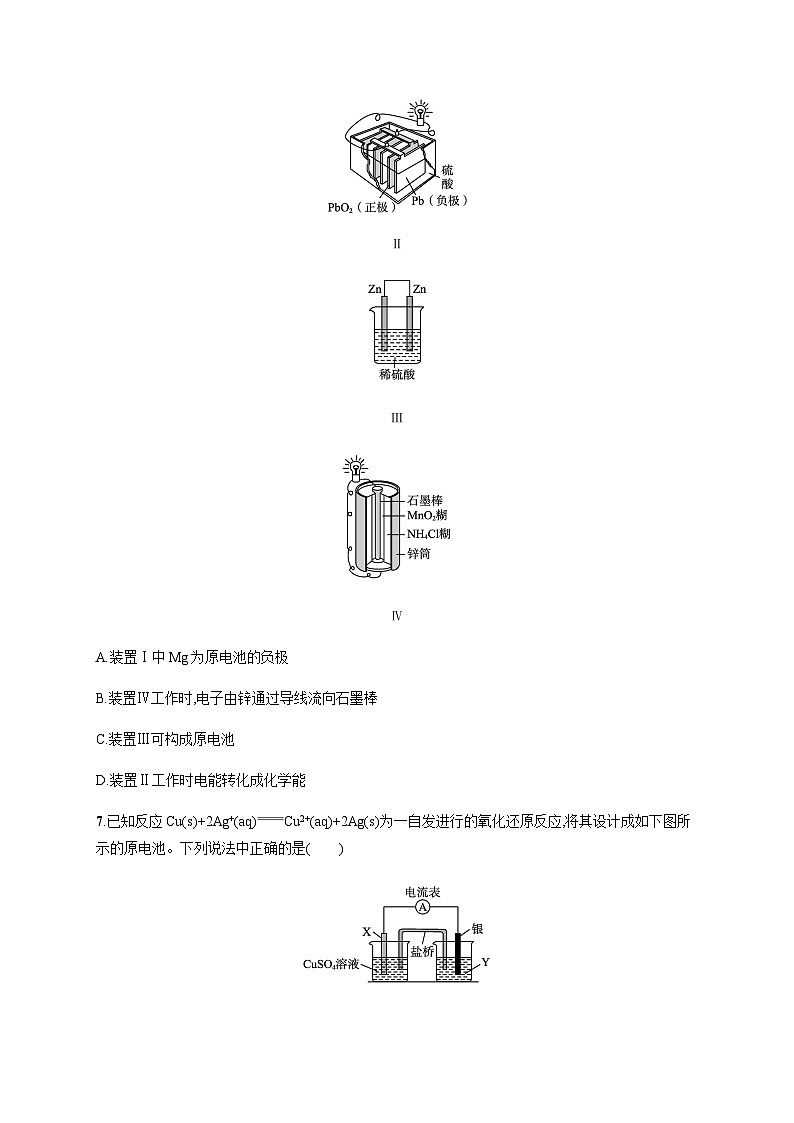
6.下列有关装置的说法正确的是( )
Ⅰ
Ⅱ
Ⅲ
Ⅳ
A.装置Ⅰ中Mg为原电池的负极
B.装置Ⅳ工作时,电子由锌通过导线流向石墨棒
C.装置Ⅲ可构成原电池
D.装置Ⅱ工作时电能转化成化学能
7.已知反应Cu(s)+2Ag+(aq)Cu2+(aq)+2Ag(s)为一自发进行的氧化还原反应,将其设计成如下图所示的原电池。下列说法中正确的是( )
A.电极X是正极,其电极反应为Cu-2e-Cu2+
B.银电极质量逐渐减小,Y溶液中c(Ag+)增大
C.X电极减少0.64 g时,电解质溶液中有0.02 mol电子转移
D.外电路中电流表的指针发生偏转
8.已知负极的电极反应式为Ag+Cl--e-AgCl。下列说法不正确的是( )
A.正极的电极反应式是Ag++e-Ag
B.电池总反应可表示为Ag++Cl-AgCl
C.反应时,盐桥中的NO3-移向KCl溶液
D.该电池证明:Ag+浓度越大,氧化性越弱
9.等质量的两份锌粉a、b,分别加入过量的稀硫酸中,同时向a中滴入少量的CuSO4溶液,如图表示产生H2的体积(V)与时间(t)的关系,其中正确的是( )
10.如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入M的浓溶液。一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑两球的浮力变化)( )
A.当M为AgNO3、杠杆为导体时,A端高,B端低
B.当M为CuSO4、杠杆为导体时,A端低,B端高
C.当M为盐酸、杠杆为导体时,A端高,B端低
D.当M为CuSO4、杠杆为绝缘体时,A端低,B端高
11.现有A、B、C、D和Cu五种金属片,将其分别用导线连接后浸入稀硫酸中(如图),每次实验时,通过灵敏电流计测出电子流动方向如下表:
实验分组
所用金属
电子流向
①
A、Cu
A→Cu
②
C、D
D→C
③
A、C
C→A
④
B、Cu
Cu→B
⑤
……
……
根据上述情况,回答下列问题:
(1)上述五种金属的活动性顺序是 。
(2)在①中,Cu片上观察到的现象是 。
(3)在②中,溶液中H+向金属片 移动。
(4)如果实验⑤用B、D,则导线中电流方向为 (填“B→D”或“D→B”)。
(5)已知反应:Cu+2Fe3+Cu2++2Fe2+。请用下列试剂和材料,用上图所示装置,将此反应设计成原电池并检验正极产物。
试剂:CuCl2溶液、FeCl3溶液、FeCl2溶液、KSCN溶液、K3[Fe(CN)6]溶液、H2O2溶液、NaOH溶液。
材料:Cu片、Fe片、石墨棒。
设计电池应选用的试剂和材料是 。
B级 关键能力提升练
12.硝酸汞和碘化钾溶液混合后会生成红色的碘化汞沉淀,为了探究硝酸汞和碘化钾溶液之间能否发生氧化还原反应,研究人员设计了如图的实验装置,结果电流计指针发生了偏转,下列分析正确的是( )
A.如图装置的电流方向是从C1经外电路到C2
B.C1是负极,发生的反应是2I--2e-I2
C.K+向C1电极流动
D.装置发生的总反应是Hg2++2I-HgI2↓
13.一学生用如图装置研究原电池原理,下列说法错误的是( )
A.图③中Zn片增加质量与Cu片减小质量的比为65∶64
B.图②中如果两极上都有气体产生,则说明Zn片不纯
C.图①中Cu片上没有气体产生
D.图②与图③中正极产物的质量比为1∶32时,Zn片减小的质量相等
14.如图是某校化学兴趣小组设计的一套原电池装置,下列有关描述正确的是( )
A.此装置能将电能转变为化学能
B.石墨电极的反应式:O2+2H2O+4e-4OH-
C.电子由石墨电极经导线流向Cu电极
D.电池的总反应式:2Cu+O2+4HCl2CuCl2+2H2O
15.(2023河北任丘一中高二期中)已知下图所示的原电池在工作时,右池中Y2O72-转化为Y3+。下列叙述正确的是( )
A.左池电极反应式:X4++2e-X2+
B.每消耗1 mol Y2O72-,转移3 mol电子
C.改变右池溶液的c(H+),电流大小不变
D.左池中阴离子数目增加
16.分析如图所示的四个原电池装置,其中结论正确的是( )
A.①②中Mg为负极,③④中Fe为负极
B.②中Mg为正极,电极反应式为6H2O+6e-6OH-+3H2↑
C.③中Fe为负极,电极反应式为Fe-2e-Fe2+
D.④中Cu为正极,电极反应式为2H++2e-H2↑
17.如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
A.外电路的电流方向为X→外电路→Y
B.若两电极分别为Fe和石墨,则X为石墨,Y为Fe
C.X极上发生的是还原反应,Y极上发生的是氧化反应
D.若两电极都是金属,则它们的活动性顺序为X>Y
18.下图是原电池的装置图。请回答:
(1)若溶液C为稀硫酸,电流表指针发生偏转,B电极材料为Fe且为负极,则A电极上发生的电极反应式为 ;反应进行一段时间后溶液C的pH将 (填“升高”“降低”或“基本不变”)。
(2)若需将反应Cu+2Fe3+Cu2++2Fe2+设计成如图所示的原电池装置,则A极(负极)材料为 ,B极(正极)材料为 ,溶液C为 。
(3)若溶液C为CuCl2溶液,电极材料是Zn和Cu,则Zn是 极,Cu极发生 反应,电极反应式为 。反应过程溶液中c(Cu2+) (填“变大”“变小”或“不变”)。
19.某校化学研究性学习小组欲设计实验验证Fe、Cu金属活动性的相对强弱,他们提出了以下两种方案。请你帮助他们完成有关实验项目:
方案Ⅰ:有人提出将大小相等的铁片和铜片分别同时放入稀硫酸(或稀盐酸)中,观察产生气泡的快慢,据此确定两金属的活动性。该原理的离子方程式为 。
方案Ⅱ:有人利用Fe、Cu为电极设计成原电池,以确定它们活动性的相对强弱。试在下面的方框内画出原电池装置图,标出原电池的电极材料和电解质溶液,并写出电极反应式。
正极反应式: ;
负极反应式: 。
方案Ⅲ:结合你所学的知识,帮助他们再设计一个验证Fe、Cu活动性相对强弱的简单实验方案(与方案Ⅰ、Ⅱ不能雷同): ,
用离子方程式表示其反应原理: 。
C级 学科素养拔高练
20.生活中使用的银器表面常常会发黑(生成Ag2S),利用原电池原理可将黑色物质除去,恢复银白色原貌。对于轻微腐蚀蒙有硫化银(Ag2S)的银器,可将其和铝片一起接触浸泡在稀NaOH溶液中,经一定时间后污迹消失,取出后用水洗干净,再用软布或棉团擦干。
(1)除去黑色物质的过程中,铝为原电池的哪一极?请写出两极的电极反应式。
(2)除去黑色物质的过程中,溶液中的OH-向哪极移动?
参考答案
专题1 分层作业4 原电池的工作原理
1.A 解析 锂离子电池为原电池,将化学能转化为电能,A项符合题意;硅太阳能电池是将太阳能转化为电能,B项不符合题意;电饭煲是将电能转化为热能,C项不符合题意;风力发电器是将风能转化为电能,D项不符合题意。
2.A 解析 A项为酸碱中和反应,没有电子的得失,不是氧化还原反应,所以不能设计成原电池。
3.C 解析 C项装置中不能形成闭合回路,所以不能构成原电池。
4.B 解析 由于Zn的金属活动性比Cu强,所以Zn为负极,Cu为正极,电子从负极(锌片)经外电路流向正极(铜片),A项正确;在正极,Cu2++2e-Cu,正极区溶液中阳离子减少,所以盐桥中K+向正极移动,B项错误;锌电极为负极,Zn失电子生成Zn2+,发生的反应为Zn-2e-Zn2+,C项正确;负极Zn失电子发生氧化反应,正极Cu2+得电子发生还原反应,实现了氧化反应和还原反应分开进行,D项正确。
5.A 解析 装置①为原电池,锌比铜活泼,锌为负极,铜为正极,盐桥中的K+向正极移动,即移向CuSO4溶液,A项正确;装置①中,锌为负极,发生氧化反应,B项错误;装置②中铁失去电子,C项错误;电子只能经过外电路,不能经过溶液,D项错误。
6.B 解析 Al能够与NaOH溶液反应,而Mg不能反应,所以装置Ⅰ中Mg为原电池的正极,Al为原电池的负极,A错误;装置Ⅳ中Zn为负极,石墨棒为正极,故装置Ⅳ工作时,电子由负极锌通过导线流向正极石墨棒,B正确;装置Ⅲ中两个电极都是Zn,因此不可构成原电池,C错误;装置Ⅱ工作时为原电池,化学能转化为电能,D错误。
7.D 解析 根据电池反应式可知,反应中Ag+被还原,应为正极反应,则电解质溶液为硝酸银溶液,Cu被氧化,应为原电池负极反应,则X为Cu,Y为硝酸银溶液。电极X的材料是铜,铜为原电池的负极,A错误;银电极为电池的正极,发生的电极反应为Ag++e-Ag,银电极质量逐渐增大,Y溶液中c(Ag+)减小,B错误;X电极的质量减少0.64 g,转移电子的物质的量为0.64 g64 g·mol-1×2=0.02 mol,电子不能在电解质溶液中转移,C错误;该装置为原电池,外电路中电流表的指针发生偏转,D正确。
8.D 解析 右边Ag电极为正极,则溶液中的Ag+在正极上得电子生成Ag,电极反应式是Ag++e-Ag,A项正确;负极反应式是Ag+Cl--e-AgCl,正极反应式是Ag++e-Ag,则电池总反应为Ag++Cl-AgCl,B项正确;反应时,由负极的电极反应式Ag+Cl--e-AgCl可知,溶液中阴离子减少,所以盐桥中的NO3-移向KCl溶液,C项正确;该电池中,左、右电极材料都为Ag,但左边电解质溶液为KCl溶液,右边电解质溶液为AgNO3溶液,由右边发生反应Ag++e-Ag,则证明Ag+浓度越大,氧化性越强,D项错误。
9.D 解析 由于锌粉是等量且少量的,a中Zn与CuSO4溶液反应置换出Cu,Zn的量减少,产生H2的量减少,但a中Zn、Cu和稀硫酸形成原电池,加快反应速率,D项图示符合要求。
10.B 解析 当M为AgNO3、杠杆为导体时,形成原电池,铁的金属活动性强于铜,因此铁是负极,失去电子,被氧化,铜是正极,溶液中的银离子在正极得到电子,发生还原反应析出银,因此A端低,B端高,故A项错误;当M为CuSO4、杠杆为导体时,形成原电池,铁的金属活动性强于铜,因此铁是负极失去电子,被氧化,铜是正极,溶液中的铜离子在正极得到电子,发生还原反应析出铜,因此A端低,B端高,故B项正确;当M为盐酸、杠杆为导体时,形成原电池,铁的金属活动性强于铜,因此铁是负极失去电子,被氧化,铜是正极,溶液中H+得到电子生成H2,铁球质量减小,铜球不变,因此A端低,B端高,故C项错误;当M为CuSO4、杠杆为绝缘体时,只发生Fe与硫酸铜溶液的反应,在Fe的表面析出Cu,质量变大,则A端高,B端低,D项错误。
11.答案 (1)D>C>A>Cu>B (2)有无色气泡生成
(3)C (4)B→D (5)FeCl3溶液、Cu片、石墨棒
解析 (1)原电池工作时,电子从负极经导线流向正极,负极较活泼,由电子流向可知金属的活动性:A>Cu、D>C、C>A、Cu>B,则金属的活动性顺序为D>C>A>Cu>B。
(2)在①中,Cu为正极,正极氢离子得电子被还原生成氢气,可观察到有无色气泡生成。
(3)在②中,溶液中H+向正极移动,即向C移动。
(4)如果实验⑤用B、D,因活动性BCu,Zn为负极,失去电子,发生氧化反应,电极反应式为Zn-2e-Zn2+,正极Cu上发生得到电子的还原反应,电极反应式为Cu2++2e-Cu,当电路中转移2 mol电子时,负极减小65 g,正极质量增加64 g,故图③中Zn片减小的质量与Cu片增加的质量比为65∶64,A错误;图②中Zn、Cu及H2SO4溶液构成原电池,负极Zn上发生反应Zn-2e-Zn2+,正极Cu上发生反应2H++2e-H2↑,如果两极上都有气体产生,则说明Zn片不纯,锌片上的杂质、Zn及稀硫酸构成原电池,在Zn片上也发生H+得到电子变为H2的还原反应,B正确;由于Cu在金属活动性顺序中位于H元素的后边,在图①中Cu片没有与Zn片连接,因此Cu片上不发生反应,因此没有气体产生,C正确;图②与图③都构成原电池,在图②中正极反应为2H++2e-H2↑,图③中正极反应为Cu2++2e-Cu。若两个正极产物的质量比为1∶32时,反应过程中转移电子的物质的量为(1 g2 g·mol-1×2)∶(32 g64 g·mol-1×2)=1∶1,由于负极都是Zn失去电子变为Zn2+,因此图②与图③中Zn片减小的质量相等,D正确。
14.D 解析 该装置为原电池装置,原电池装置能将化学能转变为电能,A项错误;装置中铜失电子被氧化,所以铜为负极,石墨为正极,酸性条件下不能生成氢氧根离子,电极反应为O2+4H++4e-2H2O,B项错误;由题图可知,Cu电极为负极,石墨电极为正极,电子从负极沿导线流向正极,即由Cu电极经导线流向石墨电极,C项错误;自发进行的氧化还原反应是铜在酸溶液中被氧气氧化生成氯化铜溶液,反应的化学方程式为2Cu+O2+4HCl2CuCl2+2H2O,D项正确。
15.D 解析 右池中Y2O72-转化为Y3+,Y元素化合价降低,则右池为正极,左池为负极;左池电极反应式为X2+-2e-X4+,故A错误;Y2O72-转化为Y3+,每消耗1 mol Y2O72-,转移6 mol电子,故B错误;氢离子参与右池反应,故改变右池溶液的c(H+),电流大小会发生变化,故C错误;左池为负极,盐桥中阴离子流入左池,左池中阴离子数目增加,故D正确。
16.B 解析 Mg比Al活泼,在①中Mg为负极,但在NaOH溶液中,Mg不反应,而Al可以反应,故②中Al为负极。在浓硝酸中铁会钝化,故Cu为负极,Fe为正极。在④中由于不断向Cu极附近通入空气,而O2比NaCl溶液中的H+得电子能力强,故Fe失去电子,在Cu极O2得到电子发生还原反应,电极反应式为O2+2H2O+4e-4OH-。
17.D 解析 根据题图知该装置是原电池,外电路中电子从X电极流向Y电极,电流的流向与此相反,即Y→外电路→X,A项错误;原电池中较活泼的金属为负极,较不活泼的金属或导电的非金属为正极,若两电极分别为Fe和石墨,则Y为石墨,X为Fe,B项错误;X是负极,负极上发生氧化反应,Y是正极,正极上发生还原反应,C项错误;原电池中较活泼的金属为负极,较不活泼的金属或导电的非金属为正极,该原电池中X是负极,Y是正极,所以若两电极都是金属,则它们的活动性顺序为X>Y,D项正确。
18.答案 (1)2H++2e-H2↑ 升高
(2)Cu 石墨(其他合理答案也可) FeCl3溶液(其他合理答案也可) (3)负 还原 Cu2++2e-Cu 变小
解析 (1)铁为负极,则该原电池反应是铁与稀硫酸的反应,所以正极反应是H+得电子生成H2,电极反应式为2H++2e-H2↑;溶液中H+放电,导致溶液中H+浓度减小,pH升高。(2)将反应Cu+2Fe3+Cu2++2Fe2+设计成如题图所示的原电池装置,根据离子方程式中物质发生的反应类型判断,Cu发生氧化反应,为原电池的负极,所以A极材料是Cu,B极材料是比Cu活泼性弱的导电物质如石墨、Ag等即可。溶液C中含有Fe3+,如FeCl3溶液。(3)Zn比较活泼,在原电池中为负极,Cu为正极,正极发生还原反应,Cu2+在正极得到电子变成Cu,电极反应为Cu2++2e-Cu,则c(Cu2+)变小。
19.答案 方案Ⅰ:Fe+2H+Fe2++H2↑
方案Ⅱ:
2H++2e-H2↑ Fe-2e-Fe2+
方案Ⅲ:把铁片插入CuSO4溶液中,一段时间后,观察铁片表面是否生成红色物质(合理即可) Fe+Cu2+Cu+Fe2+
20.答案 (1)负极 铝表面:Al+4OH--3e-AlO2-+2H2O 银表面:Ag2S+2e-2Ag+S2- (2)负极
解析 金属铝、硫化银和NaOH溶液构成了原电池,金属铝、硫化银分别充当了负极和正极,电极反应分别是在铝表面:Al-3e-Al3+,在碱性条件下,Al3+又与过量的OH-反应生成AlO2-,所以在铝表面的实际反应为Al+4OH--3e-AlO2-+2H2O,在银表面:Ag2S+2e-2Ag+S2-,溶液中的OH-向负极移动。
相关试卷
这是一份高中化学第一节 原电池精品第一课时习题,共10页。试卷主要包含了关于右图装置的叙述,正确的是,有关电化学知识的描述正确的是等内容,欢迎下载使用。
这是一份苏教版 (2019)选择性必修1第二单元 化学能与电能的转化当堂达标检测题,共30页。试卷主要包含了单选题,填空题,实验探究题等内容,欢迎下载使用。
这是一份化学选择性必修1第三单元 盐类的水解练习题,共12页。试卷主要包含了有关盐类水解的说法不正确的是,已知常温下,Ka=6,向三份0等内容,欢迎下载使用。










