沪科技版(2020)选择性必修2共价分子空间结构的预测当堂达标检测题
展开
这是一份沪科技版(2020)选择性必修2共价分子空间结构的预测当堂达标检测题,共15页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
2.1共价分子的空间结构同步练习-沪科版高中化学选择性必修2
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.有关苯分子中的化学键描述正确的是
A.每个碳原子的sp2杂化轨道中的其中一个形成π键
B.每个碳原子的未参加杂化的2p轨道形成π键
C.碳原子的三个sp2杂化轨道只形成两个σ键
D.1mol苯中含6molσ键
2.下列说法中正确的是
A.乙烯中C=C键的键能是乙烷中C−C键的键能的2倍
B.两个原子间形成共价键,最多只有一个σ键
C.N−O键的极性比C−O键的极性大
D.中4个N−H键的键能不相同
3.下列化学用语使用正确的是
A.含有1个中子的氢核素: B.基态溴原子的价电子排布式:
C.的VSEPR模型: D.二氧化硅的分子式:
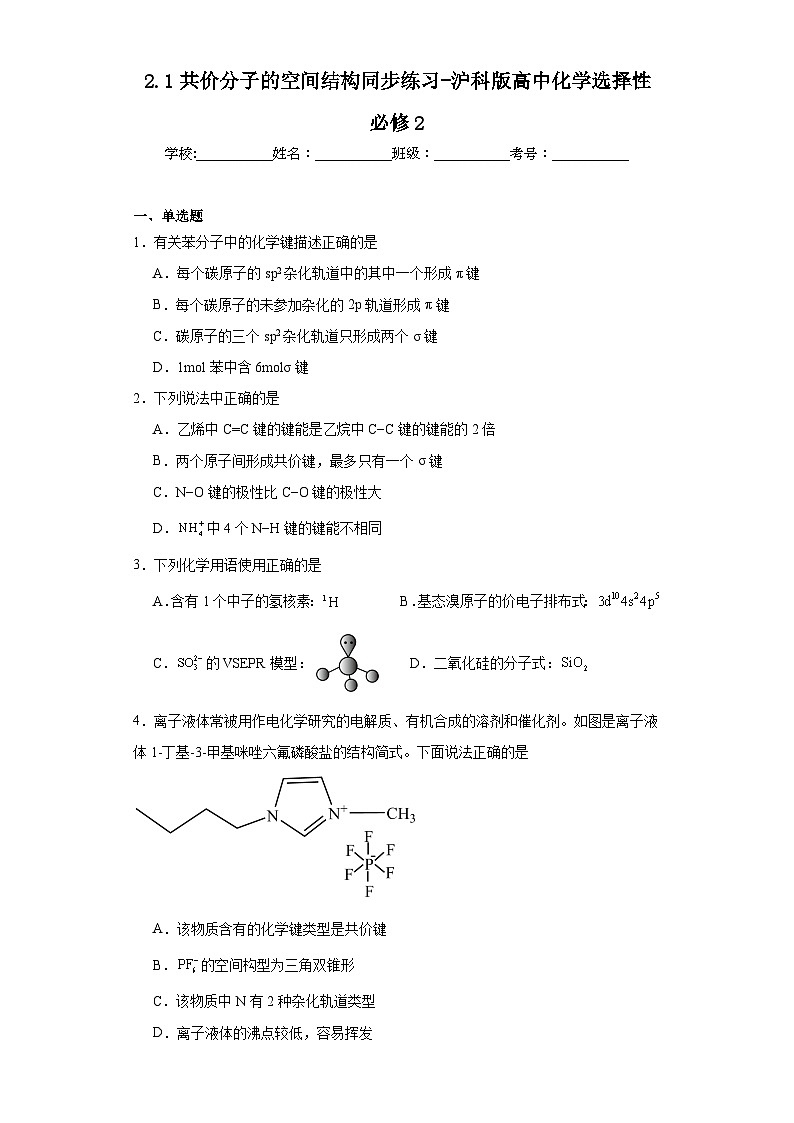
4.离子液体常被用作电化学研究的电解质、有机合成的溶剂和催化剂。如图是离子液体1-丁基-3-甲基咪唑六氟磷酸盐的结构简式。下面说法正确的是
A.该物质含有的化学键类型是共价键
B.的空间构型为三角双锥形
C.该物质中N有2种杂化轨道类型
D.离子液体的沸点较低,容易挥发
5.类比法是一种学习化学的重要方法,下列类比法结论错误的是
A.的空间结构为三角锥形,则的空间结构也为三角锥形
B.可燃冰中可以装在以氢键相连的几个水分子构成的笼内,则、等也可以
C.酸性强于,则可推出酸性强于
D.NaCl固体与浓硫酸共热可制HCl,则NaI固体与浓硫酸共热可制HI
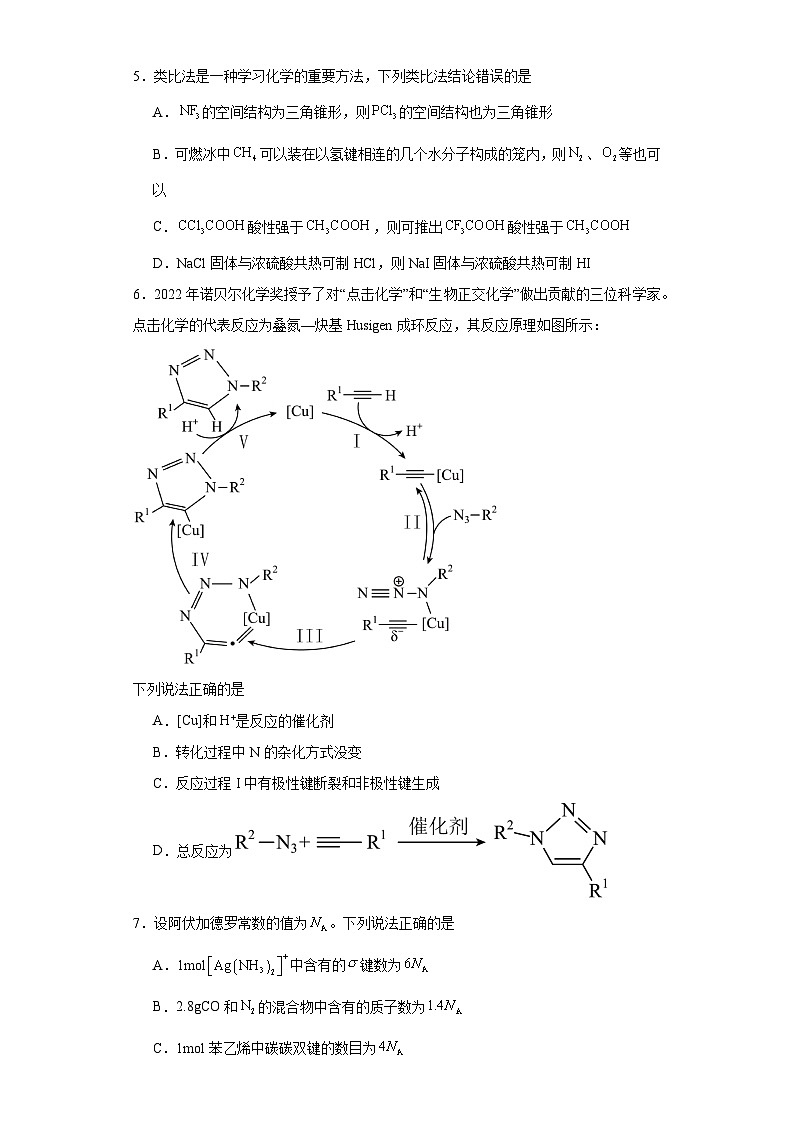
6.2022年诺贝尔化学奖授予了对“点击化学”和“生物正交化学”做出贡献的三位科学家。点击化学的代表反应为叠氮—炔基Husigen成环反应,其反应原理如图所示:
下列说法正确的是
A.[Cu]和H+是反应的催化剂
B.转化过程中N的杂化方式没变
C.反应过程I中有极性键断裂和非极性键生成
D.总反应为
7.设阿伏加德罗常数的值为。下列说法正确的是
A.1mol中含有的键数为
B.2.8gCO和的混合物中含有的质子数为
C.1mol苯乙烯中碳碳双键的数目为
D.0.5mol乙酸乙酯在酸性条件下水解,生成乙醇的分子数为
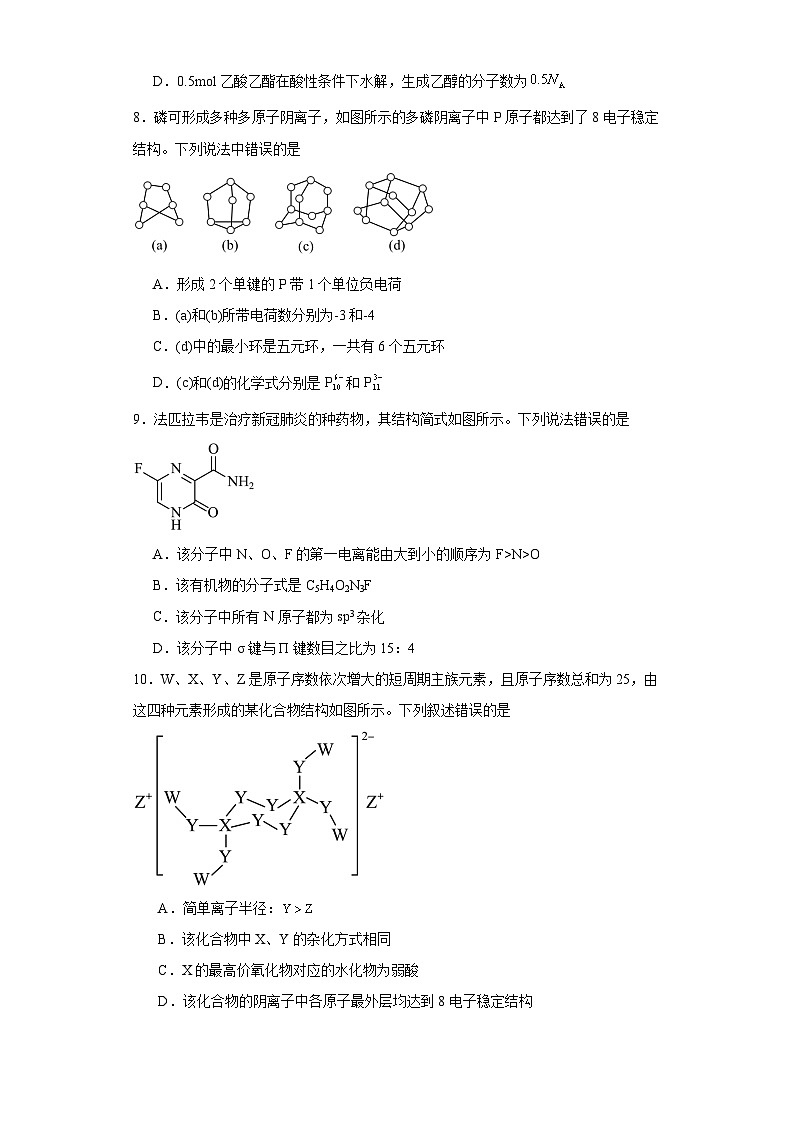
8.磷可形成多种多原子阴离子,如图所示的多磷阴离子中P原子都达到了8电子稳定结构。下列说法中错误的是
A.形成2个单键的P带1个单位负电荷
B.(a)和(b)所带电荷数分别为-3和-4
C.(d)中的最小环是五元环,一共有6个五元环
D.(c)和(d)的化学式分别是P和P
9.法匹拉韦是治疗新冠肺炎的种药物,其结构简式如图所示。下列说法错误的是
A.该分子中N、O、F的第一电离能由大到小的顺序为F>N>O
B.该有机物的分子式是C5H4O2N3F
C.该分子中所有N原子都为sp3杂化
D.该分子中σ键与Π键数目之比为15:4
10.W、X、Y、Z是原子序数依次增大的短周期主族元素,且原子序数总和为25,由这四种元素形成的某化合物结构如图所示。下列叙述错误的是
A.简单离子半径:
B.该化合物中X、Y的杂化方式相同
C.X的最高价氧化物对应的水化物为弱酸
D.该化合物的阴离子中各原子最外层均达到8电子稳定结构
二、填空题
11.用VSEPR 理论判断:
物质
孤对电子对数
轨道杂化形式
空间构型
SO3
PO
NCl3
CO2
12.如图是元素周期表的一部分:
(1)写出元素①的元素符号 ,与①同周期的主族元素中,第一电离能比①大的有 种。该周期的某种元素基态原子的核外电子排布式为,则该元素在元素周期表中的位置为 。
(2)基态锑(Sb)原子的价电子排布式为 。(氟酸锑)是一种超强酸,离子的空间构型为 ,写出一种与互为等电子体的分子 。
(3)处于分界线的元素Al可形成多种化合物。
中三种元素的基态原子的第一电离能从大到小的顺序是 (填元素符号)。
中铝的杂化方式为 ,其中阴离子的立体结构为 ,
(4)下列说法正确的是
a.、SiC,是空间构型均为正四面体的三种物质,键角与其他两种物质不同的是SiC
b.基态P原子中,电子占据的最高能级符号为M
c.Sb位于p区
d.升温实现液氨→氨气→氮气和氢气变化的阶段中,微粒间破坏的主要的作用力依次是氢键、极性共价键
(5)周期表中元素的性质呈现出周期性变化。元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能()。第二周期部分元素的变化趋势如图所示,其中除氮元素外,其他元素的自左而右依次增大的原因是 ;氮元素的呈现异常的原因是 。
13.所有共价键都有方向性和饱和性吗?根据成键原子轨道举出反例 。
14.氯吡苯脲是一种常用的膨大剂,其结构简式如图,它是经国家批准使用的植物生长调节剂。
(1)氯元素基态原子核外电子有 种不同运动状态的电子,未成对电子数为 。
(2)膨大剂能在动物体内代谢,其产物较为复杂,其中有H2O、NH3、CO2等。
①请用共价键知识解释H2O分子比NH3分子稳定的原因为 。
②H2O、CO2分子的空间结构分别是 。
(3)查文献可知,可用2−氯−4−氨基吡啶与异氰酸苯酯反应,生成氯吡苯脲,其反应方程式如图:
反应过程中,每生成1mol氯吡苯脲,断裂 个σ键,断裂 个π键。(NA为阿伏加德罗常数)
15.根据氢气分子的形成过程示意图(如下图)回答问题:
(1)H—H键的键长为 ,①~⑤中,体系能量由高到低的顺序是 。
(2)下列说法中正确的是_______。
A.氢气分子中含有一个π键
B.由①到④,电子在核间出现的几率增大
C.由④到⑤,必须消耗外界的能量
D.氢气分子中含有一个极性共价键
(3)几种常见化学键的键能如下表:
化学键
Si—O
H—O
O=O
Si—Si
Si—C
键能/kJ·mol-1
460
464
498
176
x
比较Si—Si键与Si—C键的键能大小:x (填“>”、“Na 正四面体
(4)cd
(5) 同周期元素随核电荷数依次增大,原子半径逐渐变小,故结合一个电子释放出的能量依次增大 N原子的2p轨道为半充满状态相对稳定,故不易结合一个电子
13.所有的共价键都有饱和性,但并不是所有的共价键都有方向性,如s-s σ键就没有方向性。
14.(1) 17 1
(2) H−O键的键能大于H−N键的键能,所以H2O分子比NH3分子稳定 V形、直线形
(3) NA NA
15.(1) 0.074nm ①⑤②③④
(2)BC
(3)>
16.碳原子最外层有4个电子,可与很多种原子之间形成共价键,碳原子之间也有碳碳单键、碳碳双键、碳碳三键,可以形成链状,也可以形成环状,形成多种多样的化合物。比如,含10个碳原子的烷烃有75个构造异构体,含15个碳原子的烷烃有4347个构造异构体;当碳原子数增加到20时,构造异构体数目竟高达366319个,对于构成生命的重要物质蛋白质,其分子中碳原子数远大于20,并且还连有、、、等不同的基团;并且键的键能是305,、键的键能在260左右,它们很容易通过反应转变为新的化合物,相对于其他诸多单键的键能,键的键能是比较大的,在转化中能保持碳骨架的相对稳定,以形成更加复杂的有机物;而对于键的键能相对较小,硅及其化合物多以固态存在,不易形成复杂的化合物。所以地球上的生命体中的物质多以碳原子作为分子的“骨架”。
17.(1) 或 第四周期ⅠB族
(2)
(3)或
(4)和
(5)3
(6)7
(7) 四面体形 V形 4 氢键具有方向性
18.(1)在原子数目相同的条件下,N2比N4具有更低的能量,而P4比P2具有更低的能量,能量越低越稳定
(2)AD
19.(1) O3是极性分子,O2是非极性分子,水是极性溶剂,根据相似相溶原理,O3在水中的溶解度比O2在水中的溶解度大 晶体存在各向异性
(2)
(3) 3:1 sp2
(4)C
20.(1) 成键电子对数 孤电子对数
(2) 彼此远离 对称 直线形 平面三角形 正四面体结构
21.(1)Cu2(OH)2SO4+8NH3·H2O=2[Cu(NH3)4]2+ +SO+2OH- +8H2O
(2) 晶体受热易脱水脱氨(“晶体受热易分解”或“加热烘干变质”) 为了使乙醇较慢的从漏斗中流出来并与晶体充分接触,提高洗涤的效果
(3) C B
(4)ACD
(5) pH NH4Cl
22.(1) +3 V
(2) 球形干燥管 饱和食盐水 浓硫酸 除去装置中的空气和水蒸气,避免空气与NO反应,也避免产物的水解;
(3)2HNO2 = NO↑ +NO2 ↑+ H2O
(4) 抑制三价铁的水解 98.25%
23.(1) 3d6 正四面体
(2) 恒压滴液漏斗 除去水中溶解的氧气,防止Fe2+被氧化
(3)避免产品中混入铁粉
(4)pH降低,不利于沉淀的生成;pH过高,会生成Fe(OH)2沉淀
(5)5Fe2++MnO+8H+=5Fe3++Mn2++4H2O
相关试卷
这是一份高中化学第2节 共价键与分子的空间结构综合训练题,共38页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
这是一份化学选择性必修2第2节 共价键与分子的空间结构当堂检测题,共13页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
这是一份高中化学鲁科版 (2019)选择性必修2第2节 共价键与分子的空间结构课后练习题,共13页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。










