



所属成套资源:高一化学同步教学课堂 人教版2019必修第一册 教学课件
人教版 (2019)必修 第一册第一节 物质的分类及转化教学课件ppt
展开
这是一份人教版 (2019)必修 第一册第一节 物质的分类及转化教学课件ppt,共25页。PPT课件主要包含了学习目标,课堂小结等内容,欢迎下载使用。
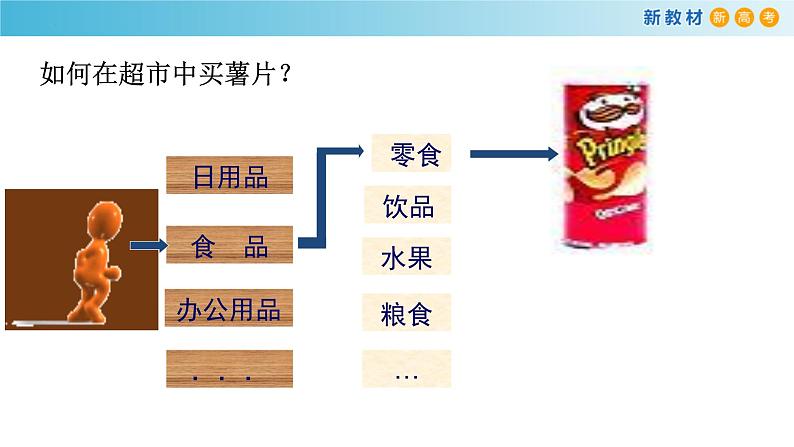
图书馆、超市、药房、书店、快递公司等地方都利用了分类的手段,可以提高日常生活、学习和工作的效率
第1课时 简单分类法及其应用
了解物质分类的方法和依据; 认识元素可以组成不同种类的物质,根据物质的组成和性质可以对物质进行分类(重点、难点);感受分类方法对化学学科研究和化学学习的重要作用。
科学分类的前提是建立科学准确的分类标准 。
科学的分类能够反映事物的本质特征,有利于深入研究,那么怎样才能保证分类的科学性?
分类是提高效率的一种重要手段
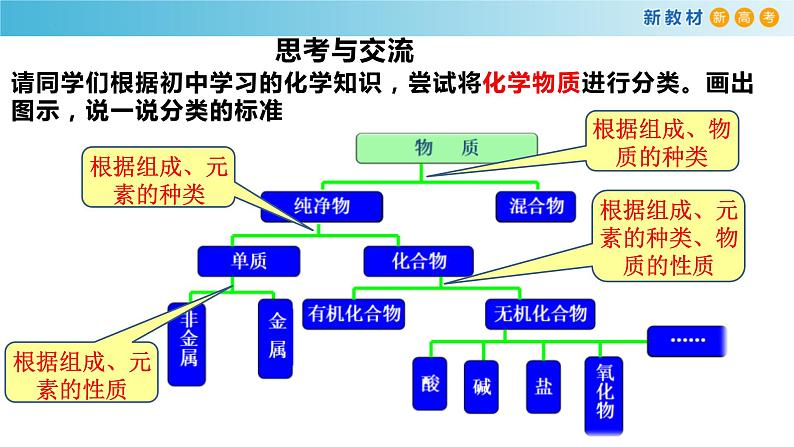
一、根据物质的组成和性质分类
任何物质都是由元素组成的,根据元素组成对物质进行分类是化学研究的基础。只有一种元素组成的物质叫单质;由两种或两种以上种类元素组成的物质是化合物。
请同学们根据初中学习的化学知识,尝试将化学物质进行分类。画出图示,说一说分类的标准
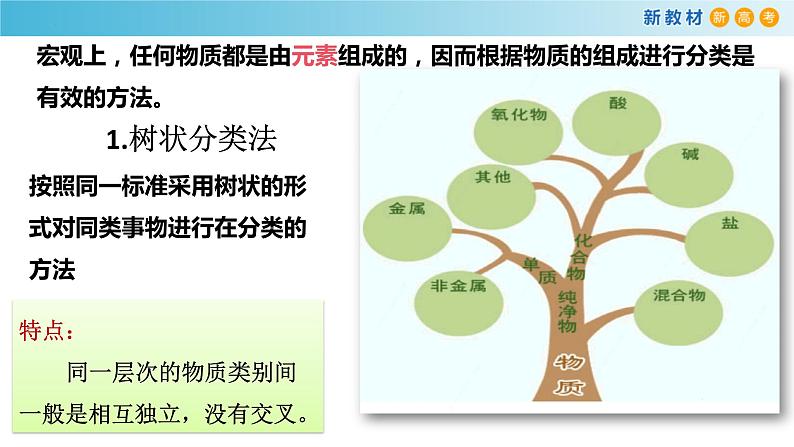
宏观上,任何物质都是由元素组成的,因而根据物质的组成进行分类是有效的方法。
按照同一标准采用树状的形式对同类事物进行在分类的方法
特点:同一层次的物质类别间一般是相互独立,没有交叉。
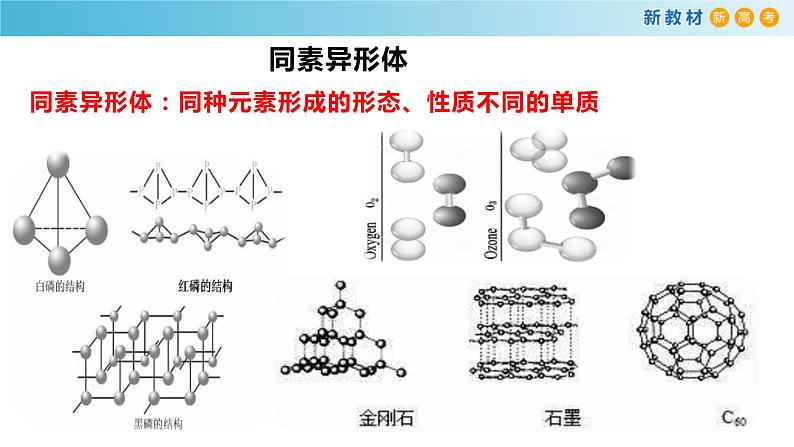
同素异形体:同种元素形成的形态、性质不同的单质
石墨、金刚石都是由碳元素构成的单质,为什么物理性质却各不相同呢?
碳原子的 排列方式不 同
结 构 不同
平面层状结构质软可做润滑剂
空间网状正四面体型结构天然最硬的物质可做切割刀
结构决定性质性质决定用途
注意: 由同一种元素组成的物质不一定是单质,还可能是混合物,如O2和O3的混合物。
根据元素的组成可以将下列物质:CO2、Na2O、SO2、MgO、SO3、CaO分为金属氧化物和非金属氧化物,试分析它们的化学性质,还可以怎样分?
CO2 + Ca(OH)2 == CaCO3↓ + H2O
MgO + 2HCl == MgCl2 + H2O
H2CO3→ CO2 H2SO4→ SO3HNO3→N2O5 HMnO4→Mn2O7
Ca(OH)2→ CaOFe(OH)3→ Fe2O3NaOH→Na2O
1.判断CO、NO是否为酸性氧化物CO、NO不是酸性氧化物,没有对应酸,不能与碱反应生成对应盐和水
2.概念辨析1、金属氧化物一定是碱性氧化物?2、非金属氧化物一定是酸性氧化物?2、酸性氧化物都能溶于水生成相应的酸?
Mn2O7是酸性氧化物
如SiO2是酸性氧化物,但不溶于水
经验规律:大多数非金属氧化物属于酸性氧化物,大多数金属氧化物属于碱性氧化物3.碱性氧化物一定是金属氧化物。
除了CO、NO、NO2等
除了Al2O3、Mn2O7、Na2O2等
SO2、CO2、P2O5
Na2O、CaO、Fe2O3
氧化物:含有两种元素,其中一种是氧元素的化合物
能与碱反应生成盐和水的氧化物,如CO2、SO3等
能与酸反应生成盐和水的氧化物,如CaO、Na2O等
既能与酸反应生成盐和水,又能与碱反应生成盐和水 的氧化物,如Al2O3等
既不能与酸反应生成盐和水,又不能与碱反应生成 盐和水的氧化物,如CO、NO等。
酸:电离时生成的阳离子全部为氢离子的化合物。如H2SO4按是否含氧分为含氧酸和无氧酸 HNO3 HCl 按有无挥发性分为挥发性酸和难挥发性酸 HNO3 、HCl H2SO4按最多电离H+个数分为一元酸 、二元酸和多元酸 HCl H2CO3 H3PO4
已知H3PO3(亚磷酸)与足量的NaOH完全反应最终生成Na2HPO3,反应方程式为 H3PO3+2NaOH==Na2HPO3+2H2O请试着分析H3PO3(亚磷酸)属于几元酸?提示: HCl+NaOH==NaCl+H2O答案:H3PO3(亚磷酸)是二元酸 拓展:按在水溶液中是否完全电离分为强酸和弱酸六大强酸:HNO3 、HCl 、H2SO4 、HBr、HI、HClO4
碱:电离时生成的阴离子全部为氢氧根的化合物。如NaOH按最多电离OH-个数分为一元碱 、二元碱和多元碱 NaOH Ca(OH)2 Fe(OH)3按在水溶液中是否完全电离分为强碱和弱碱四大强碱: NaOH、KOH、Ba(OH)2 、Ca(OH)2
盐:电离时生成金属阳离子(或铵根)和酸根的化合物。按在水溶液的溶解性分为可溶性盐 和难溶性盐 常见物质溶解性:碳酸只溶钾钠铵,溶碱钾钠铵钡钙 硫酸不溶钙钡银,盐酸不溶氯化银按在水溶液中能否电离H+、OH-分为酸式盐、碱式盐和正盐
酸式盐:在水溶液中能电离出H+ 如NaHCO3碱式盐:在水溶液中能电离OH- 如Cu(OH)2CO3正盐:电离时只生成金属阳离子(或铵根)和酸根 如NaCl
O2、Fe、空气、H2SO4、NaOH、NaCl、Na2CO3、CuSO4溶液、HCl、Ca(OH)2、CO2、CaO
HCl、 H2SO4
NaOH 、Ca(OH)2
Na2SO4 、 CaCO3
同一种事物可以按不同标准(角度)进行分类。标准不同进行分类产生的分类结果就不同。
特点:物质类别间有交叉的部分
[例2]找出一种不同于其它种的物质A. Na2CO3 Na2SO4 NaCl K2CO3 B. Na2CO3 K2CO3 Na2SO4 CaCO3 C. Na2CO3 K2CO3 KCl K2SO4D. Na2CO3 Na2SO4 K2SO4 MgSO4
1、元素与物质的关系:(1)任何物质都是由元素组成的。(2)每一种元素都可以形成单质,如N2、H2、Na。(3)绝大多数元素都能与其他元素形成化合物,如 NH3、NaOH、NaCl。同素异形体:由同一种元素形成的几种性质不同的单质,叫做这种元素的同素异形体。2、常见分类法:(1)树状分类法:含义:按照同一标准对同类事物进行再分类的一种方法。特点:同一层次的物质类别间一般相互独立、没有交叉。(2)交叉分类法:含义:根据多种不同的分类标准对同一事物进行分类的方法。特点:物质类别间有交叉的部分。
1.下列每组中的两种物质之间的关系为同素异形体的一组是 A.CaO和CaS B. HCNO和HOCN C.C60和C70 D. 和
2.已知:2Na2O2 + 2H2O = 4NaOH + O2,Na2O2不属于( ) A.氧化物 B.碱性氧化物 C.金属氧化物 D.化合物
3.同学们吃的零食的包装袋中经常有一个小纸袋,上面写着“干燥剂”,其主要成分是生石灰(CaO)。(1)生石灰属于哪种类别的物质?(2)生石灰可做干燥剂的理由是什么?(用化学方程式表示)
生石灰能够强烈吸收水分,是碱性干燥剂的主要成分,吸水后氧化钙与水生成氢氧化钙: CaO+H2O===Ca(OH)2(放出大量热)
4、用交叉分类法对下列物质进行分类
5.下列有五组物质,每组中有一种物质从某种角度分析与其它三种不同。请找出该物质,并说明理由。 ⑴Fe、S、C、P ⑵H2、O2、N2、S ⑶Fe2O3、NaCl、CuO、H2O ⑷AgCl、BaSO4、KNO3、CaCO3 ⑸CuSO4、FeCl3、KMnO4、K2CO3










