




所属成套资源:中考化学一轮单元总复习课件 (含答案)
中考化学一轮单元总复习课件 第八单元 金属和金属材料 (含答案)
展开
这是一份中考化学一轮单元总复习课件 第八单元 金属和金属材料 (含答案),共60页。PPT课件主要包含了核心知识·建构脉络图,主干回顾·厚积知识力,紫红色,含碳量,金属氧化物,星四射,生成黑色固体,盐+氢气,浅绿色,新盐+新金属等内容,欢迎下载使用。
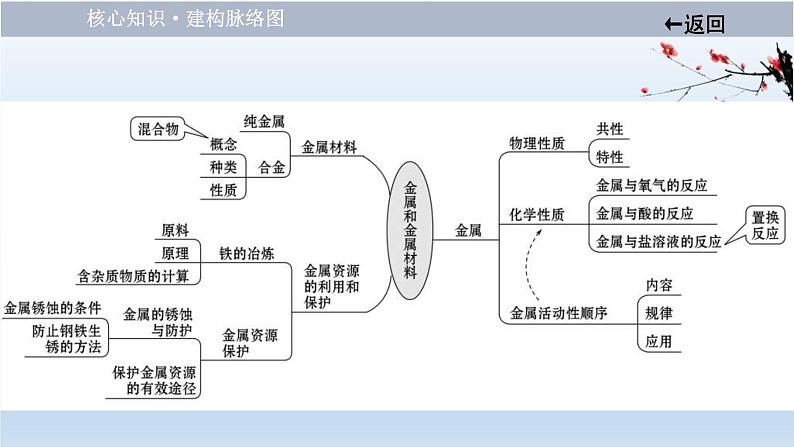
知识点一、金属材料1.金属材料的分类:
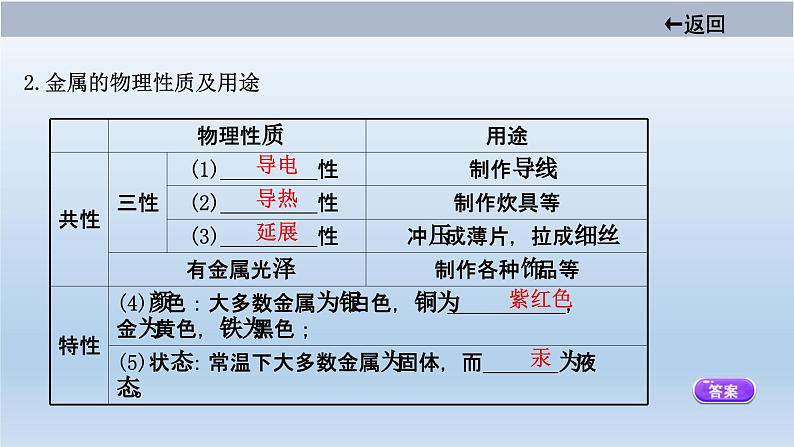
2.金属的物理性质及用途
【微提醒】1.合金一定是混合物,可由多种金属和金属或非金属熔合而成,该过程没有生成新物质,属于物理变化。2.合金中一定有金属存在,但不一定都是金属与金属熔合而成,还有可能是金属与非金属熔合而成。
【判对错】 1.生铁是纯净物;( )2.金属材料包括纯金属与合金;( )3.纯铜的硬度大于黄铜的硬度。( )
知识点二、金属的化学性质1.与氧气反应:(1)规律:金属+氧气 _______________。
(2)常见金属与氧气反应的比较。
2Mg+O2 ====2MgO
4Al+3O2 ====2Al2O3
3Fe+2O2 Fe3O4
2Cu+O2 2CuO
2.与稀盐酸、稀硫酸反应:(1)规律:金属+酸→____________。 (2)反应发生的条件:排在金属活动性顺序中_________的金属与_________发生反应。
(3)反应现象及化学方程式。
Mg+2HCl====MgCl2+H2↑
Mg+H2SO4====MgSO4+H2↑
Zn+2HCl====ZnCl2+H2↑
Zn+H2SO4====ZnSO4+H2↑
Fe+2HCl====FeCl2+H2↑
Fe+H2SO4====FeSO4+H2↑
3.与盐溶液反应:(1)规律:金属+盐 ________________。 (2)反应发生的条件。①必须是_____________置换_______________(K、Ca、Na除外)。 ②反应中的盐必须___________。
(3)常见金属与盐的反应。
Fe+CuSO4 ====Cu+FeSO4
2Al+3CuSO4 ====Al2(SO4)3+3Cu
Cu+2AgNO3====Cu(NO3)2+2Ag
【微思考】铝制品和黄金制品都耐腐蚀,其原理是否相同?提示:不相同。铝制品耐腐蚀是因为铝与氧气反应时,生成一层致密的氧化铝保护膜,黄金制品耐腐蚀是因为金的化学性质稳定,不与氧气反应。
【微提醒】铁单质与稀盐酸、稀硫酸、盐溶液发生置换反应只能生成+2价的亚铁离子(溶液呈浅绿色),不能生成+3价的铁离子(溶液呈黄色)。
【判对错】 1.将铁丝伸入盐酸中,溶液变成黄色。( )2.铜能置换出酸中的氢。( )3.银不能把铁从氯化亚铁溶液中置换出来。( )
知识点三、金属活动性顺序1.金属活动性顺序:
2.意义:在金属活动性顺序里:(1)金属的位置越靠前,它的活动性_________。 (2)位于_______前面的金属能置换出酸中的_______。 (3)_____________的金属能把_____________的金属从它们的化合物溶液里置换出来(K、Ca、Na除外)。
【微提醒】K、Ca、Na的金属活动性很强,与盐溶液接触时,会先和溶液中的水发生剧烈反应生成相应的氢氧化物,生成物再与该盐溶液反应,所以K、Ca、Na不能将盐溶液中的金属置换出来。
【判对错】1.金属活动性顺序表中位置越靠前越容易冶炼。( )2.CuCl2可以用金属铜与稀盐酸反应制得。( )3.金属与酸和盐溶液的置换反应遵循“氢前可换氢”,“前金换后金”的规律。( )
知识点四、金属资源的利用和保护1.铁的冶炼(1)原料:铁矿石、焦炭、石灰石和空气(2)原理(以氧化铁为例) _____________________ (3)实验探究:(详见【实验突破 强化探究力】P70)
3CO+Fe2O3 2Fe+3CO2
2.金属资源的保护(1)钢铁锈蚀的原因铁制品的锈蚀过程,实际上是铁与空气中的_________和_______等发生化学反应的过程。 (2)防止钢铁生锈的方法①保持铁制品表面的洁净干燥②铁制品表面涂保护层,如涂油、刷漆、镀耐磨和耐腐蚀的金属等③改变金属的内部结构,如制成合金等。
【微提醒】铁燃烧与铁生锈的实质相同,发生的都是氧化反应;但铁燃烧是剧烈的氧化反应,产物是Fe3O4,呈黑色;而铁生锈则属于缓慢氧化,产物的主要成分是Fe2O3,呈红棕色。
【判对错】 1.生活中不易洗净的铝锅可以用钢丝球刷洗。( )2.铁锈蚀后没有回收利用价值。( )3.铁生锈后可以用砂纸打磨去掉表面的铁锈,可以有效阻止锈蚀加重。( )
【核心反应】请以铁(Fe)为中心,按照思路盘点并规范书写化学方程式。
①______________________②___________________________、 ____________________________③__________________________ ④______________________________、 __________________________________ ⑤____________________________
3Fe+2O2 Fe3O4
Fe +H2SO4====FeSO4+ H2↑
Fe+ 2HCl====FeCl2+ H2↑
Fe+ CuSO4====FeSO4+ Cu
Fe2O3+ 6HCl====2FeCl3+ 3H2O
Fe2O3 +3H2SO4====Fe2(SO4)3+ 3H2O
3CO+ Fe2O3 2Fe +3CO2
考点一 金属活动性顺序的判断及应用类型1 金属活动性顺序的判断【典例1】(2020·聊城中考)把X、Y、Z三种金属分别加入稀盐酸中,Y表面有气泡产生,X、Z无明显变化;再把X放到Z的硝酸盐溶液中,X的表面有固体析出,则三种金属的活动性顺序是( )A.Y>X>Z B.Y>Z>XC.X>Z>YD.Z>X>Y
【方法点拨】判断金属活动性顺序的方法(1)金属与氧气的反应:金属与氧气反应越剧烈,说明金属活动性越强;(2)金属与酸的反应:金属与盐酸、稀硫酸反应越剧烈,说明金属活动性越强;(3)金属与盐溶液的反应:一般金属能与盐溶液反应,说明该金属的活动性比盐中的金属活动性强;(4)金属活动性顺序表中:金属位置越靠前,活动性越强;(5)在自然界的存在形式:以化合物形式存在的金属比以单质形式存在的金属活动性强。
【一例一练】(2020·湘西州中考)将甲、乙两种金属片分别放入CuSO4溶液中,甲表面析出金属Cu,乙表面没有发生反应,据此判断,三种金属的活动性顺序是( )A.甲>铜>乙 B.铜>甲>乙C.乙>铜>甲D.甲>乙>铜
类型2 反应后滤液、滤渣成分的推断【典例2】(2020·济宁中考)向AgNO3、Cu(NO3)2的混合溶液中加入一定量的锌粉,充分反应,过滤。下面对反应结果的判断,不正确的是世纪金榜导学号( )A.若反应后溶液为蓝色,滤渣中一定不含有ZnB.若反应后溶液为蓝色,滤渣中一定含有Ag,可能含有CuC.若反应后溶液为无色,滤渣中一定含有Ag和CuD.若反应后溶液为无色,滤渣中一定不含有Zn
【答题指导】(1)一种金属与多种金属的盐溶液反应和多种金属与一种金属的盐溶液反应时按照优先反应原则(即活动性顺序表中“远距离先发生”规律)进行判断。如本题Zn先与AgNO3溶液反应,再与Cu(NO3)2溶液反应。(2)反应后滤渣、滤液成分的分析(以本题为例):
【一例一练】(2020·齐齐哈尔中考改编)向硝酸银溶液中加入一定质量的锌粉和铜粉的混合物,充分反应后过滤,得到滤渣和滤液。以下推断正确的是( )世纪金榜导学号A.若向滤渣中加入稀盐酸有气泡产生,则滤渣中一定有银、铜、锌B.若滤液为无色,则滤渣中一定有锌C.若滤液为蓝色,则滤液中一定有硝酸银、硝酸铜和硝酸锌D.滤渣的质量一定比反应前锌粉和铜粉混合物质量小
考点二 金属与酸反应的图象分析【典例3】(2020·襄阳中考)向质量均为m的锌粉和铁粉中分别滴加100 g相同质量分数的稀硫酸,反应过程中产生气体的质量与所加稀硫酸的质量关系如图所示,下列叙述正确的是( )A.反应后均得到无色溶液B.反应结束后两种金属均有剩余C.折线b表示的是铁和稀硫酸反应的情况D.反应结束后所得溶液的质量相等
【方法点拨】活泼金属与盐酸(或稀硫酸)反应的坐标图象分析方法1.等质氢图:两种金属反应产生的氢气质量相同,如图所示反映两种情况: (1)酸不足,金属过量,产生的氢气质量由酸的质量决定。(2)酸足量,投放的两种金属与酸反应产生氢气的质量恰好完全相同,如6.5 g锌和5.6 g铁分别投入足量的盐酸中反应产生的氢气质量相同。
2.等质等价金属图:如等质量的镁、铁、锌与足量的酸反应生成的金属阳离子都是+2价,产生氢气的速率和质量不同,如图所示反映两种情况: (1)金属越活泼,图示反应物的线越陡,如Mg线比Zn线陡,Zn线比Fe线陡。(2)金属的相对原子质量越小,与酸反应产生的氢气越多,曲线的拐点越高。可简单概括为:越陡越活,越高越小。
3.等质不等价金属图: 铝、镁、锌与酸反应生成金属阳离子的化合价分别为+3、+2、+2,如图所示反映出等质不等价金属与酸反应不仅速率不同而且产生氢气的质量与金属化合价有关。可用下式计算氢气质量:m(H2)=
【一例一练】(2020·丽水中考)取一定质量的锌粒和铜片于同一敞口容器中,再逐渐加入稀硫酸。加入稀硫酸的质量与有关量的变化关系图正确的是 ( )
实验一 一氧化碳还原氧化铁的实验探究 1.实验原理:在高温条件下,用还原剂CO将铁从铁矿石中还原出来。发生反应的化学方程式为 _____________________ 。 2.实验装置:
4.实验现象:玻璃管中的红棕色固体变为_________;试管内澄清石灰水___________;导管口产生_____________。 5.注意事项:一氧化碳有毒,实验装置中必须有尾气处理装置(点燃或用气球收集)。
【质疑·创新】1.实验中CO能否用木炭代替,_______(填“能”或“否”),理由是______________________。 2.教材实验是否有需要完善的地方?由于氢氧化钙的溶解度小,如教材所示方法不能将产生的二氧化碳完全吸收,所以排出的尾气中的成分为___________,可能无法持续燃烧。用酒精灯燃烧法处理尾气,从能源利用率角度考虑主要的不足是_________________。
3.若对教材实验进行改进,改进的方向主要体现在哪些方面?如图为常见的几种实验装置的改进,分析思考:改进后的装置具备的一个共同优点是:___________________。
【典例研析】 【原型题】(2020·邵阳中考)下图是实验室模拟工业炼铁的实验装置图,下列说法不正确的是( )世纪金榜导学号
A.B处玻璃管内发生的化学反应是氧化还原反应,还原剂是COB.在点燃酒精喷灯前,应先通入CO气体排尽装置中的空气C.该实验可以观察到B处固体从黑色逐渐变成红色D.该模拟实验缺少尾气处理装置,会污染空气
【拓展延伸】如何证明生成黑色物质为铁? 提示:实验前后分别用磁体吸引,或取反应后所得的黑色固体滴加稀盐酸有气泡产生。
【变式题1】(改用微型实验装置)(2020·河南中考)如图为CO还原Fe2O3的微型装置图,则A处V形管内的固体粉末由_________色逐渐变黑; B处V形管内的溶液变浑浊,化学方程式为 _____________________________; 将尾气点燃,化学方程式为__________________。
Ca(OH)2+CO2====CaCO3↓+H2O
2CO+O2 2CO2
【变式题2】(改变尾气处理装置)(2020·株洲中考)下图为一氧化碳还原氧化铁示意图。 (1)写出试管b中涉及的主要反应的化学方程式______________________________。 (2)c处操作的目的为_______________________________________。
CO2+Ca(OH)2 ====CaCO3↓+H2O
尾气处理,防止未反应的CO进入空气中
【答题指南】上述题目虽然装置不同,但原理与解题方法相同,解题时需要明确以下几点1.反应原理都是利用CO的还原性还原Fe2O3。2.实验步骤一氧化碳还原氧化铁实验步骤需注意:“一通二点三灭四停五处理”。“一通”先通一氧化碳;“二点”后点燃酒精喷灯加热;“三灭”实验完毕后,先熄灭酒精喷灯;“四停”等到玻璃管冷却至室温时再停止通一氧化碳;“五处理”处理尾气,防止CO污染环境。
3.现象描述包括反应现象(颜色变化)、CO2产物验证等主要两类。4.尾气处理CO有毒,会污染空气。尾气处理的目的为避免环境污染,处理方法多样,通常采用燃烧法、收集法及尾气再利用等。5.安全由于CO与空气混合遇热(点燃)可能会造成爆炸,在使用前必须对CO进行验纯。
实验二 铁生锈条件的探究1.实验原理:铁与空气中的___________、_________发生化学反应。
2.实验探究(控制变量法)
3.实验注意事项:(1)实验用的铁钉必须洁净无锈;(2)实验中的蒸馏水必须要煮沸,其目的是赶出溶解在水中的氧气,保证铁钉只与水接触;(3)实验3可通过用酒精烘烤的方法赶出试管中的水蒸气,再加入干燥剂氯化钙密封;(4)环境的湿度及酸碱度等因素也影响铁的锈蚀,如酸或氯化钠的存在会加速铁的锈蚀。
【典例研析】【原型题】(2020·苏州中考节选)钢铁的腐蚀是重要研究课题。世纪金榜导学号【知识回顾】用如图所示实验进行铁钉腐蚀的研究。一段时间后试管A、B中铁钉几乎没有生锈,而试管C中铁钉明显锈蚀,试管D、E中铁钉严重锈蚀。
(1)由A、B、C的现象可知,铁的锈蚀是铁跟___________(填化学式)等物质作用的过程。 (2)试管B中使用“煮沸并迅速冷却的蒸馏水”,其目的是______________________________________________。
解的氧气且防止氧气再溶于水
【变式题1】(探究影响钢铁生锈的因素)(2019·重庆中考B)为了探究铁制品锈蚀的条件,小明用普通铁钉、纯铁钉同时进行下面的四组实验,一段时间后只在实验Ⅰ中观察到了红褐色的锈斑,其他均无明显变化。下列说法错误的是( )
A.Ⅰ和Ⅱ说明铁制品锈蚀需要O2B.Ⅰ和Ⅲ说明铁制品锈蚀需要H2OC.Ⅰ和Ⅳ说明H2O和O2同时存在,铁制品不一定发生锈蚀D.Ⅲ和Ⅳ说明铁制品的锈蚀与铁制品内部结构有关
【变式题2】(改变实验装置) (2020·安徽中考)金属防腐是科学研究中的重大课题。某校学习小组以铁的腐蚀为项目进行如下研究。【认识铁的腐蚀】(1)下列环境中的铁制品最容易生锈的是______(填字母序号)。 A.未擦干的铁锅B.涂油漆的栏杆C.盛水的不锈钢水杯(2)铁锈的主要成分是Fe2O3·xH2O,其中铁元素的化合价是_________。
【探究铁的腐蚀】(3)该小组用下图甲装置进行实验,起始时量筒内水面处于50 mL刻度处,之后水面缓慢上升。几天后水面最终处于约_______(填“40”或“10”)mL刻度处,原因是_______________________________________________。
铁锈蚀消耗氧气,且氧气约占空气总体积的
【拓展探究】(4)小强同学进行如下实验:取铁钉用砂纸打磨,称其质量,按上图乙安装装置,放置3天,再取出铁钉称量。在不同温度下重复上述实验,得到铁钉质量增加情况如下表。
小强同学的实验是探究_________因素对铁钉腐蚀快慢的影响,结论是___________________________________________________________。 (5)有同学认为小强的实验未能真实反映50 ℃以后铁钉腐蚀的快慢,理由是50 ℃以后铁钉质量没有变化。请分析铁钉质量没有变化的原因:______________________________________________; 改进实验方案证明你的分析:________________________________________________________________________________________________。
在10~50 ℃的范围内,温度越高,铁钉腐蚀的速度越快
氧气已耗尽,剩余的铁不能继续锈蚀
向乙装置的试管中充入氧气,并在50 ℃的环
境中放置3天;若铁钉增加的质量大于0.18 g,则分析成立
相关课件
这是一份中考化学一轮复习基础知识过关课件 第八单元金属和金属材料(含答案),共41页。PPT课件主要包含了考点梳理,自主测试,归类示例一,归类示例二,归类示例三,归类示例四,归类示例五,归类示例六,答案166等内容,欢迎下载使用。
这是一份中考化学一轮单元总复习课件 第八单元 金属和金属材料 (含答案),共60页。PPT课件主要包含了核心知识·建构脉络图,主干回顾·厚积知识力,紫红色,含碳量,金属氧化物,星四射,生成黑色固体,盐+氢气,浅绿色,新盐+新金属等内容,欢迎下载使用。
这是一份初中化学人教版九年级下册课题 1 金属材料获奖复习课件ppt,共26页。PPT课件主要包含了纯金属,物理性质,化学性质,金属活动性顺序,硬度更高,抗腐蚀性能更强,熔点更低,金属资源的利用和保护,铁的冶炼,金属材料等内容,欢迎下载使用。









