
2022-2023学年广东省深圳市高一(下)期末化学试卷(含解析)
展开
这是一份2022-2023学年广东省深圳市高一(下)期末化学试卷(含解析),共22页。试卷主要包含了单选题,流程题,实验题,简答题等内容,欢迎下载使用。
2022-2023学年广东省深圳市高一(下)期末化学试卷
一、单选题(本大题共16小题,共48分)
1. 随着时代的发展,盛装食物的餐盒发生了系列演变。下列餐盒的主要材料属于硅酸盐的是( )
A. 青铜四龙纹餐盒 B. 彩陶餐盒
C. 紫竹餐盒 D. 塑料餐盒
2. 从海洋中获取物质与能量具有广阔的前景。下列说法正确的是( )
A. 利用蒸馏法进行海水淡化主要发生化学变化
B. 海底石油经分馏得到的汽油属于纯净物
C. 海水中存在的 12H、 13H互为同素异形体
D. 潮汐能属于新能源
3. HClO在一定条件下能将H2O2、C2H4、HCl等物质氧化。下列化学用语表述正确的是( )
A. HClO的结构式:H−O−Cl B. H2O2的电子式:
C. C2H4的空间填充模型: D. Cl−的离子结构示意图:
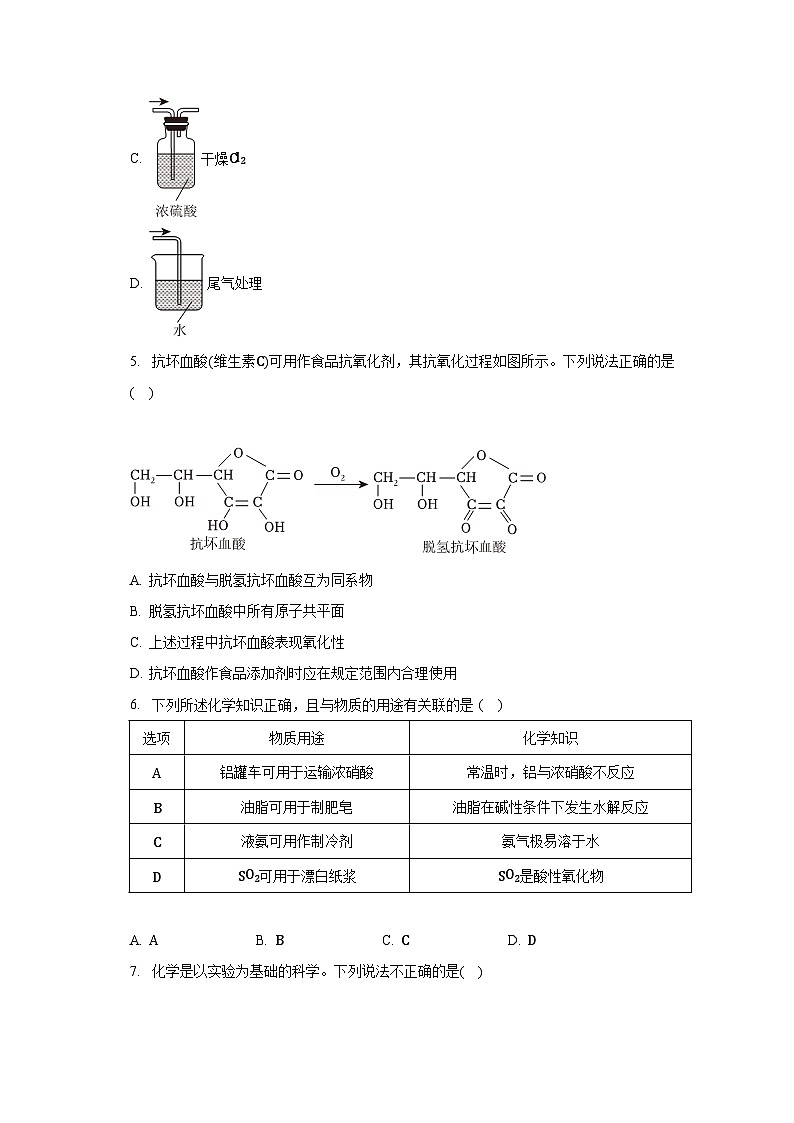
4. 下列有关氯气制备、净化及尾气处理的实验过程中(“→”表示气流方向),所需装置和试剂均正确的是( )
A. 制备Cl2
B. 除去Cl2中HCl气体
C. 干燥Cl2
D. 尾气处理
5. 抗坏血酸(维生素C)可用作食品抗氧化剂,其抗氧化过程如图所示。下列说法正确的是 ( )
A. 抗坏血酸与脱氢抗坏血酸互为同系物
B. 脱氢抗坏血酸中所有原子共平面
C. 上述过程中抗坏血酸表现氧化性
D. 抗坏血酸作食品添加剂时应在规定范围内合理使用
6. 下列所述化学知识正确,且与物质的用途有关联的是 ( )
选项
物质用途
化学知识
A
铝罐车可用于运输浓硝酸
常温时,铝与浓硝酸不反应
B
油脂可用于制肥皂
油脂在碱性条件下发生水解反应
C
液氨可用作制冷剂
氨气极易溶于水
D
SO2可用于漂白纸浆
SO2是酸性氧化物
A. A B. B C. C D. D
7. 化学是以实验为基础的科学。下列说法不正确的是( )
A. 相同条件下,钠与水的反应比钠与乙醇的反应更剧烈
B. 可用焰色试验鉴别NaCl和KCl
C. 向FeCl3溶液中滴加几滴KSCN溶液,产生红色沉淀
D. 可用新制的氢氧化铜或银氨溶液检验淀粉水解产物
8. 下列实践活动与所述的化学知识没有关联的是 ( )
选项
实践活动
化学知识
A
用NH4NO3对农作物施肥
NH4NO3属于氮肥
B
用白醋清除水垢(主要成分是CaCO3)
乙酸可与CaCO3发生反应
C
用75%的乙醇溶液消毒
蛋白质在乙醇作用下会发生变性
D
蒸馒头时加入小苏打
NaHCO3是白色晶体
A. A B. B C. C D. D
9. 将Na2O2投入足量水中发生反应。设NA为阿伏加德罗常数的值,下列相关说法正确的是( )
A. 1molNa2O2中所含阴离子数目为NA
B. 1molO2的体积为22.4L
C. 1mol⋅L−1NaOH溶液中所含Na+的数目为NA
D. 每消耗1molNa2O2,转移的电子数为2NA
10. 硝酸是一种重要的化工原料。如图为工业制备硝酸的流程示意图。下列说法不正确的是 ( )
A. 延长反应时间可实现合成塔中原料的完全转化
B. 氧化炉中主要发生的反应为4NH3+5O2=催化剂4NO+6H2O
C. 吸收塔中通入空气是为了氧化NO
D. 尾气处理可有效防止酸雨的形成
11. 下列实验操作或方案能达到相应应验目的的是 ( )
选项
实验操作或方案
实验目的
A
向溶液中滴加适量浓NaOH溶液并微热,用湿润的蓝色石蕊试纸检验产生的气体
检验溶液中是否存在NH4+
B
向淀粉−KI溶液中滴加少量氯水
证明氧化性:Cl2>I2
C
向FeCl3溶液中加入NaOH溶液
制备Fe(OH)3胶体
D
将粗盐溶解后,依次加入足量的Na2CO3溶液、NaOH溶液和BaCl2溶液
除去粗盐中的Ca2+、Mg2+、SO42−,得到精盐
A. A B. B C. C D. D
12. W、X、Y、Z为原子序数依次增大的短周期主族元素,W最外层电子数是内层电子数的3倍,X在短周期主族元素中原子半径最大,Y的最高正价与最低负价代数和为4。下列说法正确的是( )
A. 简单离子半径:WS,则简单氢化物的稳定性:H2O>H2S,故B错误;
C.常温下硫单质为固态,Cl2为气态,则单质沸点:S>Cl2,故C错误;
D.Y、Z的单质分别为硫、氯气,X的单质为活泼金属钠,则硫、氯气分别与金属钠反应生成离子化合物硫化钠、氯化钠,故D正确;
故选:D。
W、X、Y、Z为原子序数依次增大的短周期主族元素,W最外层电子数是内层电子数的3倍,W只能含有2个电子层,最外层含有6个电子,则W为O元素;X在短周期主族元素中原子半径最大,则X为Na元素;Y的最高正价与最低负价代数和为4,Y位于ⅥA族,其原子序数大于Na元素,则Y为S元素;Z的原子序数大于S元素,则Z为Cl元素,
A.氧离子和钠离子具有相同的核外电子层结构结构,核电荷数越大离子半径越小;
B.非金属性越强,简单氢化物的稳定性越强;
C.常温下硫单质为固态,Cl2为气态,固态单质的沸点大于气态;
D.硫、氯气分别与活泼金属钠反应生的硫化钠、氯化钠均为离子化合物。
本题考查原子结构与元素周期律,为高频考点,结合原子序数、原子结构来推断元素为解答关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大。
13.【答案】C
【解析】解:A.由图可知,HBr在反应①参与反应,在反应②中生成,可循环使用,故A正确;
B.由图可知,反应②中,CH4和Br2生成CH3Br和HBr,化学方程式为:CH4+Br2→催化剂CH3Br+HBr,故B正确;
C.由图可知,反应①中O2转化为H2O,O元素化合价发生变化,故C错误;
D.由图可知,O2存在非极性键,HBr中存在极性键,反应①中有极性键和非极性键的断裂,故D正确;
故选:C。
A.由图可知,HBr在反应①参与反应,在反应②中生成;
B.由图可知,反应②中,CH4和Br2生成CH3Br和HBr;
C.由图可知,反应①中O2转化为H2O;
D.由图可知,O2存在非极性键,HBr中存在极性键。
本题考查反应过程,侧重考查学生反应机理和分子结构的掌握情况,试题难度不大。
14.【答案】A
【解析】解:A.用强碱溶解铝表面氧化膜的离子方程式为:Al2O3+2OH−=2AlO2−+H2O,故A正确;
B.将Cl2通入冷的石灰乳中的离子方程式为:Cl2+Ca(OH)2=Ca2++ClO−+Cl−+H2O,故B错误;
C.向Ba(OH)2溶液中加入稀硫酸的离子方程式为:Ba2++2OH−+2H++SO42−=BaSO4↓+2H2O,故C错误;
D.向稀硝酸中加入足量铁粉的离子方程式为:3Fe+2NO3−+8H+=3Fe2++2NO↑+4H2O,故D错误;
故选:A。
A.氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水;
B.石灰乳中的氢氧化钙不能拆开;
C.氢离子、氢氧根离子的系数不满足硫酸、氢氧化钡的化学式组成;
D.铁粉足量,铁与稀硝酸反应生成亚铁离子。
本题考查离子方程式的书写判断,为高频考点,明确物质性质、反应实质为解答关键,注意掌握离子方程式的书写原则,试题侧重考查学生的分析能力及规范答题能力,题目难度不大。
15.【答案】B
【解析】解:A.由图示可知,t3∼t4时间段内v(MnO4−)大于t1~t2时间段,则t1~t2时间段消耗的n(KMnO4)比t3~t4时间段消耗的少,故A 正确;
B.t2与t3时刻的v(MnO4−)相等,随着时间的推移,反应不断消耗高锰酸钾,则t3时刻剩余的c(KMnO4)要小,故B错误;
C.随着反应不断消耗高锰酸钾,反应速率应该是逐渐减慢的,但图示表示t4时刻之前,反应速率逐渐加快,则反应速率逐渐增大的原因可能是生成的Mn2+起催化作用,故C正确;
D.H+是反应物,随着反应进行,溶液中c(H+)逐渐减小,故D正确,
故选:B。
A.t3∼t4时间段内v(MnO4−)大于t1~t2时间段,则t1~t2时间段消耗的n(KMnO4)比t3~t4时间段消耗的少;
B.随着时间的推移,反应不断消耗高锰酸钾;
C.随着反应不断消耗高锰酸钾,反应速率应该是逐渐减慢的,但图示表示t4时刻之前,反应速率逐渐加快,则反应速率逐渐增大的原因可能是生成的Mn2+起催化作用;
D.H+是反应物,随着反应进行,溶液中c(H+)逐渐减小。
本题主要考查了化学反应速率,侧重分析与实验、识图能力的考查,题目难度不大,分析题给图像,结合所学知识是解答的关键。
16.【答案】C
【解析】解:A.由电池工作时的总反应可知,KSn合金发生失电子的反应生成K+、为负极,复合碳电极为正极,故A错误;
B.该原电池工作时,KSn合金为负极,复合碳电极为正极,阳离子移向正极,即K+向复合碳电极迁移,故B错误;
C.复合碳电极为正极,正极上CO2得电子生成K2CO3和C,正极反应式为4K++3CO2+4e−=2K2CO3+C,故C正确;
D.金属K是活泼金属,能与水反应,则不能用KOH溶液代替含K+有机电解质,故D错误;
故选:C。
稳定高效的K−CO2电池放电总反应4KSn+3CO2⇌2K2CO3+C+4Sn,其中K元素由0价升高+1价,则KSn合金为负极,复合碳电极为正极,负极反应为KSn−e−=Sn+K+,正极反应式为4K++3CO2+4e−=2K2CO3+C,原电池工作时阳离子移向正极,阴离子移向负极,据此分析解答。
本题考查化学电源新型电池工作原理和电解原理,为高频考点,侧重考查分析推断能力和灵活运用能力,把握电极的判断、电极反应和题给信息的应用为解答关键,难点是电极反应式的书写,题目难度中等。
17.【答案】+2 升温、搅拌 SiO2、C H2 Fe+2Fe3+=3Fe2+ Cr2O72−+6Fe2++14H+=2Cr3++6Fe3++7H2O 62.4
【解析】解:(1)在(NH4)2Fe(SO4)2⋅6H2O 中,铵根离子带1个正电荷,硫酸根离子带2个负电荷,根据化合物中各元素化合价代数和等于0可知,铁元素的化合价为+2,
故答案为:+2;
(2)“浸取”时,为提高反应速率,可采取的措施为适当升温、搅拌,
故答案为:升温、搅拌;
(3)浸取时,含铁废渣中的金属氧化物均能和稀硫酸反应,但SiO2、C不和稀硫酸反应,则“滤渣1“的主要成分为SiO2、C,
故答案为:SiO2、C;
(4)“转化1”中主要发生三个反应,其中一个反应有气体生成:Fe+H2SO4=FeSO4+H2↑,则该气体为H2;另外两个反应的离子方程式分别为:Fe+2Fe3+=3Fe2+、Fe+Cu2+=Fe2++Cu,
故答案为:H2;Fe+2Fe3+=3Fe2+;
(5)将0.1000g铬铁合金样品处理后,铬全部转化为Cr2O72−存在于溶液中,该溶液与(NH4)2Fe(SO4)2 溶液恰好完全反应,Cr2O72−中铬元素全部转化为Cr3+,同时有Fe3+生成,其反应的离子方程式为:Cr2O72−+6Fe2++14H+=2Cr3++6Fe3++7H2O,由化合价升降总数相等可得关系式:Cr2O72−~6Fe2+,则铬铁合金中铬元素含量为:18×10−3L×0.2000mol⋅L−1×16×2×52g⋅mol−10.1000g×100%=62.4%,
故答案为:62.4%。
原料中加入过量稀硫酸浸取时铁、铜和铝的氧化物均与硫酸反应生成对应的硫酸盐和水,SiO2、C和硫酸不反应是滤渣1的主要成分,转化1中发生的反应有铁与过量硫酸的反应生成硫酸亚铁和氢气,铁与三价铁离子的反应生成亚铁离子,铁与铜离子反应生成铜和亚铁离子,调pH值的过程中铝离子转化为沉淀,同时滤渣2中还有生成的铜和过量的铁,转化2中加入硫酸铵溶液最终得到目标产物,以此解题。
本题主要考查了物质的分离和提纯有关知识,是高频考点,解题时要看框内外,边分析,边思考,理解制备流程是解题关键,侧重考查分析能力,题目难度一般。
18.【答案】100mL容量瓶 偏低 Cu+2H2SO4(浓)=△CuSO4+SO2↑+2H2O 酸性高锰酸钾溶液褪色 还原 假设3 Ag2S 8Ag++4SO2+4H2O=Ag2S↓+3Ag2SO4↓+8H+
【解析】解:(1)配制100mL0.10mol/LAgNO3溶液所需玻璃仪器有:烧杯、量筒、胶头滴管、玻璃棒、100mL容量瓶,
故答案为:100mL容量瓶;
(2)转移溶液时,未洗涤烧杯和玻璃棒,溶质物质的量偏小,溶液体积不变,则将导致所配溶液浓度偏低,
故答案为:偏低;
(3)装置A的圆底烧瓶中铜和浓硫酸加热反应生成硫酸铜、二氧化硫和水,其发生反应的化学方程式为:Cu+2H2SO4(浓)=△CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)=△CuSO4+SO2↑+2H2O;
(4)装置B中可观察到的现象为酸性高锰酸钾溶液褪色,主要是二氧化硫与酸性高锰酸钾溶液反应生成硫酸根和锰离子,则说明SO2具有还原性,
故答案为:酸性高锰酸钾溶液褪色;还原;
(5)①步骤ⅱ中加入足量稀盐酸后,观察到白色固体部分溶解,说明白色固体是硫酸钡和亚硫酸钡的混合物,由此得到白色沉淀为Ag2SO3和Ag2SO4的混合物,则说明假设3成立,
故答案为:假设3;
②根据题中信息生成该物质的原因是SO2具有较强的还原性,二氧化硫与AgNO3溶液发生氧化还原反应得到,该反应的离子方程式为:8Ag++4SO2+4H2O=Ag2S↓+3Ag2SO4↓+8H+,则推测灰黑色固体为Ag2S,
故答案为:Ag2S;8Ag++4SO2+4H2O=Ag2S↓+3Ag2SO4↓+8H+。
铜和浓硫酸在加热条件下反应生成硫酸铜、二氧化硫和水,二氧化硫通入到酸性高锰酸钾溶液中,溶液褪色,体现二氧化硫的还原性,二氧化硫通入到硝酸银溶液中得到亚硫酸银、硫酸银沉淀。
本题主要考查了性质实验方案的设计,属于高频考点,需要边思考、边分析,正确理解每个装置的作用是解题关键,侧重考查分析能力,题目难度一般。
19.【答案】0.025 等于 60% CD AC 吸收 304
【解析】解:(1)0~2min内v(H2O)=△c△t=0.2mol/L−0.1mol/L2min=0.05mol/(L⋅min),反应为CH4(g)+2H2O(g)⇌CO2(g)+4H2(g),则v(CH4)=12v(H2O)=0.025mol/(L⋅min),
故答案为:0.025;
(2)0~3min内Δc(H2O):Δc(CH4)=2:1,即Δc(H2O):0.06mol/L=2:1,Δc(H2O)=0.12mol/L,3min时c(H2O)=0.20mol/L−0.12mol/L=0.08mol/L,和4min时c(H2O)相等,说明3min时反应达到平衡状态,消耗H2O的速率等于生成H2O的速率,
故答案为:等于;
(3)起始时c(CH4):c(H2O)=1:2,与化学反应的反应物计量数之比相等,则CH4的转化率和H2O的转化率相等,即4min时,CH4转化率为0.20−0.080.20×60%=60%,
故答案为:60%;
(4)A.恒温恒容条件下充入少量氩气,反应物、生成物的浓度均不变,则反应速率不变,故A错误;
B.降低温度,活化分子数减少,反应速率降低,故B错误;
C.将容器容积减小一半,反应物、生成物的浓度均增大,则反应速率增大,故C正确;
D.再充入1molH2O(g),反应物水的浓度增大,反应速率增大,故D正确;
故答案为:CD;
(5)A.反应是气体分子数增大的反应,气体的质量不变,由M=mn可知容器内气体的平均摩尔质量保持不变的状态是平衡状态,故A正确;
B.2v正(H2O)=v逆(H2)的状态是平衡状态,即消耗H2的速率是消耗H2O速率的2倍的状态是平衡状态,所以消耗H2O的速率是消耗H2速率的2倍的状态不是平衡状态,故B错误;
C.反应是气体分子数增大的反应,恒温恒容条件下容器内的压强保持不变的状态是平衡状态,故C正确;
D.反应体系中各物质均为气体,即气体的总质量不变,恒容条件下容器内气体的密度始终不变,所以容器内气体的密度保持不变的状态不一定是平衡状态,故D错误;
故答案为:AC;
(6)反应CH4(g)+2H2O(g)⇌CO2(g)+4H2(g)的ΔH=反应物总键能−生成物总键能=4×413kJ/mol+4×498kJ/mol−2×800kJ/mol−4×435kJ/mol=+304kJ/mol,热化学方程式为CH4(g)+2H2O(g)⇌CO2(g)+4H2(g)ΔH=+304kJ/mol,所以生成1molCO2(g)时吸收热量304kJ,
故答案为:吸收;304。
(1)根据v=△c△t计算0~2min内v(H2O),结合化学方程式的计量数关系计算v(CH4);
(2)0~3min内Δc(H2O):Δc(CH4)=2:1,即Δc(H2O):0.06mol/L=2:1,Δc(H2O)=0.12mol/L,3min时c(H2O)=0.20mol/L−0.12mol/L=0.08mol/L,和4min时c(H2O)相等;
(3)起始时c(CH4):c(H2O)=1:2,与化学反应的反应物计量数之比相等,则CH4的转化率和H2O的转化率相等;
(4)一般来说,升高温度、增大压强、浓度或加入催化剂等,可增大反应速率;
(5)反应达到平衡状态时,正逆反应速率相等,各物质的浓度、含量不变,以及由此衍生的一些量也不发生变化;
(6)反应CH4(g)+2H2O(g)⇌CO2(g)+4H2(g)的ΔH=反应物总键能−生成物总键能=4×413kJ/mol+4×498kJ/mol−2×800kJ/mol−4×435kJ/mol=+304kJ/mol,热化学方程式为CH4(g)+2H2O(g)⇌CO2(g)+4H2(g)ΔH=+304kJ/mol。
本题考查化学反应速率及其影响因素、化学平衡的计算、反应热计算,考查了学生的分析判断能力及化学计算能力,把握反应热与键能的计算关系、化学反应速率的计算及影响因素和化学平衡状态的判断是解题关键,注意掌握反应速率与化学计量数关系的应用,难度难度中等。
20.【答案】乙烯 碳碳双键、醛基 CD CH3CH(CH3)CH2OH++H2O 酯化反应或取代反应 8 (CH3)2CHCH2CH2OH
【解析】解:(1)A为CH2=CH2,化合物A的名称为乙烯,
故答案为:乙烯;
(2)化合物C中官能团的名称为碳碳双键、醛基,
故答案为:碳碳双键、醛基;
(3)A.肉桂醛中除了C、H元素外还含有O元素,所以不属于不饱和烃,属于烃的含氧衍生物,故A错误;
B.肉桂醛的分子式为C9H8O,故B错误;
C.肉桂醛能和溴水发生氧化反应、加成反应,所以能使溴水褪色,故C正确;
D.肉桂醛中含有碳碳双键,所以能发生加聚反应,故D正确;
故答案为:CD;
(4)反应③的化学方程式为CH3CH(CH3)CH2OH++H2O;该反应的反应类型为酯化反应或取代反应,
故答案为:CH3CH(CH3)CH2OH++H2O;酯化反应或取代反应;
(5)化合物X为化合物D的同系物,且相对分子质量比D大14,说明X比D多一个CH2,X的结构相当于戊烷中的1个氢原子被−OH取代,戊烷中含有几种氢原子,该醇就有几种结构,戊烷有正戊烷、异戊烷、新戊烷,正戊烷有3种氢原子、异戊烷有4种氢原子、新戊烷有1种氢原子,所以该醇的种类为3+4+1=8;其中,仅含有两个甲基且连在同一个碳原子上的结构简式为(CH3)2CHCH2CH2OH,
故答案为:8;(CH3)2CHCH2CH2OH。
反应①是原子利用率100%的反应,且1molA与1molH2、1molCO反应得到1molB,根据原子守恒知,A的分子式为C2H4,为CH2=CH2;B和HCHO先发生加成反应然后发生消去反应生成C,C和氢气发生加成反应或还原反应生成D,肉桂醛发生催化氧化生成E,F属于酯类物质,则D和E发生酯化反应生成F为。
本题考查有机物的合成,侧重考查分析、判断及知识综合运用能力,正确推断各物质的结构简式是解本题关键,注意(5)题同分异构体种类的判断方法,题目难度中等。
相关试卷
这是一份2022-2023学年上海中学高一(下)期末化学试卷(含解析),共24页。试卷主要包含了简答题等内容,欢迎下载使用。
这是一份2022-2023学年辽宁省大连高一(下)期末化学试卷(含解析),共22页。试卷主要包含了单选题,流程题,实验题,简答题等内容,欢迎下载使用。
这是一份2022-2023学年江西省南昌市高一(下)期末化学试卷(含解析),共21页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。