

2022-2023学年重庆市缙云教育联盟高二(下)期末化学试卷(含解析)
展开
这是一份2022-2023学年重庆市缙云教育联盟高二(下)期末化学试卷(含解析),共21页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
2022-2023学年重庆市缙云教育联盟高二(下)期末化学试卷
一、选择题(本大题共14小题,共42分)
1. 下列实验,能得到溶液的是( )
A. B. C. D.
2. 下列关于糖的说法错误的是( )
A. 淀粉是一种天然高分子化合物 B. 糖都能水解
C. 纤维素没有甜味 D. 糖类是人体内能量的主要来源之一
3. 在一定温度下A(g)+3B(g)⇌2C(g)达平衡的标志是( )
A. 物质A、B、C的分子个数比为1:3:2
B. 单位时间内生成A、C的物质的量之比为1:2
C. 单位时间内生成A、B的物质的量之比为1:3
D. 反应速率v(A)=v(B)3=v(C)2
4. X、Y、Z、W为周期表中前20号元素,原子序数依次増大,W、Y为金属元素,X原子的最外层电子数是次外层电子数的3倍,Y、Z位于同周期,Z单质是一种良好的半导体。W单质能与冷水剧烈反应,Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等。下列说法正确的是( )
A. 原子半径:W>Y>Z>X
B. X与Z形成的化合物可导电
C. Y、Z、W的最高价氧化物的水化物中,碱性最强的为Y
D. W可从Y的盐溶液中置换出Y
5. 下列各组中的两种物质在溶液中的反应,可用同一离子方程式表示的是( )
A. Cu(OH)2+HCl;Cu(OH)2+CH3COOH
B. NaHCO3+H2SO4;Na2CO3+HCl
C. NaHSO4+NaOH;H2SO4+NaOH
D. BaCl2+H2SO4;Ba(OH)2+H2SO4
6. 下列关于钠的叙述正确的是( )
A. 钠在自然界中存在游离态 B. 钠是一种灰色的固体
C. 钠可以保存在煤油中 D. 钠着火时可以用水扑灭
7. 下列图示与对应的叙述相符的是( )
A. 图甲表示氢氧化钠溶液与盐酸反应时的能量变化
B. 图乙表示电解精炼铜时,阳极减少的质量Δm随转移电子物质的量的变化
C. 图丙表示合成氨反应其他条件一定,在有、无催化剂条件下n(NH3)随时间的变化
D. 图丁表示反应2SO2(g)+O2(g)⇌2SO3(g)其他条件一定,改变起始时O2的物质的量,平衡时SO3的体积分数随起始时O2的物质的量的变化
8. 下列实验过程中,始终无明显现象的是( )
A. NO2通入FeSO4溶液中 B. CO2通入CaCl2溶液中
C. NH3通入AlCl3溶液中 D. SO2通入已酸化的Ba(NO3)2溶液中
9. 下列说法中正确的是( )
A. 化学反应中的能量变化都表现为热量的变化
B. 增加炼铁高炉的高度可以降低尾气中CO的含量
C. 无论加入正催化剂还是加入负催化剂都能大大提高化学反应速率
D. 把煤粉碎了再燃烧可以提高煤的燃烧效率
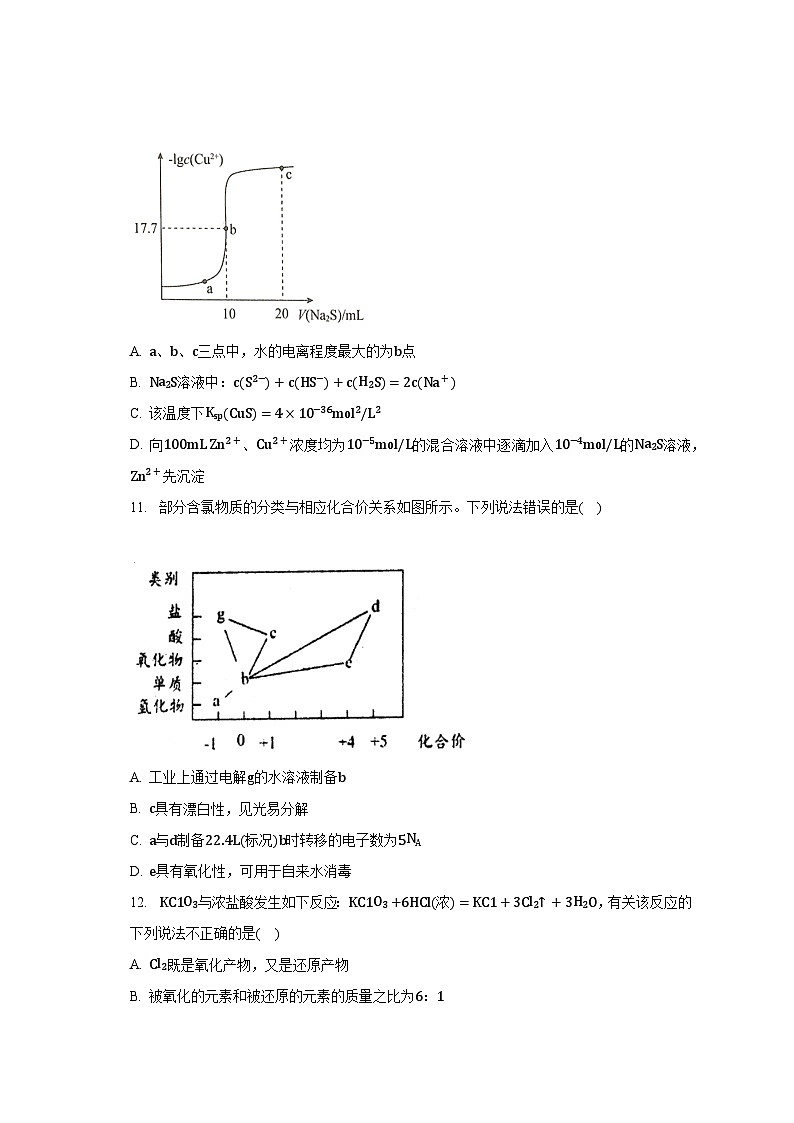
10. 某温度下,向10mL 0.1mol/L CuCl2溶液中滴加0.1mol/L的Na2S溶液,滴加过程中溶液中−lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,下列有关说法正确的是已知:lg2=0.3,Ksp(ZnS)=3×10−25mol2/L2。( )
A. a、b、c三点中,水的电离程度最大的为b点
B. Na2S溶液中:c(S2−)+c(HS−)+c(H2S)=2c(Na+)
C. 该温度下Ksp(CuS)=4×10−36mol2/L2
D. 向100mL Zn2+、Cu2+浓度均为10−5mol/L的混合溶液中逐滴加入10−4mol/L的Na2S溶液,Zn2+先沉淀
11. 部分含氯物质的分类与相应化合价关系如图所示。下列说法错误的是( )
A. 工业上通过电解g的水溶液制备b
B. c具有漂白性,见光易分解
C. a与d制备22.4L(标况)b时转移的电子数为5NA
D. e具有氧化性,可用于自来水消毒
12. KC1O3与浓盐酸发生如下反应:KC1O3+6HCl(浓)=KC1+3Cl2↑+3H2O,有关该反应的下列说法不正确的是( )
A. Cl2既是氧化产物,又是还原产物
B. 被氧化的元素和被还原的元素的质量之比为6:1
C. 盐酸既体现酸性,又体现还原性
D. 转移5mol电子时,产生3molCl2
13. 下列实验操作、现象和实验结论均正确的是 ( )
选项
实验操作
现象
结论
A
向1mol/L100mL的KI淀粉溶液中通入足量的氯气
溶液最终未变蓝
氯气的水溶液具有漂白性
B
向浓度均为0.01mol/L的MgCl2和CuCl2的混合溶液10mL中加入1mol/L的氨水10mL
只产生了白色沉淀
Ksp[Cu(OH)2]>Ksp[Mg(OH)2]
C
向澄清的BaCO3的饱和溶液中加入等体积1mol/LNa2SO4溶液
产生了白色沉淀
BaCO3溶解度大于BaSO4
D
向盛有KI3溶液的两试管中分别加入淀粉和AgNO3溶液
前者溶液变成蓝色,后者有黄色沉淀
KI3溶液存在平衡:I3−⇌I2+I−
A. A B. B C. C D. D
14. 某溶液中可能含有下列5种离子中的几种:Na+、NH4+、Mg2+、Al3+、Cl−.为确认该溶液组成进行如下实验:①取20.0mL该溶液,加入32.5mL 4.00mol⋅L−1NaOH溶液加热,有白色沉淀产生,无刺激气味气体生成.过滤、洗涤、干燥,得沉淀2.03g.再将滤液稀释至100mL,测得滤液中c(OH−)=0.2mol⋅L−1;
②另取20.0mL该溶液,加入足量的AgNO3溶液,生成白色沉淀14.35g.关于原溶液组成结论正确的是( )
A. 一定含有Mg2+、Al3+、Cl−,不含有Na+、NH4+
B. 一定含有Na+、Mg2+、Cl−,不含有NH4+、可能含有Al3+
C. c(Mg2+)为1.75 mol⋅L−1,c(Na+)为1.50 mol⋅L−1,
D. c(Cl−)为5.00 mol⋅L−1,c(Al3+)为1.00 mol⋅L−1,
二、非选择题(共58分)
15. 草酸与高锰酸钾在酸性条件下能够发生反应:
MnO4−+H2C2O4+H+→Mn2++CO2↑+H2O(未配平)
通过下表实验探究外界因素对反应速率的影响。
实验序号
实验温度/K
有关物质
溶液颜色褪至无色所需时间/s
酸性KMnO4溶液
H2C2O4溶液
H2O
V/mL
c/mol⋅L−1
V/mL
c/mol⋅L−1
V/mL
A
293
4
0.02
4
0.1
0
t1
B
T1
4
0.02
3
0.1
V1
8
C
313
4
0.02
V2
0.1
1
t2
(1)该反应中氧化剂和还原剂的物质的量之比为 ______。
(2)其中T1=______;V2=______。
(3)若t1v(逆),3min后v(正)Al>Si>O,故A正确;
B.X与Z形成的化合物为SiO2,不能导电,故B错误;
C.Y、Z、W的最高价氧化物的水化物中,碱性最强的为K,故C错误;
D.K不能从溶液中置换出Al,故D错误;
故选A。
5.【答案】C
【解析】解:A.Cu(OH)2+HCl的离子方程式为:Cu(OH)2+2H+=Cu2++2H2O,Cu(OH)2+CH3COOH的离子方程式为:Cu(OH)2+2CH3COOH=Cu2++2H2O+2CH3COO−,两个反应的离子方程式不同,不能用同一个离子方程式表示,故A错误;
B.NaHCO3+H2SO4的离子方程式为:HCO3−+H+=H2O+CO2↑,而Na2CO3+HCl的离子方程式为CO32−+2H+=CO2↑+H2O或CO32−+H+=HCO3−,两个反应的离子方程式不同,不能用同一个离子方程式表示,故B错误;
C.NaHSO4+NaOH;H2SO4+NaOH,两个反应的离子方程式均为:OH−+H+=H2O,能用同一个离子方程式表示,故C正确;
D.BaCl2+H2SO4的离子方程式为:SO42−+Ba2+=BaSO4↓,而Ba(OH)2+H2SO4的离子方程式为:2H++SO42−+Ba2++2OH−=BaSO4↓+2H2O,两个反应的离子方程式不同,不能用同一个离子方程式表示,故D错误;
故选:C。
A.氯化氢为强电解质,需要拆开,而醋酸为弱酸,不能拆开;
B.碳酸氢根离子不能拆开;
C.二者的反应实质都是氢离子与氢氧根离子生成水;
D.氢氧化钡与硫酸反应除了生成硫酸钡沉淀,还有水生成。
本题考查离子方程式的书写判断,为高频考点,把握物质性质、反应实质为解答关键,注意掌握离子方程式的书写原则,试题侧重考查学生的分析与应用能力,题目难度不大。
6.【答案】C
【解析】解:A.钠的性质活泼,易与空气中的水、氧气反应,在自然界中以化合态存在,自然界中不存在游离态,故A错误;
B.钠是银白色的金属,故B错误;
C.钠与煤油不反应,且密度比煤油大,可保存在煤油中,沉在底部,煤油隔绝了空气,故C正确;
D.钠与水剧烈反应,生成氢气,钠着火时不能用水扑灭,可以用沙子隔绝空气盖灭,故D错误;
故选:C。
A.钠的性质活泼,易与空气中的水、氧气反应;
B.钠是银白色的金属单质;
C.钠与煤油不反应,且密度比煤油大;
D.钠与水剧烈反应,生成氢氧化钠和氢气。
本题考查了元素化合物知识,熟悉钠的物理性质和化学性质是解题关键,题目难度不大。
7.【答案】D
【解析】解:A.氢氧化钠溶液与盐酸的反应是放热反应,即反应物具有的能量高于生成物具有的能量,与图甲不符合,故A错误;
B.电解精炼铜时,阳极失电子的物质除铜外,其它部分杂质如Zn、Fe、Ni等也发生氧化反应,当阳极质量减少6.4 g时,电路中转移的电子数不一定为0.2mol,与图乙不符合,故B错误;
C.催化剂能加快化学反应速率,但不能改变化学平衡的始态和终态,所以合成氨反应在其他条件一定,有、无催化剂时平衡状态下的n(NH3)相等,与图丙不符合,故C错误;
D.其他条件一定,增大起始时O2的物质的量,反应速率增大,平衡时SO3的体积分数逐渐增大,当n(SO2):n(O2)=2:1时SO3的平衡体积分数最大,而后随着O2的物质的量增大,平衡正向移动,但O2的增大量远大于SO3的增大量,所以平衡时SO3的体积分数反而减小,与图丁符合,故D正确;
故选:D。
A.氢氧化钠溶液与盐酸的反应是放热反应;
B.电解精炼铜时,阳极失电子的物质除铜外,其它部分杂质也发生氧化反应;
C.催化剂能加快化学反应速率,但不能改变化学平衡的始态和终态;
D.增大起始时O2的物质的量,SO3的体积分数和反应速率均增大,n(SO2):n(O2)=2:1时SO3的平衡体积分数最大。
本题考查较综合,涉及吸放热反应的判定、化学平衡的影响因素、精炼铜原理等知识,明确化学反应原理及影响因素是解本题关键,题目难度中等。
8.【答案】B
【解析】解:A、NO2通入后和水反应生成具有强氧化性的硝酸,将亚铁盐氧化为铁盐,溶液颜色由浅绿色变为黄色,现象明显,故A不选;
B、因CO2和CaCl2不反应,无明显现象,故B选;
C、NH3通入溶液中转化为氨水,与AlCl3反应生成氢氧化铝沉淀,现象明显,故C不选;
D、SO2通入酸化的硝酸钡中,硝酸根离子在酸性条件下具有氧化性,则亚硫酸根离子被氧化为硫酸根离子,该反应生成硫酸钡沉淀,现象明显,故D不选;
故选:B。
根据物质的性质来分析发生的化学反应,若化学反应中有气体、沉淀、颜色变化等明显现象,则不符合该题的题意.
本题考查常见的化学反应及反应的现象,熟悉常见元素化合物知识即可解答;解答此题的易错点是:不能正确理解CO2和CaCl2能否反应,由于盐酸是强酸,碳酸是弱酸,故将CO2通入CaCl2溶液中时,因碳酸钙沉淀能溶于盐酸则CO2和CaCl2不反应.
9.【答案】D
【解析】解:A.化学反应中能量的变化主要表现为热量的变化,还有光能、电能等形式的变化,故A错误;
B.高炉煤气成分中与高炉高度是没有关系的,增加炼铁高炉的高度不能减少CO的产生,故B错误;
C.正催化剂是加快反应的速率、而负催化剂是减弱反应速率,故C错误;
D.把煤粉碎了再燃烧,能增大煤与空气的接触面积,使煤充分燃烧,可以提高煤的燃烧效率,故D正确;
故选:D。
A.化学反应中能量的变化主要表现为热量的变化;
B.增加炼铁高炉的高度不能减少CO的产生;
C.正催化剂是加快反应的速率、而负催化剂是减弱反应速率;
D.把煤粉碎了再燃烧可以提高煤与氧气的接触面积。
本题考查较为综合,涉及化学反应中能量变化、环境污染与治理、化学反应速率的影响等知识,明确化学反应速率的影响因素等基础知识为解答关键,试题培养了学生的灵活应用能力,题目难度不大。
10.【答案】C
【解析】【分析】
本题考查沉淀溶解平衡知识,根据图象所提供的信息计算出CuS的Ksp数值是关键,对于同类型的沉淀可直接根据Ksp数值比较溶解性情况,不同类型的沉淀则需要定量计算比较,这是易错点,题目难度中等,注意守恒思想的运用。
向10mL 0.1mol/L CuCl2溶液中滴加0.1mol/L的Na2S溶液,发生反应:Cu2++S2−⇌CuS↓,Cu2+单独存在或S2−单独存在均会水解,水解促进水的电离,结合图象计算溶度积常数和溶液中的守恒思想,据此判断分析。
【解答】
向10mL 0.1mol/L CuCl2溶液中滴加0.1mol/L的Na2S溶液,发生反应:Cu2++S2−⇌CuS↓,Cu2+单独存在或S2−单独存在均会水解,水解促进水的电离,b点溶液时滴加Na2S溶液的体积是10mL,此时恰好生成CuS沉淀,CuS存在沉淀溶解平衡:CuS(s)⇌Cu2+(aq)+S2−(aq),已知此时−lgc(Cu2+)=17.7,则平衡时c(Cu2+)=c(S2−)=10−17.7mol/L,
A.Cu2+单独存在或S2−单独存在均会水解,水解促进水的电离,b点时恰好形成CuS沉淀,此时水的电离程度并不是a,b,c三点中最大的,故A错误;
B.Na2S溶液中,根据物料守恒,2c(S2−)+2c(HS−)+2c(H2S)=c(Na+),故B错误;
C.该温度下,平衡时c(Cu2+)=c(S2−)=10−17.7mol/L,则Ksp(CuS)=c(Cu2+)c(S2−)=10−17.7mol/L×10−17.7mol/L=10−35.4mol2/L2,由于已知lg2=0.3,则Ksp(CuS)=10−35.4mol2/L2=(100.3)2×10−36mol2/L2=4×10−36mol2/L2,故C正确;
D.向100 mL Zn2+、Cu2+浓度均为10−5mol/L的混合溶液中逐滴加入10−4mol/L的Na2S溶液,产生ZnS时需要的S2−浓度为,产生CuS时需要的S2−浓度为,则产生CuS沉淀所需S2−浓度更小,优先产生CuS沉淀,故D错误;
故选C。
11.【答案】C
【解析】【分析】
本题考查含氯物质的性质,为高频考点,把握元素的化合价、类别推断物质为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大。
【解答】
由价类二维图可知,a为HCl、b为Cl2、c为HClO、d为氯酸盐,含ClO3−、e为ClO2、g为氯化物,含Cl−,以此来解答。
A.若g为NaCl,b为Cl2,电解饱和氯化钠溶液可制备氯气,故A正确;
B.c为HClO,具有强氧化性,不稳定,则c具有漂白性,见光易分解,故B正确;
C.a与d发生6H++5Cl−+ClO3−=3Cl2↑+3H2O,生成3mol氯气转移5mol电子,制备22.4L(标况)b时转移的电子数为22.4L22.4L/mol×53×NA=53NA,故C错误;
D.e为ClO2,具有强氧化性,可用于自来水消毒,故D正确;
故选:C。
12.【答案】B
【解析】解:A.只有Cl元素的化合价变化,KClO3中Cl由+5价降低为0,HCl中Cl由−1价升高为0,Cl2 既是氧化产物,又是还原产物,故A正确;
B.失去电子被氧化,由反应可知5个Cl失去电子与1个Cl得到电子相同,则被氧化的元素和被还原的元素的质量之比 5:1,故B错误;
C.生成KCl和氯气,可知盐酸既体现酸性,又体现还原性,故C正确;
D.由反应可知转移5mol电子生成3mol气体,故D错误;
故选:B。
由KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O可知,KClO3中Cl由+5价降低为0,HCl中Cl由−1价升高为0,以此来解答。
本题考查氧化还原反应及计算,为高频考点,把握反应中元素的化合价变化、电子转移计算为解答的关键,侧重分析与应用能力的考查,注意选项B为易错点,题目难度不大。
13.【答案】D
【解析】解:A.氯气与KI反应生成碘,淀粉遇碘变蓝,则溶液先变蓝,后氯气可氧化碘单质,溶液蓝色消失,故A错误;
B.浓度相同时,Ksp[Cu(OH)2]小,应先生成蓝色沉淀,故B错误;
C.BaCO3的饱和溶液中加入等体积1mol/LNa2SO4溶液,Qc(BaSO4)>Ksp(BaSO4)时生成白色沉淀,且碳酸钡、硫酸钡均为白色沉淀,不能比较溶解度大小,故C错误;
D.前者溶液变成蓝色,可知溶液含碘单质,后者有黄色沉淀,可知溶液含碘离子,则KI3溶液存在平衡:I3−⇌I2+I−,故D正确;
故选:D。
A.氯气与KI反应生成碘,淀粉遇碘变蓝;
B.浓度相同时,Ksp小的先沉淀;
C.BaCO3的饱和溶液中加入等体积1mol/LNa2SO4溶液,Qc(BaSO4)>Ksp(BaSO4)时生成白色沉淀,且碳酸钡、硫酸钡均为白色沉淀;
D.前者溶液变成蓝色,可知溶液含碘单质,后者有黄色沉淀,可知溶液含碘离子。
本题考查化学实验方案的评价,为高频考点,把握物质的性质、反应与现象、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大。
14.【答案】A
【解析】解:①加入NaOH溶液加热,有白色沉淀产生,无刺激气味气体生成,说明原溶液中可能含有Mg2+、Al3+;一定没有NH4+;滤液中c(OH−)=0.2mol⋅L−1,证明碱过量,一定含有Mg2+;
②加入足量的AgNO3溶液,生成白色沉淀14.35g,溶液中一定含有Cl−;
氢氧化镁2.03g,物质的量是0.035mol,消耗的n(OH−)=0.07mol,加入的氢氧化钠为0.13mol,滤液中的n(OH−)=0.2mol⋅L−1×0.1L=0.02mol,故Al3+消耗了0.04mol氢氧化钠生成偏铝酸钠,n(Al3+)=0.01mol;生成白色沉淀14.35g是氯化银,物质的量是0.1mol,氢氧化镁有0.035,n(Al3+)=0.01mol,根据电荷守恒,n(Na+)=n(Cl−)−2n(Mg2+)−3n(Al3+)=0,故不含有钠离子,
A、根据以上分析可知,溶液中一定存在:Mg2+、Al3+、Cl−,一定不含有Na+和NH4+,故A正确;
B、溶液中一定不存在:Na+,故B错误;
C、c(Mg2+)=0.035mol0.02L=1.75 mol⋅L−1,不存在钠离子,故C错误;
D、c(Al3+)=0.01mol0.02L=0.50 mol⋅L−1,c(Cl−)=0.1mol0.02L=5mol/L,故D错误;
故选:A。
①加入NaOH溶液加热,有白色沉淀产生,无刺激气味气体生成,说明原溶液中可能含有Mg2+、Al3+;一定没有NH4+;滤液中c(OH−)=0.2mol⋅L−1,证明碱过量,一定含有Mg2+;
②加入足量的AgNO3溶液,生成白色沉淀14.35g,溶液中一定含有Cl−;
氢氧化镁2.03g,物质的量是0.035mol,消耗的n(OH−)=0.07mol,加入的氢氧化钠为0.13mol,滤液中的n(OH−)=0.2mol⋅L−1×0.1L=0.02mol,故Al3+消耗了0.04mol氢氧化钠生成偏铝酸钠,n(Al3+)=0.01mol;生成白色沉淀14.35g是氯化银,物质的量是0.1mol,氢氧化镁有0.035,n(Al3+)=0.01mol,根据电荷守恒,n(Na+)=n(Cl−)−2n(Mg2+)−3n(Al3+)=0,故不含有钠离子,据此选择即可.
本题考查离子反应的简单计算、常见离子的检验方法,题目难度中等,注意掌握常见离子的性质及检验方法,根据电荷守恒判断钠离子的存在为本题易错点.
15.【答案】(1)2:5
(2)293;3
(3)在其他条件不变时,浓度越大,反应速率越快;0.00125mol/(L⋅s)
(4)①若K+和SO42−是催化剂,则反应一开始就会很快 ②MnSO4
【解析】【分析】
本题考查化学反应速率,题目难度中等,掌握外界条件改变对速率的影响是解题的关键,注意探究实验保证单一变量原则。
【解答】
(1)反应MnO4−+H2C2O4+H+→Mn2++CO2↑+H2O中,锰元素价态降低得电子,高锰酸钾作氧化剂,碳元素价态升高失电子,草酸作还原剂,由电子守恒可知高锰酸钾与草酸的物质的量之比为2:5,
故答案为:2:5;
(2)实验A、B的反应物浓度不同,故温度应保持不变,T1=293,实验B、C温度不同,应保持反应物浓度相同,故V1=1,V2=3,
故答案为:293;3;
(3)实验A比B的反应物浓度大,若t1Y逆,故D错误,
故答案为:AC。
Ⅰ.达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,由此列三段式进行计算;
Ⅱ.起始时加入1molCO2和3 molH2,由图像可知:反应到10min时达到平衡,此时甲醇的物质的量为0.75mol,CO2为0.25mol。
本题考查化学平衡的计算,把握化学平衡及转化率的计算为解答的关键,注意三段式的建立。
相关试卷
这是一份2022-2023学年重庆市缙云教育联盟高二(下)期末化学试卷(含详细答案解析),共19页。试卷主要包含了单选题,流程题,实验题,简答题等内容,欢迎下载使用。
这是一份2021-2022学年重庆市缙云教育联盟高二(下)质检化学试卷(4月份)(含答案解析),共20页。试卷主要包含了 下列有关说法正确的有, 下列说法不正确的是, 下列说法正确的是等内容,欢迎下载使用。
这是一份重庆市缙云教育联盟2022-2023学年高二上学期期末联考化学答案,共4页。试卷主要包含了 D 2, B 7,A 【解析】解,B 【解析】解,B 【解析】A, B等内容,欢迎下载使用。









