
人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第一节 化学反应速率课文课件ppt
展开
这是一份人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第一节 化学反应速率课文课件ppt,共18页。
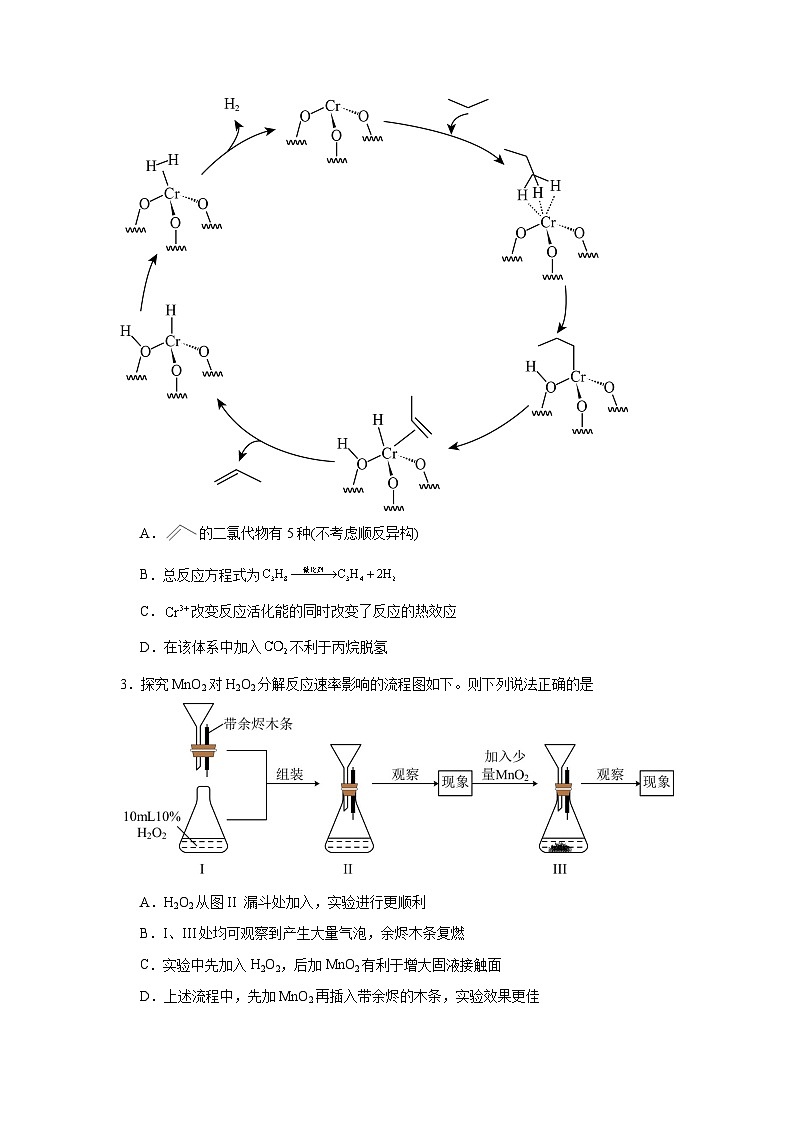
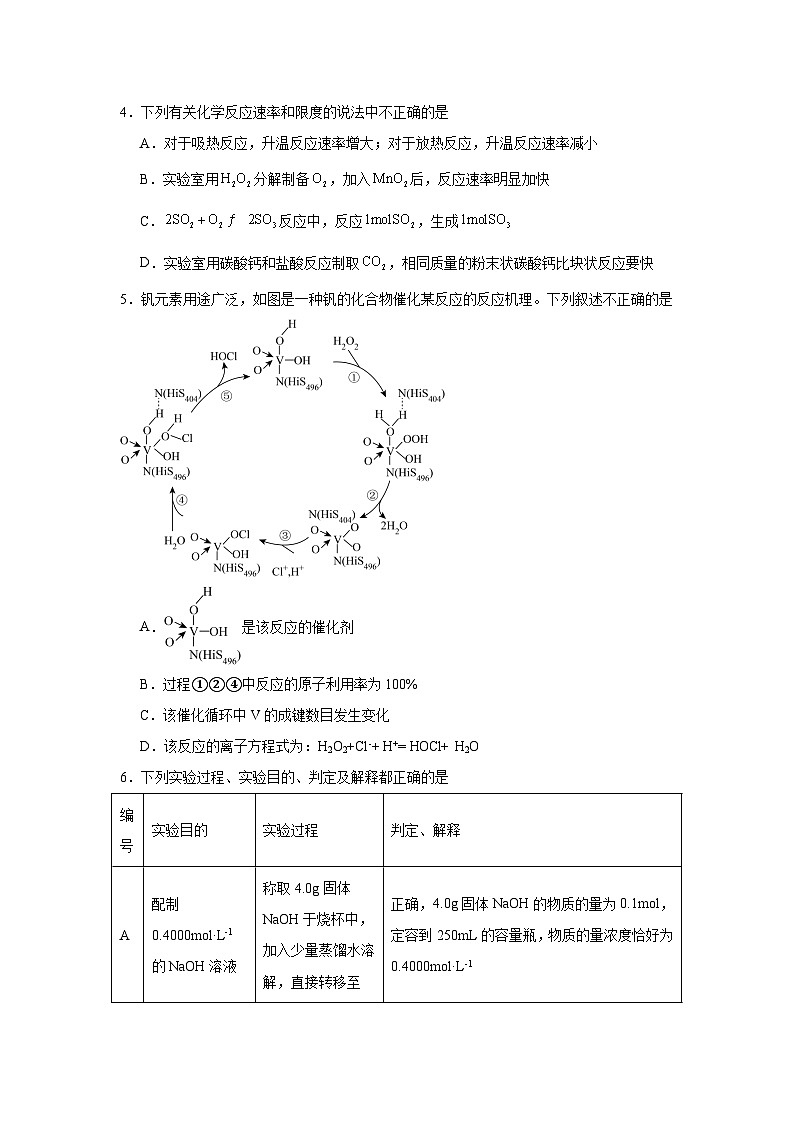
2.1.2影响化学反应速率的因素提升练-人教版高中化学选择性必修1学校:___________姓名:___________班级:___________考号:___________ 一、单选题1.如图表示某可逆反应在使用和未使用催化剂时,反应进程和能量的对应关系。下列说法一定正确的是A.a与b相比,b的活化能更高B.反应物断键吸收的总能量小于生成物成键释放的总能量C.a与b相比,a中的活化分子的百分比更高D.a与b相比,a对应的反应速率更快2.以表面隔离的催化丙烷无氧脱氢的机理如图,随着反应的进行,副反应产生的积炭会导致催化剂失活。下列说法正确的是 A.的二氯代物有5种(不考虑顺反异构)B.总反应方程式为C.改变反应活化能的同时改变了反应的热效应D.在该体系中加入不利于丙烷脱氢3.探究MnO2对H2O2分解反应速率影响的流程图如下。则下列说法正确的是A.H2O2从图II 漏斗处加入,实验进行更顺利B.I、III处均可观察到产生大量气泡,余烬木条复燃C.实验中先加入H2O2,后加MnO2有利于增大固液接触面D.上述流程中,先加MnO2再插入带余烬的木条,实验效果更佳4.下列有关化学反应速率和限度的说法中不正确的是A.对于吸热反应,升温反应速率增大;对于放热反应,升温反应速率减小B.实验室用分解制备,加入后,反应速率明显加快C.反应中,反应,生成D.实验室用碳酸钙和盐酸反应制取,相同质量的粉末状碳酸钙比块状反应要快5.钒元素用途广泛,如图是一种钒的化合物催化某反应的反应机理。下列叙述不正确的是A.是该反应的催化剂B.过程①②④中反应的原子利用率为100%C.该催化循环中V的成键数目发生变化D.该反应的离子方程式为:H2O2+Cl-+ H+= HOCl+ H2O6.下列实验过程、实验目的、判定及解释都正确的是编号实验目的实验过程判定、解释A配制0.4000mol·L-1的NaOH溶液称取4.0g固体NaOH于烧杯中,加入少量蒸馏水溶解,直接转移至250mL容量瓶中定容正确,4.0g固体NaOH的物质的量为0.1mol,定容到250mL的容量瓶,物质的量浓度恰好为0.4000mol·L-1B探究维生素C的还原性向盛有2mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化正确,FeCl3具有氧化性,能与具有还原性的维生素C发生反应,使溶液的颜色由黄色变为浅绿色(Fe2+)C制取并纯化氢气向稀盐酸中加入锌粒,将生成的气体依次通过NaOH溶液、浓硫酸和KMnO4溶液正确,产生的气体依次通过NaOH溶液、浓硫酸和KMnO4溶液,除去可能的酸性气体、水蒸气和还原性气体等杂质,得到纯净氢气D探究浓度对反应速率的影响向2支盛有5mL不同浓度NaHSO3溶液的试管中同时加入2mL 5%H2O2溶液,观察实验现象错误,反应的离子方程式为H2O2+NaHSO3=Na++H++SO42-+H2O没有明显的实验现象,因此不能用此反应探究浓度对反应速率的影响 A.A B.B C.C D.D7.反应CO(g)+H2O(g)=CO2(g)+H2(g)在金催化剂表面上的历程如下图所示(吸附在金催化剂表面上的物种用*标注)。下列说法正确的是A.该历程共包括8个基元反应B.CO(g)和H2O(g)被吸附在催化剂表面时吸收能量C.决速步骤的化学方程式为H2O*=OH*+H*D.放热最多的步骤只有极性键的断裂与形成8.下列实验操作和现象与结论关系不正确的是 操作和现象结论A将大小相同的K和Na放入等体积的水中,钾比钠反应剧烈钾元素的金属性比钠元素强B将Ba(OH)2·8H2O和NH4Cl晶体在小烧杯中混合,用手触摸烧杯外壁感觉变凉Ba(OH)2·8H2O与NH4Cl的反应是吸热反应C向盛有H2O2溶液的试管中,加入少量FeCl3溶液,产生气泡的速率比不加FeCl3溶液的快FeCl3可以加快H2O2分解的速率,起了催化作用D向酸性KMnO4溶液中通入SO2气体,KMnO4溶液紫色褪去。SO2具有漂白性A.A B.B C.C D.D9.苯乙烷()与Cl2在光照条件下发生一氯取代,生成两种一取代物的速率如下图I,反应基本历程如下图II。下列说法不正确的是A.反应①②③的△H>0,反应④⑤⑥的△H<0B.光照条件下,得到等量的(A)和(B)时,生成(B)时需要能量更少C.相同条件下,由苯乙烷分别制备等量的和的△H不相等D.使用恰当的催化剂,可以使反应②的程度减小,反应③的程度增大10.向H2O2溶液中加入少量KI溶液,反应历程是:i.H2O2+I−=H2O+IO−;ii.H2O2+IO-=H2O+O2↑+I−,H2O2分解反应过程中不加KI溶液和加入KI溶液的能量变化如下图所示。下列判断不正确的是A.KI是H2O2分解的催化剂B.曲线②代表加入KI的能量图C.KI能增大H2O2的分解速率D.反应i是放热反应,反应ii是吸热反应 二、填空题11.某含硫酸的酸性工业废水中含有。光照下,草酸(化学式为,是二元弱酸)能将其中的转化为。某课题组研究发现,少量铁明矾即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:在下,控制光照强度、废水样品、初始浓度和催化剂用量相同,调节不同的初始和一定浓度草酸溶液用量,作对比实验,完成了以下实验设计表。实验编号初始pH废水样品体积/mL草酸溶液体积/mL蒸馏水体积/mL①4601030②56030③520测得实验①和②溶液中的浓度随时间变化关系如图所示。 (1)写出草酸与重铬酸钾反应的离子方程式: 。(2) , , 。(3)实验①和②的结果表明 。(4)实验①中时段反应速率 (用代数式表示)。12.关于化学反应的理论是一个经过简化的概念模型,合理简化的概念模型是研究化学反应原理的基础。反应速率的碰撞理论提出:能引发化学反应的碰撞称为有效碰撞。(1)图I是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是 (填“a”“b”或“c”)。(2)过渡态理论是在碰撞理论的基础上提出的:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。根据图Ⅱ写出相应的热化学方程式: 。(3)过渡态理论认为,催化剂改变反应速率的原因是改变了活化能从而改变了反应的途径。请在图Ⅱ中画出该反应在其他条件不变,仅使用催化剂而使反应速率加快的能量变化示意图。 13.尿素是目前使用量较大的一种化学氮肥。I.以、为原料生产尿素的反应历程与能量变化示意图如下:(1)图中的两步反应属于放热反应的 。(用、、、表示,下同)(2)根据图像写出以、为原料生产尿素的热化学方程式: 。(3)根据上述反应历程与能量变化示意图,过程 (填“第一步反应”或“第二步反应”)为决速步。II.氨基甲酸铵为尿素生产过程的中间产物,易分解。某小组对氨基甲酸铵的分解实验进行探究。已知:① ② ③ (4)请写出分解生成与气体的热化学方程式: 。14.加上一点点,作用大无边,功成不居功(打一化学名词) 15.浓度对反应速率影响得一般规律:增大反应物的浓度 化学反应速率,减小反应物的浓度 化学反应速率。16.在 2L 密闭容器中进行反应:mX(g) +nY(g) ⇌ pZ(g) +qQ(g),式中 m、n、p、q 为化学计量数。在0~3min 内, 各物质物质的量的变化如表所示:物质的量XYZQ起始/mol0.7 1 2min 末/mol0.82.70.82.73min 末/mol 0.8 已知:2min 内 v(Q) =0.075 mol·L-1·min-1 ,v(Z):v(Y)=1:2.(1)2min 内 Z 的反应速率 v(Z)= mol·L-1·min-1(2)试确定以下物质的相关量:起始时 n(Y) = mol,n(Q) = mol(3)方程式中 m = ,n = ,p = ,q = (4)对于该反应,能增大反应速率的措施是 (填字母)。A.增大容器体积 B.移走部分 Q C.通入大量X D.升高温度17.为测试铁片中铁元素的含量,某课外活动小组提出下面方案并进行了实验。将0.200g铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用0.0200mol•L-1的KMnO4溶液滴定,达到终点时消耗了25.00mLKMnO4溶液。(1)配平以下方程式并标出电子转移的方同与数目: 。H2SO4+KMnO4+FeSO4→MnSO4+Fe2(SO4)3+K2SO4+H2O(2)铁片中铁元素的质量分数为 ;若通过仪器分析发现该小组的测量结果偏高,以下可能的情况有 。A.酸式滴定管洗净后,直接注入高锰酸钾溶液B.洗净的锥形瓶,再用待测液润洗C.锥形瓶中残留有少量蒸馏水D.滴定至终点时,在滴定管尖嘴部位有气泡(3)高锰酸钾溶液往往用硫酸酸化而不用盐酸酸化,原因是: 。(4)Fe2(SO4)3溶液中c(Fe3+):c(SO) 2:3(填写“>”、“<”或“=”),用离子方程式解释: 。(5)高锰酸钾在化学品生产中,广泛用作为氧化剂,可以氧化H2O2、Fe2+、S2-、SO等多种物质。如H2O2+KMnO4+H2SO4→MnSO4+ +K2SO4+H2O,试推测空格上应填物质的化学式为 。(6)上述反应在恒温下进行,该过程中会明显看到先慢后快的反应,原因可能是 。18.已知氢气的燃烧热为285 kJ·mol−1,氨气在氧气中燃烧的热化学方程式为:4NH3(g) + 3O2(g) 2N2(g) + 6H2O(l) ΔH = -1526 kJ·mol−1回答下列问题:(1)写出表示氢气燃烧热的热化学方程式 ,氢气作为未来理想燃料的优点是 。(2)根据上述信息可知:N2(g) + 3H2(g) 2NH3(g) ΔH = ,若H-H的键能为436 kJ·mol−1,N-H的键能为400 kJ·mol−1,则N≡N的键能为 kJ·mol−1。(3)工业上,合成氨反应在催化剂表面的变化如图所示,下列说法错误的是_______(填标号)。A.①→②表示催化剂的吸附过程,该过程吸收能量B.②→③→④的过程中有非极性键的断裂和形成C.合成氨反应正反应的活化能小于逆反应的活化能D.过程⑤中有化学键的断裂19.在密闭容器里,通入xmolH2(g)和ymolI2(g),改变下列条件,反应速率将如何变化?(填“增大、减小、或无影响”)(1)若升高温度,速率 ;(2)若加入催化剂,速率 ;(3)若充入更多的H2,速率 ;20.三氧化二镍(Ni2O3)是重要的电子元件材料和蓄电池材料,工业上利用含镍废料(主要成分为镍、铝、氧化铁、碳等)提取Ni2O3,工业流程如图:“预处理”操作可以选择用 来除去废旧镍电池表面的矿物油污 三、实验题21.回答下列问题(1)金属与硝酸反应通常不能生成H2,用3mol·L-1HNO3与过量铁粉反应,HNO3的还原产物主要是NO,请写出反应的离子方程式: 。有同学在查阅文献时发现文献有记载:HNO3与铁反应能产生H2。于是其小组进行了金属铁与硝酸反应能否产生H2及其有利条件的探究。实验Ⅰ:20℃,将过量铁粉溶于0.5mol·L-1HNO3中,立即有无色气体生成,充分反应后,溶液几乎无色。(2)检验气体:方法如图所示。确认气体是H2,不含NO。实验证据是 。(3)检验溶液:取上层清液,等分两份①向一份滴加溶液, (填现象),说明含有Fe2+。②向另一份加入NaOH溶液,产生灰绿色沉淀;加热至沸,有刺激性气味气体逸出,用湿润红色石蕊试纸检验,试纸变蓝。综合①、②,说明实验Ⅰ中发生的反应有,另外还有 (写出离子方程式)。(4)对H2产生的原因提出假设:在稀的酸性溶液中,HNO3中H+的氧化性大于,验证如下:实验Ⅱ:将铜粉溶于中。经检测,发现没有 生成,初步证实假设不成立。(5)再次查阅文献发现:在酸性介质中,尽管电极电势数据显示离子是个颇强的氧化剂,然而动力学原因导致它在稀酸中的反应一般都很慢。于是小组改变条件重复实验Ⅰ,向中加入过量铁粉,结果如下:实验序号ⅢⅣⅤ温度20℃40℃60℃生成H2体积6.0mL3.4mL2.6mL经检验,实验Ⅲ、Ⅳ、Ⅴ中,的还原产物与实验Ⅰ相同。从反应速率的角度解释温度升高H2体积减少的原因 。22.影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。他们利用Cu、Fe、Mg和不同浓度的硫酸溶液(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素。甲同学研究的实验报告如表所示:实验步骤现象结论①分别取等体积2mol/L硫酸溶液于三支试管中②向三支试管中分别投入大小、形状相同的Cu、Fe、Mg反应速率:,Cu不反应金属的性质越活泼,反应速率越快(1)甲同学的实验目的是 。乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行定量实验。(2)乙同学在实验中应该测定的数据是 。(3)乙同学完成该实验应选用的实验药品是 。23.KMnO4酸性溶液与草酸(H2C2O4)溶液反应时,溶液紫色会逐渐褪去。某探究小组用测定此反应溶液紫色消失所需时间的方法,研究外界条件对反应速率的影响。该实验条件作如下限定:①所用KMnO4酸性溶液的浓度可选择:0.02mol·L-1、0.002mol·L-1;②所用H2C2O4溶液的浓度可选择:0.2mol·L-1、4mol·L-1;③每次实验时KMnO4酸性溶液的用量均为4mL、H2C2O4溶液的用量均为2mL。(1)已知:①H2C2O4电离常数,Ka1=5.9×10-2,Ka2=6.4×10-5。②与KMnO4反应时,H2C2O4转化为CO2和H2O。写出草酸与酸性高锰酸钾溶液反应的离子方程式 。(2)若要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成 组实验进行对比即可得出结论。(3)在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得实验数据(从混合振荡均匀开始计时)如表所示:KMnO4酸性溶液浓度(mol•L-1)溶液褪色所需时间(min)第一次第二次第三次0.021413110.0026.76.66.7①用0.002mol·L-1KMnO4酸性溶液进行实验时,KMnO4的平均反应速率 (忽略混合前后溶液体积变化)。②该小组同学认为依据表中数据,不能得出“溶液的褪色所需时间越短,反应速率越快”的结论。该同学设计以下方案,可以直接得出“褪色时间越短,反应的速率越快”结论。KMnO4酸性溶液H2C2O4溶液浓度/mol•L-1体积(mL)浓度/mol•L-1体积(mL)0.022b4a2c4则表中a= ;b= ;c= 。(4)测得某次实验(恒温)时溶液中Mn2+物质的量与时间关系如图。请解释n(Mn2+)在反应初始时变化不大一段时间后快速增大的原因: 。 参考答案:1.B2.A3.C4.A5.B6.B7.C8.D9.B10.D11.(1)(2) 10 60 20(3)其他条件相同时,溶液的初始值越小,反应速率越快或溶液的对反应速率有影响(4) 12. a 13.(1)(2) (3)第二步反应(4) 14.催化剂15. 加快 减慢16. 0.05mol/(L·min) 2.3 3 1 4 2 3 CD17. 70% AB 盐酸具有还原性,易被高锰酸钾氧化 < Fe3++3H2OFe(OH)3+3H+ O2 生成的锰离子具有催化作用,加快反应速率18.(1) H2(g) +O2(g) = H2O(l) ∆H = -285 kJ·mol−1 热值大,生成物无污染(答到任何一点即得分)(2) -92 kJ·mol−1 1000(3)BD 19. 增大 增大 增大20.酒精清洗21.(1)(2)气体遇空气未见红棕色;点燃肥皂泡,发出爆鸣声(3) 产生蓝色沉淀 (4)H2(5)温度升高,H+、表现氧化性自身被还原的速率均增大,参与反应的速率增大得更多,且同时消耗H+;使H+浓度下降,得电子(表现氧化性)的机会减少,导致产生H2的体积减少 22.(1)研究金属(或反应物)本身的性质与反应速率的关系(2)一定时间内产生气体的体积(或产生一定体积的气体所需的时间)(3)Mg(或Fe)、0.5mol/L硫酸溶液、2mol/L硫酸溶液 23. 5H2C2O4+2MnO+6H+=2Mn2++10CO2↑+8H2O 4 2×10-4mol/(L•min) 0.02 0.2或0.4 0.4或0.2 Mn2+对该反应有催化作用
相关课件
这是一份化学选择性必修1第二节 反应热的计算多媒体教学ppt课件,共17页。
这是一份高中化学第一节 原电池评课课件ppt,共17页。
这是一份高中化学人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡实验活动3 盐类水解的应用课前预习课件ppt,共14页。










