

所属成套资源:2024荆州沙中学高二上学期9月月考试题(新)及答案(九科)
2024荆州沙中学高二上学期9月月考化学试题含答案
展开这是一份2024荆州沙中学高二上学期9月月考化学试题含答案,共8页。试卷主要包含了选择题等内容,欢迎下载使用。
2023—2024学年度上学期2022级
9月月考化学试卷
命题人:丁琴君 审题人:王晓巍
考试时间:2023年9月14日
考试时间:75分钟
可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 Fe-56 Zn-65
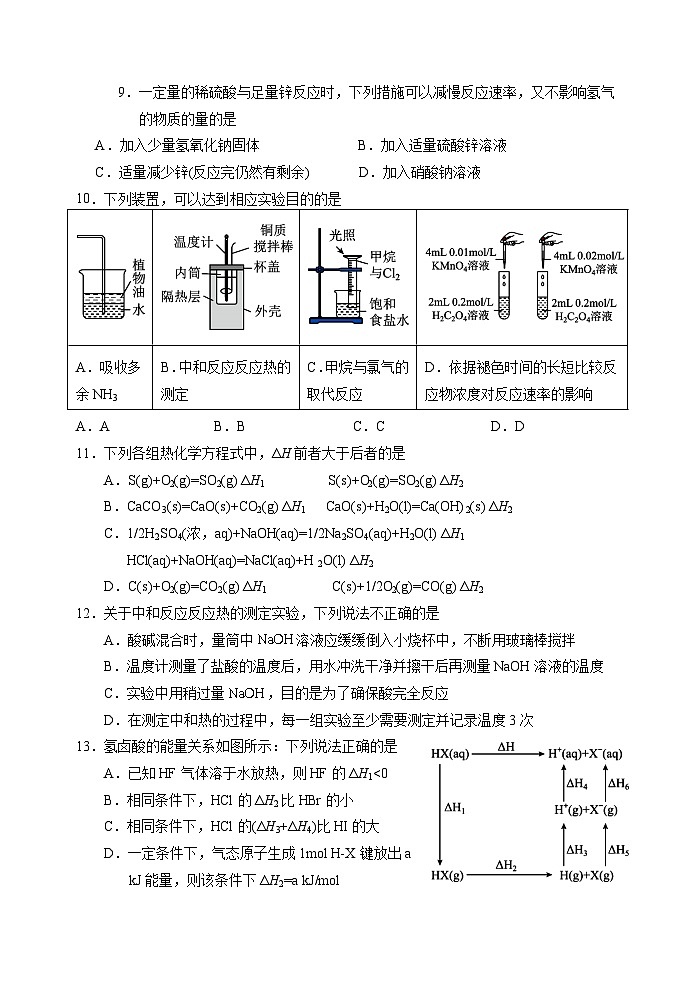
一、选择题(本题包括15个小题,每小题3分,共45分,每小题只有1个选项符合题意)
1.下列关于结构的表示方法正确的是
A.乙酸乙酯的结构式: B.用于考古断代的碳原子符号:
C.四氯化碳的电子式: D.乙烯的结构简式:CH2CH2
2.下列反应属于放热反应的是
A.Na与H2O反应 B.NH4Cl与Ba(OH)2·8H2O反应
C.C与CO2高温反应生成CO D.NaOH固体溶于水
3.化学创造美好生活。下列说法正确的是
A.酸雨是pH小于7的雨水,燃煤脱硫可防治硫酸型酸雨
B.淀粉、纤维素和油脂均是天然有机高分子
C.“北斗系统”组网成功,北斗芯片中的半导体材料为二氧化硅
D.误食重金属盐会引起人体中毒,可以喝大量牛奶解毒
4.对于反应中的能量变化,表述正确的是
A.加热才能发生的反应肯定属于吸热反应
B.化学变化时形成化学键的过程需吸收能量
C.ΔH<0的反应中,反应物的总能量大于生成物的总能量
D.有化学键断裂的过程一定发生了化学变化
5.央视兔年春晚《满庭芳·国色》唱了42个颜色名,艺术地表现了中国人对传统国色的极致表达和美学追求。一些矿物颜料的色彩和主要成分见表:
色彩 | 霞光红 | 迎春黄 | 天霁蓝 | 瑞雪白 |
主要成分 | 朱砂 | 雌黄 | 石青 | 蛤灰 |
化学式 | HgS | As2S3 | Cu(OH)2•2CuCO3 | CaO |
下列说法正确的是
A.石青颜料耐酸碱腐蚀
B.蛤灰加水后会放出大量的热
C.工业制汞是在空气中焙烧朱砂,生产流程中加入氧化钙的是为减少汞蒸气的排放
D.《遁斋闲览》中记载:有误字,以雌黄灭之,为其与纸色相类。利用了雌黄的化学性质
6.下列化学反应的离子方程式正确的是
A.将过量SO2气体通入NaClO溶液中:
B.向酸性碘化钾溶液中滴加适量双氧水:
C.过量铁粉与稀硝酸反应:
D.用氯化铁溶液腐蚀铜板:
7.铁触媒催化合成氨的反应历程如图所示,其中吸附在催化剂表面的物质用“ad”表示,下列说法正确的是
A.该历程中,“吸附”过程吸热,“脱附”过程放热
B.合成氨反应N2(g)+3H2(g)⇌2NH3(g)的ΔH=-92 kJ·mol-1
C.铁触媒不仅可以改变反应历程,增大活化分子百分数,还可以改变该反应的焓变
D.该历程中反应速率最慢的过程为N2ad+H2=N2ad+3Had
8.下列说法正确的是
A.热化学方程式中的化学计量数只表示物质的量,可以是分数
B.同温同压下,4Al(s)+3O2(g) = 2Al2O3(s)在常温和点燃条件下的ΔH不同
C.活化能是指活化分子具有的最低能量
D.由 C(s,石墨) = C(s,金刚石) ΔH= +1.90 kJ·mol-1 可知,金刚石比石墨稳定
9.一定量的稀硫酸与足量锌反应时,下列措施可以减慢反应速率,又不影响氢气的物质的量的是
A.加入少量氢氧化钠固体 B.加入适量硫酸锌溶液
C.适量减少锌(反应完仍然有剩余) D.加入硝酸钠溶液
10.下列装置,可以达到相应实验目的的是
A.吸收多余NH3 | B.中和反应反应热的测定 | C.甲烷与氯气的取代反应 | D.依据褪色时间的长短比较反应物浓度对反应速率的影响 |
A.A B.B C.C D.D
11.下列各组热化学方程式中,ΔH前者大于后者的是
A.S(g)+O2(g)=SO2(g) ΔH1 S(s)+O2(g)=SO2(g) ΔH2
B.CaCO3(s)=CaO(s)+CO2(g) ΔH1 CaO(s)+H2O(l)=Ca(OH)2(s) ΔH2
C.1/2H2SO4(浓,aq)+NaOH(aq)=1/2Na2SO4(aq)+H2O(l) ΔH1
HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l) ΔH2
D.C(s)+O2(g)=CO2(g) ΔH1 C(s)+1/2O2(g)=CO(g) ΔH2
12.关于中和反应反应热的测定实验,下列说法不正确的是
A.酸碱混合时,量筒中溶液应缓缓倒入小烧杯中,不断用玻璃棒搅拌
B.温度计测量了盐酸的温度后,用水冲洗干净并擦干后再测量NaOH溶液的温度
C.实验中用稍过量,目的是为了确保酸完全反应
D.在测定中和热的过程中,每一组实验至少需要测定并记录温度3次
13.氢卤酸的能量关系如图所示:下列说法正确的是
A.已知HF气体溶于水放热,则HF的ΔH1<0
B.相同条件下,HCl的ΔH2比HBr的小
C.相同条件下,HCl的(ΔH3+ΔH4)比HI的大
D.一定条件下,气态原子生成1mol H-X键放出a kJ能量,则该条件下ΔH2=a kJ/mol
14.铑的配合物离子[Rh(CO)2I2]-可催化甲醇羰基化,反应过程如图所示。下列叙述错误的是
A.CH3COI是反应中间体
B.甲醇羰基化反应为CH3OH+CO===CH3CO2H
C.反应过程中Rh的成键数目保持不变
D.增大CH3OH的浓度,可以增大单位体积内活化分子数
15.在密闭容器中进行反应X+2Y⇌2Z,已知反应中X、Y、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到化学平衡时,各物质的浓度可能是
A.X为0.2mol/L B.Y为0.5mol/L
C.Y为0.1mol/L D.Z为0.35mol/L
16.(14分)某校化学活动社团做了如下探究实验:
实验一:测定1 mol/L的硫酸与锌粒或锌粉反应的速率,设计如图I装置:
(1)装置图I中盛装硫酸的仪器名称是 。
(2)按照图I装置实验时,限定了两次实验时间均为10 min,还需要测定的另一个数据是 。
(3)将图Ⅰ装置中的气体收集装置改为图Ⅱ,实验结束后读取气体体积时应该注意的问题是 (至少回答两点)。
实验二:通过实验探究温度和浓度对反应速率的影响。
实验原理及方案:在酸性溶液中,KIO3和Na2SO3可发生反应生成I2,生成的I2可用淀粉溶液检验,根据出现蓝色所需的时间来衡量该反应的速率。
实验序号 | 0.1 mol·L-1 KIO3酸性溶液(含淀粉)的体积/mL | 0.1 mol·L-1 Na2SO3溶液的体积/mL | 水的体积/mL | 实验 温度/℃ | 出现蓝色的时间/s |
① | 5 | 5 | V1 | 5 | t1 |
② | 5 | 5 | 40 | 25 | t2 |
③ | 5 | V2 | 35 | 25 | t3 |
(4)碘酸钾和亚硫酸钠反应的离子方程式为 ;
(5)实验①③中V1= ,V2= ;出现蓝色的时间由大到小的顺序 ;
(6)对比实验②、③可得出的结论是 ;
(7)资料显示序号①的反应进行至10 s时,测得Na2SO3溶液的浓度为0.005 mol·L-1,则10 s内生成I2的平均化学反应速率υ(I2)= 。
17.(14分)化学反应过程中释放或吸收的热量在生活、生产、科技及科研中应用广泛。
(1)生活中的冷敷袋是利用 (填“放热”或“吸热”)的化学变化或物理变化。
(2)图Ⅰ是1mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中能量变化示意图,正向反应的活化能为 ,ΔH= 。
(3)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
又已知③H2O(g)=H2O(l) ΔH=-44 kJ·mol-1,
则表示甲醇燃烧热的热化学方程式为: 。
(4)下表是部分化学键的键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能/kJ·mol-1 | a | b | c | x |
已知 1 mol 白磷(P4)完全燃烧放热为d kJ,白磷及其完全燃烧的产物结构如图Ⅱ所示,则表中 x= kJ·mol-1(用含有 a、b、c、d 的代数式表示)。
(5)已知反应中A+B=C+D中A、B、C、D所含能量依次可表示为EA、EB、EC、ED,该反应∆H= 。
(6)已知:H2和C3H8的燃烧热分别为285.8kJ·mol-1和2219.9kJ·mol-1,在25℃和101kPa,H2和C3H8的混合气体5mol完全燃烧生成CO2和液态水,放出6264.2kJ的热量。则混合气体中H2和C3H8的体积比是 。
18.(13分)(1)某温度下在容积为2L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。
①该反应的化学方程式是 。
②4min时,υ正 υ逆(填“>”“<”或“=")。
③若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经相同时间后,测得三个容器中的反应速率分别为甲:υ(X)=0.3 mol·L-1·s-1,乙:υ(Y)=0.12 mol·L-1·s-1,丙:υ(Z)=9.6 mol·L-1·min-1。则甲、乙、丙三个容器中反应速率由快到慢的顺序为____________。
④下列措施能增大该反应速率的是 (选填字母)
A.升高温度 B.恒容条件下充入Ar气
C.减小Z的浓度 D.将反应容器体积缩小
(2)反应2NO(g)+O2(g)⇌2NO2(g),在一定温度下密闭容器内,能说明该反应已经达到化学平衡状态的是 。
a.2υ逆(NO)=υ正(O2) b.容器内压强保持不变 c.υ(NO2)=2υ(O2)
d.容器内的密度保持不变 e.容器内混合气体平均相对分子质量不变
f.c(NO):c(O2):c(NO2)=2:1:2 g.容器内气体颜色不变
(3)常见的烟道气中除去SO2的方法之一:2CO(g)+SO2(g)⇌2CO2(g)+S(l) (ΔH<0),该反应的平衡常数表达式为 。若在2L的密闭容器中进行上述反应,经测定在5min内气体的质量减少了1.6g,则0~5min的平均反应速率υ(SO2)= 。
19.(14分)已知:有机物 A 的产量可以用来衡量一个国家的石油化工发展水平,B 和 D 是生活中两种常见的有机物。现以A为主要原料合成乙酸乙酯,其合成路线如图1所示。
(1)物质B的名称是 ,反应①的反应类型是 ;
(2)反应④的化学方程式是 ;
(3)E是常见的高分子材料,E的结构简式是 ;
(4)某同学用如图2所示的实验装置制取少量乙酸乙酯。实验结束后,试管甲中上层为透明的、不溶于水的油状液体。实验时,甲中饱和碳酸钠溶液的作用是(填字母) 。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.加速酯的生成,提高其产率
D.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
(5)写出分子中含有HCOO—的E的同分异构体的结构简式: 。
(6)B的同系物CH3OH制作的燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、氧气和KOH溶液构成。该燃料电池的总反应为CH3OH+O2+KOH→K2CO3+H2O(未配平)。该燃料电池的负极电极反应式为
。
高二9月月考化学参考答案
1-15 CADCB ABABC BADCD
16.(14分,除标注外每空2分)
(1)分液漏斗(1分)
(2)收集到气体的体积(1分)
(3)待瓶中气体恢复至室温,调节软管使甲、乙中液面相平,视线平视凹液面最低点
(4)2+5+2H+=I2+5+H2O
(5)40(1分) 10(1分) t1>t2>t3
(6)其他条件相同时,反应物浓度越大,化学反应速率越快
(7)0.0001 mol·L-1·s-1
17.(14分,每空2分)
(1)吸热 (2)134kJ·mol-1 -234 kJ·mol-1
(3)CH3OH(g)+O2(g)=CO2(g)+2H2O(l)ΔH=-764.7 kJ·mol-1
(4) (5) (EC+ED)—(EA+EB) (6)1:1
18.(13分,除标注外每空2分)
(1)3X(g)+Y(g)⇌2Z(g) >(1分) 乙>甲>丙 AD
(2)beg (3) 0.005mol/(L•min)
19.(14分,每空2分)
(1)乙醇 加成反应 (2) (3) (4)BD (5)HCOOCH2CH2CH3、HCOOCH(CH3)2
(6) CH3OH+8OH--6e- = CO+6H2O
相关试卷
这是一份2024荆州沙中学高二下学期3月月考化学试题含答案,共10页。试卷主要包含了2L HF分子中F原子数为0,5NA,00等内容,欢迎下载使用。
这是一份2024荆州沙中学高三上学期10月月考化学含答案,共5页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
这是一份2024荆州沙中学高一上学期9月月考化学试题含答案,共5页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。








