

高中化学人教版 (2019)选择性必修1第二节 反应热的计算课时练习
展开
这是一份高中化学人教版 (2019)选择性必修1第二节 反应热的计算课时练习,共12页。试卷主要包含了已知热化学方程式,33 kJ·ml-1等内容,欢迎下载使用。
第二节 反应热的计算
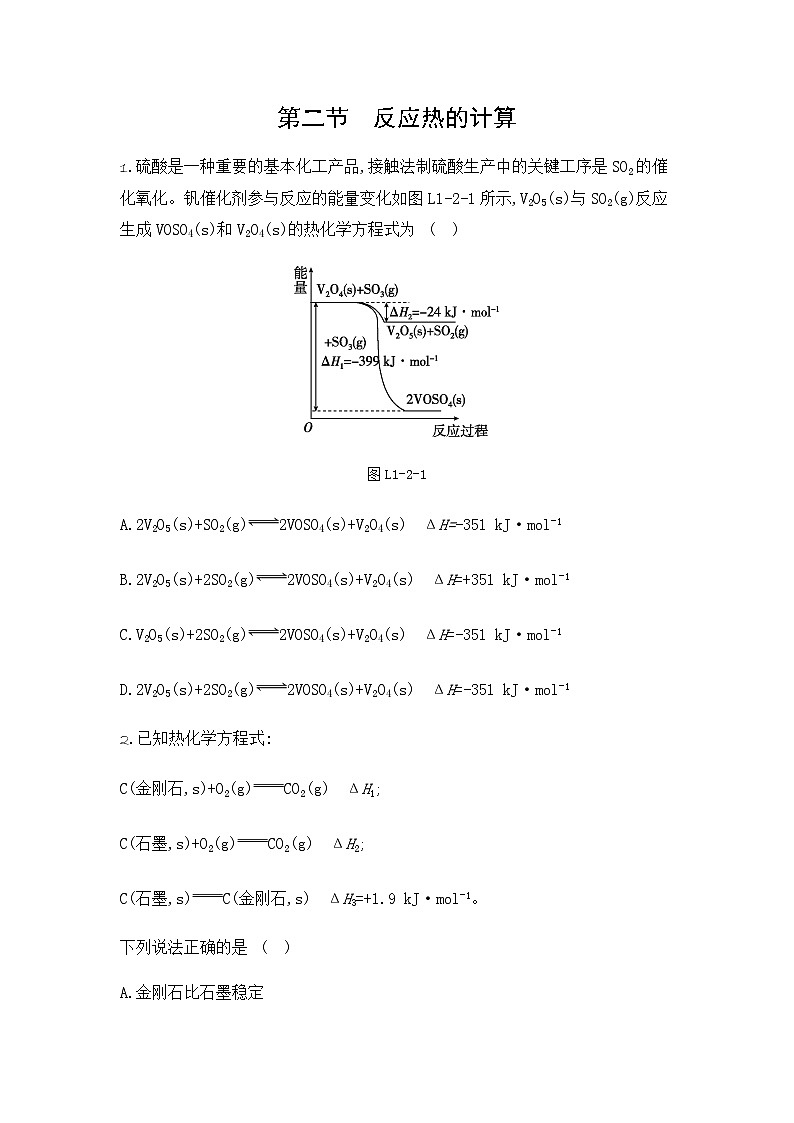
1.硫酸是一种重要的基本化工产品,接触法制硫酸生产中的关键工序是SO2的催化氧化。钒催化剂参与反应的能量变化如图L1-2-1所示,V2O5(s)与SO2(g)反应生成VOSO4(s)和V2O4(s)的热化学方程式为 ( )
图L1-2-1
A.2V2O5(s)+SO2(g)2VOSO4(s)+V2O4(s) ΔH=-351 kJ·mol-1
B.2V2O5(s)+2SO2(g)2VOSO4(s)+V2O4(s) ΔH=+351 kJ·mol-1
C.V2O5(s)+2SO2(g)2VOSO4(s)+V2O4(s) ΔH=-351 kJ·mol-1
D.2V2O5(s)+2SO2(g)2VOSO4(s)+V2O4(s) ΔH=-351 kJ·mol-1
2.已知热化学方程式:
C(金刚石,s)+O2(g)CO2(g) ΔH1;
C(石墨,s)+O2(g)CO2(g) ΔH2;
C(石墨,s)C(金刚石,s) ΔH3=+1.9 kJ·mol-1。
下列说法正确的是 ( )
A.金刚石比石墨稳定
B.ΔH1>ΔH2
C.ΔH3=ΔH1-ΔH2
D.石墨转化成金刚石的反应是吸热反应
3.相同温度和压强下,关于反应的ΔH,下列判断正确的是 ( )
(g)+H2(g)(g) ΔH1
(g)+2H2(g)(g) ΔH2
(g)+3H2(g)(g) ΔH3
(g)+H2(g)(g) ΔH4
A.ΔH1>0,ΔH2>0
B.ΔH3=ΔH1+ΔH2
C.ΔH1>ΔH2,ΔH3>ΔH2
D.ΔH2=ΔH3+ΔH4
4.化学反应中常常伴随有能量变化,某反应的能量变化图如图L1-2-4所示,下列叙述正确的是 ( )
图L1-2-4
A.该反应一定需要加热
B.ΔH=E1-E2,加入催化剂,ΔH减小
C.该反应的任意一种反应物一定比任意一种生成物稳定
D.该反应断开所有反应物化学键所吸收的能量大于形成所有生成物化学键所释放的能量
5.根据如下能量关系示意图,下列说法正确的是 ( )
图L1-2-5
A.1 mol C(s)与1 mol O2(g)的能量之和为393.5 kJ
B.由C→CO的热化学方程式为2C(s)+O2(g)2CO(g) ΔH=-221.2 kJ∙ mol-1
C.反应2CO(g)+O2(g)2CO2(g)中,生成物的总能量大于反应物的总能量
D.将1 mol C(s)磨成粉末后,反应更加剧烈,说明粉碎可以改变ΔH
6. H2(g)+ ΔH=+124 kJ· mol-1。已知:部分化学键的键能如下,则x值为 ( )
化学键
C—H
C—C
CC
H—H
键能/
(kJ·mol-1)
412
348
x
436
A.264 B.536 C.612 D.696
7.单斜硫和正交硫转化为二氧化硫的能量变化如图L1-2-6所示,下列说法不正确的是 ( )
图L1-2-6
A.单斜硫和正交硫互为同素异形体
B.单斜硫比正交硫稳定
C.1 mol SO2(g)分解成1 mol S(单斜,s)和1 mol O2时会吸收热量
D.S(单斜,s)S(正交,s) ΔH=-0.33 kJ·mol-1
8.(1)金刚石和石墨互为同素异形体,它们在氧气不足时燃烧生成一氧化碳,充分燃烧时生成二氧化碳,反应中放出的热量如图L1-2-2所示:
图L1-2-2
等物质的量的金刚石和石墨完全燃烧 (填“金刚石”或“石墨”)放出热量更多。在通常状况下,金刚石和石墨相比, (填“金刚石”或“石墨”)更稳定。请写出表示石墨燃烧热的热化学方程式: 。
(2)已知:Fe2O3(s)+32C(石墨,s)32CO2(g)+2Fe(s) ΔH=+234.1 kJ·mol-1,则Fe2O3(s)32O2(g)+2Fe(s) ΔH= kJ·mol-1。
(3)意大利科学家获得了极具理论研究意义的N4分子。N4分子结构如图L1-2-3所示,已知断裂1 mol N—N吸收167 kJ热量,形成1 mol N≡N放出942 kJ热量。根据以上信息和数据,计算1 mol N4气体转变为N2的ΔH= kJ·mol-1。
图L1-2-3
9. (1)室温下,2 g苯(C6H6)完全燃烧生成液态水和CO2,放出83.6 kJ的热量,写出1 mol C6H6完全燃烧的热化学方程式: 。
(2)已知:Fe2O3(s)+32C(s)32CO2(g)+2Fe(s) ΔH=+a kJ·mol-1;
C(s)+O2(g)CO2(g) ΔH=-b kJ·mol-1。
则2Fe(s)+32O2(g)Fe2O3(s)的ΔH= 。
(3)已知下列两个热化学方程式:
H2(g)+12O2(g)H2O(l) ΔH=-285.8 kJ·mol-1
C3H8(g)+5O2(g)3CO2(g)+4H2O(l) ΔH=-2 220.0 kJ·mol-1
①实验测得H2和C3H8的混合气体共5 mol,完全燃烧生成液态水时放热6 264.5 kJ,则混合气体中H2和C3H8的体积之比为 。
②已知:H2O(l)H2O(g) ΔH=+44.0 kJ·mol-1,求1 mol丙烷燃烧生成CO2和气态水的ΔH= 。
10.(1)C、N、S的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的影响。
CO2的重整:以CO2和H2为原料可得到CH4。
已知:①CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH1=+247 kJ·mol-1;
②CH4(g)+H2O(g)CO(g)+3H2(g) ΔH2=+205 kJ·mol-1。
则CO2重整的热化学方程式为 。
(2)已知部分物质燃烧的热化学方程式如下:
2H2(g)+O2(g)2H2O(g)
ΔH=-484 kJ·mol-1;
2CO(g)+O2(g)2CO2(g)
ΔH=-566 kJ·mol-1;
CH4(g)+2O2(g)CO2(g)+2H2O(g)
ΔH=-802 kJ·mol-1。
CH4和O2反应生成CO和H2的热化学方程式为 。
(3)NH3是造成水体富营养化的重要因素之一,用次氯酸将水中的NH3转化为氮气除去,其相关反应的热化学方程式如下:
反应Ⅰ:NH3(aq)+HClO(aq)NH2Cl(aq)+H2O(l) ΔH1=a kJ·mol-1;
反应Ⅱ:NH2Cl(aq)+HClO(aq)NHCl2(aq)+H2O(l) ΔH2=b kJ·mol-1;
反应Ⅲ:2NHCl2(aq)+H2O(l)N2(g)+HClO(aq)+3HCl(aq) ΔH3=c kJ·mol-1。
则2NH3(aq)+3HClO(aq)N2(g)+3HCl(aq)+3H2O(l) ΔH= kJ·mol-1。
(4)已知:
①2CO(g)+SO2(g)S(l)+2CO2(g)
ΔH1=-37.0 kJ·mol-1;
②2H2(g)+SO2(g)S(l)+2H2O(g)
ΔH2=+45.0 kJ·mol-1;
③2CO(g)+O2(g)2CO2(g)
ΔH3=-566.0 kJ·mol-1;
④2H2(g)+O2(g)2H2O(g)
ΔH4=-484.0 kJ·mol-1。
写出液态硫(S)燃烧的热化学方程式: 。
第二节 反应热的计算
1.D [解析] 由题中信息可知:
①V2O4(s)+2SO3(g)2VOSO4(s) ΔH1=-399 kJ·mol-1
②V2O4(s)+SO3(g)V2O5(s)+SO2(g) ΔH2=-24 kJ·mol-1
根据盖斯定律可知,①-②×2得:2V2O5(s)+2SO2(g)2VOSO4(s)+V2O4(s),则ΔH=ΔH1-2ΔH2=(-399 kJ·mol-1)-(-24 kJ·mol-1)×2=-351 kJ·mol-1,所以该反应的热化学方程式为2V2O5(s)+2SO2(g)2VOSO4(s)+V2O4(s) ΔH=-351 kJ·mol-1。
2.D [解析] 石墨转化为金刚石要吸收能量,说明石墨的能量低,石墨比金刚石稳定,A错误;石墨的能量低于金刚石的能量,故石墨燃烧放出的能量比等质量的金刚石少,放热反应的ΔH
相关试卷
这是一份人教版 (2019)选择性必修1第二节 反应热的计算课堂检测,共20页。试卷主要包含了单选题,综合题等内容,欢迎下载使用。
这是一份人教版 (2019)选择性必修1第二节 反应热的计算一课一练,共20页。试卷主要包含了2 反应热的计算 课后训练,8kJ·ml-1、-1411,2kJ·ml-1B.+44,8kJ•ml-1,5Q3﹣Q2+2Q1,4kJ·ml-1,则,2kJ•ml﹣1,,0 kJ·ml-1等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修1第二节 反应热的计算随堂练习题,共15页。试卷主要包含了2反应热的计算同步练习题,3,则甲烷燃烧的热化学方程式为,8 kJ,9kJ/ml等内容,欢迎下载使用。









