

选择性必修1第3节 化学反应的速率课后作业题
展开
这是一份选择性必修1第3节 化学反应的速率课后作业题,共15页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
2.3化学反应的速率同步练习-鲁科版高中化学选择性必修1
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列说法正确的是
A.活化分子碰撞即发生化学反应
B.增大反应物的浓度会加快反应速率,原因是增加了活化分子的百分数
C.某一反应的活化分子的百分数是个定值不随外界条件改变而改变
D.活化分子间的碰撞不一定是有效碰撞
2.一定温度下,在恒容密闭容器中发生反应:N2(g)+3H2(g)⇌2NH3(g)。能说明该反应已达化学平衡状态的是
A.正、逆反应速率都等于零 B.N2和H2全部转化为NH3
C.N2、H2和NH3的浓度不再变化 D.N2、H2和NH3的物质的量之比为1∶3∶2
3.用NA代表阿伏加德罗常数的值,下列说法正确的是
A.1.8g重水(D2O)中所含质子数为NA
B.2molNO与1molO2在密闭容器中充分反应后的分子数为2NA
C.0.1mol/L HClO4溶液中含有的H+数为0.1NA
D.1.6g由O2和O3组成的混合物中含有氧原子的数目为0.1NA
4.对于反应,在不同时间段内所测反应速率如下,则表示该化学反应进行最快的是
A. B.
C. D.
5.在一定温度下,向aL密闭容器中加入1molX气体和2molY气体,发生如下反应:X(g)+2Y(g)2Z(g),此反应达到平衡的标志是
A.容器内各物质的浓度不随时间变化 B.气体的平均摩尔质量变大
C.容器内X、Y、Z的浓度之比为1:2:2 D.单位时间消耗0.1molX同时生成0.2molZ
6.在2A(g)+3B(g)2C(g)+D(g)的反应中,表示反应速率最快的是
A.v(A)=0.5mol•L-1•min-1 B.v(B)=0.6mol•L-1•min-1
C.v(C)=0.7mol•L-1•min-1 D.v(D)=0.4mol•L-1•min-1
7.下列说法正确的是( )
A.活化分子间发生的所有碰撞均为有效碰撞
B.升高温度,增加了活化分子百分数
C.使用催化剂,能降低反应的反应热
D.对于气体反应,增大压强能提高活化分子总数
8.向K2S2O8和KI的混合溶液中滴加FeCl3溶液,反应过程中的能量变化如图所示,下列有关该反应的说法正确的是
A.反应过程中v() = v(I-) = v(I2)
B.Fe3+是该反应的催化剂,所以c(Fe3+)与反应速率无关
C.若不加FeCl3,则正反应的活化能比逆反应的活化能大
D.步骤① 2Fe3+(aq) + 2I-(aq) = I2(aq) + 2Fe2+(aq) ΔH1;步骤② 2Fe2+(aq) + (aq) = 2Fe3+ + 2 (aq) ΔH2 ,则ΔH1> ΔH2
9.下列说法不正确的是
A.恒温恒容下,对于反应,压强不再变化,说明反应已达到平衡状态
B.绝热体系中,对于反应,正反应为放热反应,若反应体系的温度不变,说明反应已达到平衡状态
C.在恒容容器中,发生反应,若混合气体的颜色不再变化,说明反应达到平衡状态
D.恒温恒容下,对于反应:,当,反应达到平衡状态
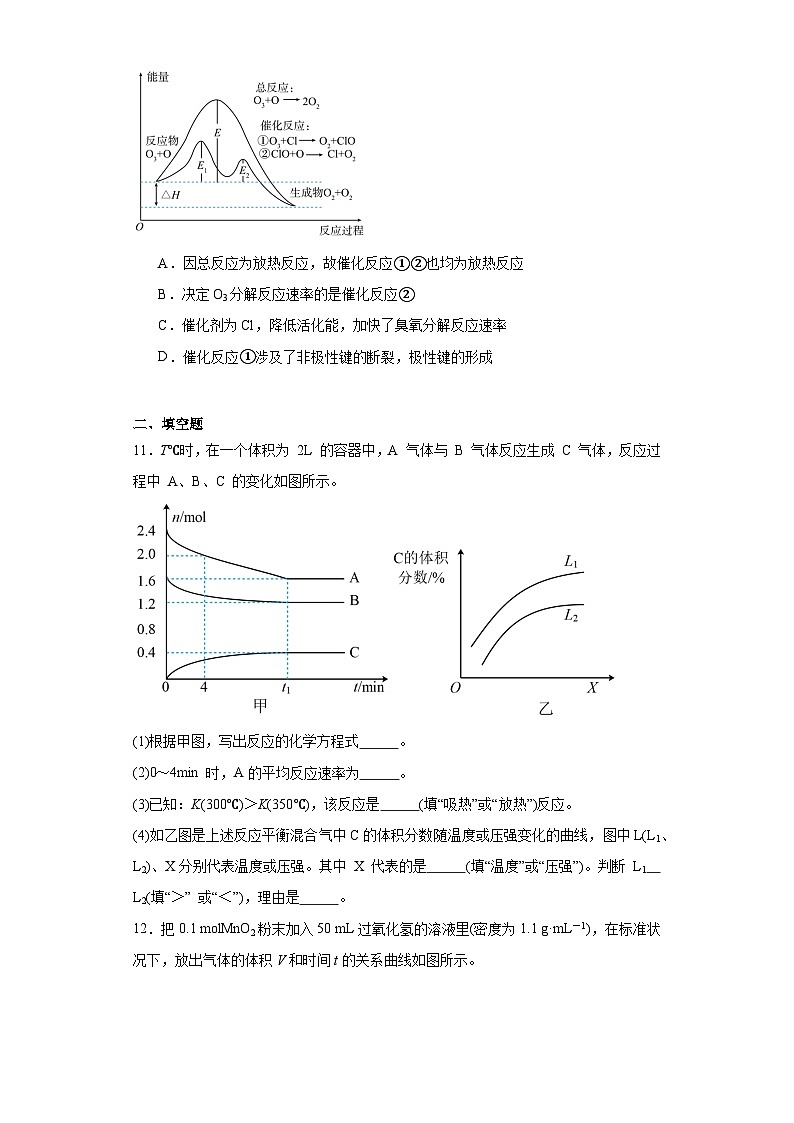
10.大气层中臭氧分解反应历程如图所示,下列说法正确的是
A.因总反应为放热反应,故催化反应①②也均为放热反应
B.决定O3分解反应速率的是催化反应②
C.催化剂为Cl,降低活化能,加快了臭氧分解反应速率
D.催化反应①涉及了非极性键的断裂,极性键的形成
二、填空题
11.T℃时,在一个体积为 2L 的容器中,A 气体与 B 气体反应生成 C 气体,反应过程中 A、B、C 的变化如图所示。
(1)根据甲图,写出反应的化学方程式 。
(2)0~4min 时,A的平均反应速率为 。
(3)已知:K(300℃)>K(350℃),该反应是 (填“吸热”或“放热”)反应。
(4)如乙图是上述反应平衡混合气中C的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。其中 X 代表的是 (填“温度”或“压强”)。判断 L1 L2(填“>” 或“<”),理由是 。
12.把0.1 molMnO2粉末加入50 mL过氧化氢的溶液里(密度为1.1 g·mL-1),在标准状况下,放出气体的体积V和时间t的关系曲线如图所示。
(1)实验时放出气体的体积为 。
(2)放出一半气体所需的时间约为 。
(3)根据曲线形状解释反应速率变化的原因 。
13.回答下列问题:
(1)将一定量的A、B、C三种物质(都是气体)放入固定体积为10L的密闭容器中,一定条件下发生反应,一段时间内测得各物质的物质的量变化如图所示。
请回答下列问题:
①该反应的化学方程式用A、B、C可表示为 。
②用B的浓度变化表示0~10min内的反应速率是 。
③判断该反应达到化学平衡状态的标志是 (填字母)。
a.A和B浓度相等
b.A百分含量保持不变
c.A的生成速率与B的消耗速率相同
d.容器中气体的压强不变
e.容器中混合气体的密度保持不变
(2)已知断开1molH2中的化学键需吸收436kJ的热量,断开1molCl2中的化学键需吸收243kJ的热量,而形成1molHCl分子中的化学键释放431kJ的热量,试写出H2在Cl2中燃烧的热化学反应方程式 。
14.利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有 (填化学式)。
(2)将X与Y混合,可生成淡黄色固体,该反应中氧化剂与还原剂的物质的量之比为 。
(3) Z的浓溶液与铜单质在一定条件 下可以发生化学反应,该反应的化学方程式为 。
(4) Na2S2O3是重要的化工原料。从氧化还原反应的角度分析, 下列制备Na2S2O3的方案理论上可行的
是 (填字母)。
a.Na2S+S b. Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+ Na2SO4
(5) 2SO2(g) +O2(g) 2SO3(g),是工业制硫酸的主要反应之一,研究该反应的速率和限度有着重要的现实意义。一定条件下, 在2L的密闭容器中加入4molSO2(g)、6molO2(g)和 2molSO3(g),在2min末达到平衡,测得n(SO3)=4mol。
①0~2min时间段的化学反应速率为v(SO2)= 。
②2min末c(O2)= mol/L。
③关于2SO2(g) +O2(g) 2SO3(g)反应,下列说法正确的是 。
A.增大氧气的浓度可提高反应速率
B.升高温度可提高反应速率
C.使用催化剂能显著增大反应速率
D.通入过量的氧气可以实现SO2的完全转化
15.按要求完成下列问题。
(1)为了提高煤的利用率,常将其气化为可燃性气体,主要反应是碳和水蒸气反应生成水煤气,其中还原剂是 。
(2)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:N2(g)+3H2(g)2NH3(g)。
①合成氨的反应中的能量变化如图所示。该反应是 反应(填“吸热”或“放热”),其原因是反应物化学键断裂吸收的总能量 (填“大于”或“小于”)生成物化学键形成放出的总能量。
②在一定条件下,将一定量的N2和H2的混合气体充入某密闭容器中,一段时间后,下列叙述能说明该反应达到平衡状态的是 (填序号)。
a.容器中N2、H2、NH3共存 b.N2、H2、NH3的物质的量之比为1:3:2
c.容器中的压强不随时间变化 d.N2、NH3浓度相等
(3)工业上用电解饱和食盐水的方法制取氯气、烧碱和氢气。其化学反应方程式为 。
(4)下列各反应中,符合如图所示能量变化的是 (填序号)。
a.H2和Cl2的反应 b.Al和盐酸的反应 c.Na和H2O的反应 d.Ba(OH)2·8H2O和NH4C1的反应
(5)海水资源前景广阔。
①列举一种海水淡化的方法 。
②采用空气吹出法从海水中提取溴的过程中,吸收剂SO2和溴蒸气反应生成氢溴酸以达到富集的目的,该反应的离子方程式为 。
16.反应2HI(g)H2(g)+I2(g) △H=Q,在4种不同条件下进行,已知起始时I2与H2的物质的量为0,反应物HI的浓度(mol/L)随反应时间(min)的变化情况如下表所示:
(1)实验1中,反应在0〜10 min内平均速率v(HI)为 mol·L-1·min-1。仔细分析上表数据可推知Q 0 (填“>”“”“”或“ 1.0或1 < 1.2
17. 不变 Fe3O4+H23FeO+H2O < 100% BCD 温度过高,CO2的转化率较低;温度过低,反应的速率较慢
18.(1) 2 0.2 mol/(L·min)
(2)K==4
(3) 50% C
19.(1) 三
(2)4
(3)>
(4)CE
(5) 0.023 87 8
20.1:3:2
21.(1)、
(2)
(3)
(4) 30 10 17.5 暗红 当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积
22.(1) ② ① K+、Cl-均不参与反应,故加入KCl固体对此平衡无影响
(2)+5H2C2O4+6H+=2Mn2++8H2O+10CO2↑
(3) 3.0 4.0
(4)0.01 mol/(L•min)
(5)反应生成的Mn2+起催化作用
(6)B
23. 浓度 褪色 乙 反应物浓度越大,速率越大 2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O 2MnO+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O = 2×10-4
相关试卷
这是一份鲁科版 (2019)选择性必修1第2章 化学反应的方向、 限度与速率第3节 化学反应的速率测试题,共38页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
这是一份高中化学鲁科版 (2019)选择性必修1第4节 离子反应达标测试,共13页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
这是一份高中化学鲁科版 (2019)选择性必修1第3节 化学反应的速率课后复习题,共16页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。









