



初中化学鲁教版 (五四制)八年级全册第一节 原子的构成授课课件ppt
展开与原子相比,原子核的体积非常小,这就意味着原子核外有一个很大的空间,电子在这个空间里作高速的运动。那么,电子在原子核外又是如何运动的呢?
原子内的多个电子在运动过程中会发生碰撞吗?
1.知道原子核外电子的排布规律2.了解离子的概念及离子的形成过程,认识离子是构成物质的一种微粒,会写常见的离子符号。
原子核外电子的排布与元素化学性质的关系
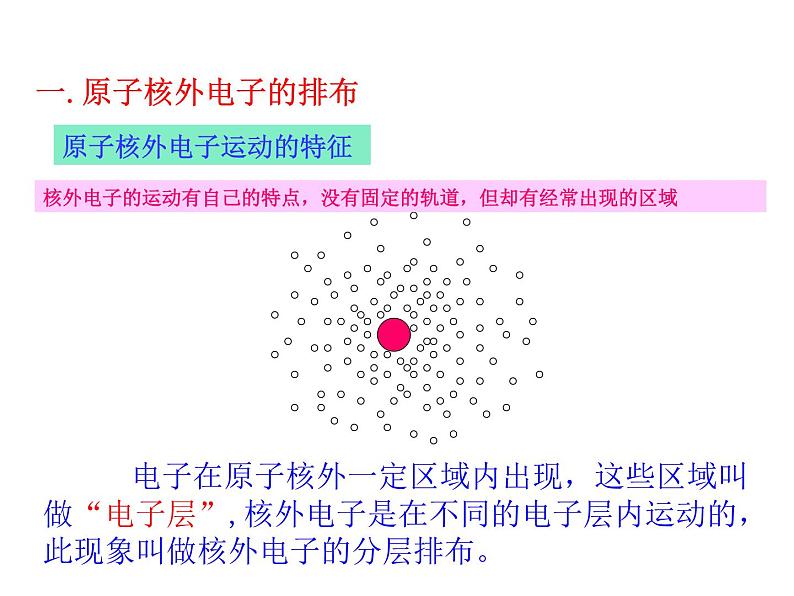
电子在原子核外一定区域内出现,这些区域叫做“电子层”,核外电子是在不同的电子层内运动的,此现象叫做核外电子的分层排布。
核外电子的运动有自己的特点,没有固定的轨道,但却有经常出现的区域
原子核外电子运动的特征
一.原子核外电子的排布
1.分层排布(高速运动)
思考:如何直观、形象地表示电子的分层排布呢?
电子层 离核远近 能量高低
一 二 三 四 五 六 七
低 高
近 远
2、原子结构示意图的意义
电子层
2 8 4
3、三类元素原子结构特点(1) 金属元素的原子最外层电子数一般少于 4 个( H、He、B 除外)。(2) 非金属元素的原子最外层电子数一般等于或多于4 个。 (3) 稀有气体元素的原子最外层电子数一般等于 8 个(He 为 2 个)。
按照规律,写出从 1 到 18 号元素的原子结构示意图,你能从中总结出什么规律?
物质都有趋向于稳定状态的特点(如:水往低处流,树上的苹果往下掉等现象)。原子也不例外,同样也有趋向于稳定结构的特点。那么,什么样的结构才是原子的稳定结构呢?
稳定结构:像稀有气体元素原子这样的结构叫 8个电子的稳定结构。若只有一个电子层,则 2 个电子也是稳定结构(如:He)。
原子的最外层电子数决定原子的化学性质。
通过讨论,你来归纳一下
既不得电子,也不失电子
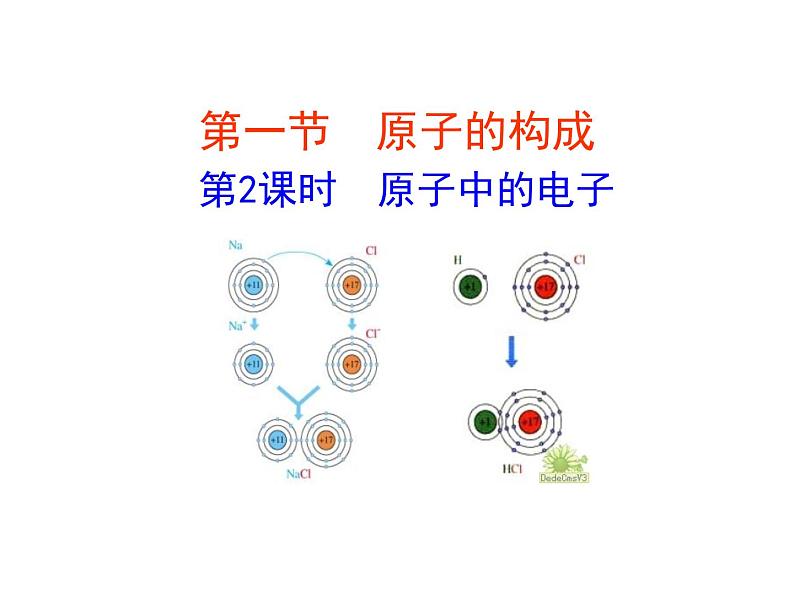
1、离子的形成原子失去电子后变成带正电荷的阳离子,原子得到电子后变成带负电荷的阴离子。
在化学反应中,原子核是不变的,发生改变的只是核外电子。
因得失电子而带电荷的原子(或原子团)叫离子。
阳离子(带正电荷)如Na+钠离子
阴离子(带负电荷)如Cl-氯离子
离子符号右上角的数字表示离子所带的电荷数,正负号表示离子所带电荷的电性。
每个镁离子带2个单位的正电荷
表示2个镁离子(镁离子的个数)
5、原子和离子的区别和联系
构成物质的基本粒子——分子、原子、离子有何异同?它们之间有什么关系?相同点:不同点:相互关系:
质量和体积都很小,总在不停地运动,相互间有间隔;同种粒子性质相同,不同种粒子性质不同等。
在化学变化中,分子可分,原子不可分;分子、原子不显电性,离子带电等。
分子由原子构成;原子和离子通过得失电子相互转化等。
原子核外电子是分层排布的
原子的结构可以用原子结构示意图表示
原子的核外电子排布,特别是最外层的电子数目,跟原子的化学性质有密切关系
原子通过得失电子达到8电子的稳定结构——离子
【典例1】如图是硫原子的结构示意图,下列由图中获取的信息错误的是( )A. 硫原子的核电荷数为16B.第三层上的电子能量比第一层上电子能量低C. 硫原子的结构示意图中的x等于8D. 硫原子在化学反应中易失去电子
知识点一、核外电子的排布
【典例2】汤姆森发现电子,卢瑟福积极探索原子内部结构,门捷列夫列出了第一张元素周期表,徐寿为大量化学元素创造汉语名称……许许多多科学家为理论化学研究做出了巨大贡献,推开了物质微观世界之门下列有关说法错误的是( )A.固态水的分子在不停地运动 B.氯化钠是由Na+和Cl-构成C.氧原子结构示意图为D.镓原子结构如图,易形成带3个正电荷的阳离子
1.原子在化学变化中不可能转化成以下哪种粒子( )A.带正电荷的离子B.新的分子C.带负电荷的离子D.新的原子
2. 下列是几种微粒的结构示意图,有关说法错误的是( ) A.微粒①易得到电子 B.微粒②和④核外电子排布相同,都属于原子 C.微粒③易形成阳离子 D.微粒④带两个单位正电荷
鲁教版 (五四制)八年级全册第一节 原子的构成评课课件ppt: 这是一份鲁教版 (五四制)八年级全册第一节 原子的构成评课课件ppt,文件包含第1课时原子的结构原子质量的计量ppt、卢瑟福α粒子散射实验wmv、原子构成的描述mp4等3份课件配套教学资源,其中PPT共34页, 欢迎下载使用。
化学九年级上册第三节 原子的构成说课课件ppt: 这是一份化学九年级上册第三节 原子的构成说课课件ppt,共22页。PPT课件主要包含了你造吗,原子结构示意图,Mg2+,阳离子等内容,欢迎下载使用。
化学八年级全册第三单元 物质构成的奥秘第一节 原子的构成多媒体教学课件ppt: 这是一份化学八年级全册第三单元 物质构成的奥秘第一节 原子的构成多媒体教学课件ppt,文件包含第2课时原子中的电子ppt、氯化钠的形成swf等2份课件配套教学资源,其中PPT共20页, 欢迎下载使用。













