

鲁科版 (2019)必修 第一册第2节 电解质的电离 离子反应同步达标检测题
展开
这是一份鲁科版 (2019)必修 第一册第2节 电解质的电离 离子反应同步达标检测题,共13页。试卷主要包含了单选题,实验题,工业流程题等内容,欢迎下载使用。
2.2电解质的电离——离子反应同步练习
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.某化学小组设计实验方案,探究镁单质与碳酸氢钠溶液的反应。实验步骤如下:
①用稀硫酸将一根镁条充分浸泡一段时间,取出镁条并洗涤;
②然后将洗涤干净的镁条插入碳酸氢钠溶液中,发现铁条表面产生大量气泡,并产生白色沉淀;
③取出镁条后,……
④将沉淀转移到试管中,并加入……,沉淀溶解,并产生气泡。
确定沉淀的组成时,可充分灼烧一定质量的沉淀,下列哪个选项可通过计算确定
A.和 B.和
C.和 D.和
2.在甲、乙两烧杯溶液中,分别含有大量的Cu2+、K+、H+、Cl-、 、OH-中的三种,已知甲烧杯的溶液呈蓝色,则乙烧杯的溶液中大量存在的离子是
A.Cu2+、H+、Cl- B.Cl-、、OH-
C.K+、、OH- D.K+、H+、Cl-
3.下列离子方程式书写正确的是
A.浓硝酸中加入铜片: Cu+4HNO3(浓)= Cu2++2NO+2NO2↑+2H2O
B.已知氧化性:Cl2>Br2>Fe3+向FeBr2溶液(含溶质a mol)中通入a mol氯气:2Fe2++2Br−+2Cl2=2Fe3++Br2+4Cl−
C.用稀硫酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO+6H++7H2O2=2Mn2++6O2↑+10H2O
D.工业印刷电路板废液中加入足量铁粉先发生的反应:Fe3++Fe=2Fe2+
4.下列反应的离子方程式书写正确的是
A.制备胶体:
B.铁与稀盐酸:
C.溶液与少量溶液反应:
D.过氧化氢使酸性高锰酸钾溶液褪色:
5.下列反应的离子方程式书写正确的是
A.溶液与NaOH溶液:
B.与KOH溶液:
C.稀硫酸与溶液:Ba2++SO=BaSO4↓
D.Fe与稀硝酸:
6.宏观辨识与微观探析是化学学科核心素养之一,下列离子方程式能正确解释相应事实的是
A.向溶液中滴加过量的氨水:
B.用过量的热烧碱溶液检验中的:
C.在强碱溶液中次氯酸钠与反应生成:
D.用溶液检验亚铁离子:
7.室温下,下列各组离子在指定溶液中一定能大量共存的是
A.的溶液:
B.溶液:
C.的溶液:
D.的溶液:
8.下列化学用语表示不正确的是
A.中用核素符号表示为
B.用电子式表示氯化钠的形成过程:
C.的电离方程式:
D.氯化铵的电子式:
9.下列离子方程式书写正确的是
A.少量金属钠投入冷水中:
B.铜与稀硝酸反应:
C.向溶液中加过量的溶液并加热:
D.向溶液中滴加稀盐酸:
10.下列离子方程式书写错误的是
A.向溶液中通入过量的CO2:
B.向溶液中加入铁片:
C.金属钠加入水中:
D.NaHSO4溶液与少量溶液混合:
11.将足量的不断通入NaOH、、的混合溶液中,生成沉淀的物质的量与通入的体积的关系可表示为
A. B.
C. D.
12.某锂离子电池的正极材料为、碳粉及铝箔,某化学兴趣小组设计下列室温下的流程处理废旧锂离子电池的正极材料,下列离子反应方程式书写不正确的是
A.加入过量NaOH溶液:
B.被氧化:
C.滤液Ⅱ加入饱和碳酸钠溶液:
D.滤液Ⅰ加入过量:;
13.下列反应的离子方程式,表达错误的是
A.把高氯酸()滴入过量溶液中:
B.石灰岩的溶蚀作用:
C.过氧化钠转化为烧碱:
D.少量溶液与溶液混合:
14.某溶液中可能含有如下离子:、、、、、(不考虑水的电离)。当向该溶液中逐滴加入NaOH溶液时,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示,下列说法正确的是
A.原溶液中一定含有的阳离子是、、、
B.原溶液中含有的阴离子是、
C.原溶液中
D.反应最后形成的溶液中的溶质只含NaCl和
15.下列离子方程式书写正确的是
A.在溶液中滴入溶液至恰好中和:
B.溶液腐蚀印刷电路铜板:
C.向溶液中滴入少量澄清石灰水:
D.醋酸腐蚀大理石台面:
二、实验题
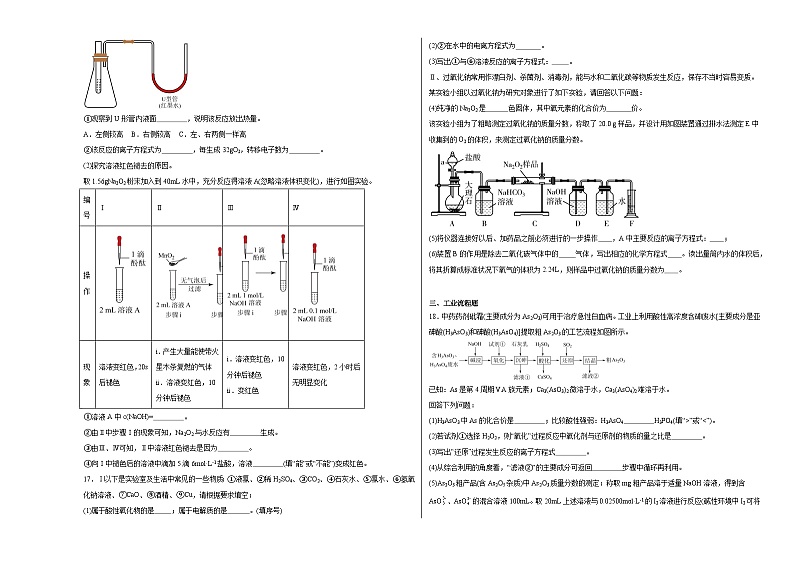
16.某化学兴趣小组学习Na2O2的性质后,进行过氧化钠与水反应的探究实验。
(1)探究该反应的热效应。
实验装置如图所示,调节U形管内两侧液面相平,向试管中加入agNa2O2粉末,再滴加10mL蒸馏水及2~3滴酚酞试液,试管内产生大量气泡,溶液先变红后褪色。
①观察到U形管内液面 ,说明该反应放出热量。
A.左侧较高 B.右侧较高 C.左、右两侧一样高
②该反应的离子方程式为 ,每生成32gO2,转移电子数为 。
(2)探究溶液红色褪去的原因。
取1.56gNa2O2粉末加入到40mL水中,充分反应得溶液A(忽略溶液体积变化),进行如图实验。
编号
Ⅰ
Ⅱ
Ⅲ
Ⅳ
操作
现象
溶液变红色,20s后褪色
i.产生大量能使带火星木条复燃的气体
ii.溶液变红色,10分钟后褪色
i.溶液变红色,10分钟后褪色
ii.变红色
溶液变红色,2小时后无明显变化
①溶液A中c(NaOH)= 。
②由Ⅱ中步骤Ⅰ的现象可知,Na2O2与水反应有 生成。
③由Ⅲ、Ⅳ可知,Ⅱ中溶液红色褪去是因为 。
④向Ⅰ中褪色后的溶液中滴加5滴6mol·L-1盐酸,溶液 (填“能”或“不能”)变成红色。
17.Ⅰ以下是实验室及生活中常见的一些物质:①液氯、②稀H2SO4、③CO2、④石灰水、⑤氯水、⑥氢氧化钠溶液、⑦CaO、⑧酒精、⑨Cu,请根据要求填空:
(1)属于酸性氧化物的是 ;属于电解质的是 。(填序号)
(2)②在水中的电离方程式为 。
(3)写出①与⑥溶液反应的离子方程式: 。
Ⅱ、过氧化钠常用作漂白剂、杀菌剂、消毒剂,能与水和二氧化碳等物质发生反应,保存不当时容易变质。某实验小组以过氧化钠为研究对象进行了如下实验,请回答以下问题:
(4)纯净的Na2O2是 色固体,其中氧元素的化合价为 价。
该实验小组为了粗略测定过氧化钠的质量分数,称取了20.0 g样品,并设计用如图装置通过排水法测定E中收集到的O2的体积,来测定过氧化钠的质量分数。
(5)将仪器连接好以后、加药品之前必须进行的一步操作 ,A中主要反应的离子方程式: ;
(6)装置B的作用是除去二氧化碳气体中的 气体,写出相应的化学方程式 。读出量筒内水的体积后,将其折算成标准状况下氧气的体积为2.24L,则样品中过氧化钠的质量分数为 。
三、工业流程题
18.中药药剂砒霜(主要成分为As2O3)可用于治疗急性白血病。工业上利用酸性高浓度含砷废水[主要成分是亚砷酸(H3AsO3)和砷酸(H3AsO4)]提取粗As2O3的工艺流程如图所示。
已知:As是第4周期ⅤA族元素;Ca3(AsO3)2微溶于水,Ca3(AsO4)2难溶于水。
回答下列问题:
(1)H3AsO3中As的化合价是 ;比较酸性强弱:H3AsO4 H3PO4(填“>”或“Br->Cl-,向FeBr2溶液(含溶质a mol)中通入a mol氯气,反应的离子方程式为:2Fe2++2Br−+2Cl2=2Fe3++Br2+4Cl−,B正确;
C.用稀硫酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性,离子方程式为:,C错误;
D.工业印刷电路板废液中有,加入足量铁粉先发生的反应为:Fe3++Fe=2Fe2+、,D错误;
故选B。
4.C
【详解】A.向沸水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:,故A错误;
B.铁与稀盐酸反应生成氯化亚铁和氢气,反应的离子方程式为:Fe+2H+=Fe2++H2↑,故B错误;
C.Ca(HCO3)2溶液与少量NaOH溶液反应,离子方程式:,故C正确;
D.过氧化氢使酸性高锰酸钾溶液褪色,离子方程式为:5H2O2+2+6H+=2Mn2++16H2O+5O2↑,故D错误;
故选:C。
5.A
【详解】A.氯化铵与氢氧化钠都是强电解质,拆成离子,铵根离子与氢氧根离子生成弱电解质一水和氨,故A方程式正确;
B.CH3COOH是弱电解质,不能拆成离子,正确的方程式为CH3COOH+OH-=CH3COO-+H2O故B错误;
C.硫酸和氢氧化钡除生成沉淀外,还有水生成,漏掉了离子反应,正确的应该是故C错误;
D.铁与稀硝酸反应不生成氢气,方程式应该是 故D错误;
答案选A。
6.D
【详解】A.向硫酸铜溶液中滴加过量氨水会生成四氨合铜离子,方程式为:,A错误;
B.碳酸氢根与氢氧根离子也会反应,因此反应的方程式为:,B错误;
C.在强碱溶液中不会生成氢离子,因此反应的方程式为:,C错误;
D.在溶液中是沉淀,所以不能拆,因此反应的方程式为:,D正确;
故选D。
7.B
【详解】A.含H+溶液呈酸性, 在酸性条件下有氧化性,能将Fe2+氧化Fe3+,A错误;
B.0.1mol⋅L−1Na2SO4溶液中,Cu2+、Mg2+、Cl−、各种离子互不反应,B正确;
C.溶液中的与Ba2+产生沉淀BaCO3,不能共存,C错误;
D.溶液中的OH-与反应生成,与Ca2+继续反应生成沉淀CaCO3,D错误;
故答案为:B。
8.D
【详解】A.Cf和Ca质量数总和为297,核电荷数总和为118,则0g的质量数为297-3=294,核电荷数为118,0g用核素符号表示为,A正确;
B.Na和Cl2反应生成NaCl的过程中,Cl得到一个电子生成氯离子,钠失去一个电子生成钠离子,用电子式表示氯化钠的形成过程为,B正确;
C.碳酸氢钠电离生成钠离子和碳酸氢根离子,电离方程式为,C正确;
D.氯化铵的电子式为,D错误;
故答案选D。
9.B
【详解】A.少量金属钠投入冷水中反应生成氢氧化钠和氢气,离子方程式为:,A错误;
B.铜与稀硝酸反应,生成硝酸铜、一氧化氮气体和水,离子方程式为:,B正确;
C.向NH4HCO3溶液中加过量的NaOH溶液并加热,离子方程式为:HCO+NH+OH-NH3↑+2H2O+ CO,C错误;
D.向Na2SiO3溶液中滴加稀盐酸:二者反应产生NaCl、H2SiO3沉淀,离子方程式为:2H++=H2SiO3↓,D错误;
故选B。
10.D
【详解】A.过量时,会生成,根据强酸制弱酸原理,向溶液中通入过量的CO2发生反应的离子方程式为:,A正确;
B.具有强氧化性,具有强还原性,向溶液中加入铁片,会发生归中反应,反应的离子方程式为:,B正确;
C.金属钠非常活泼,能与水剧烈反应,钠加入水中发生反应的离子方程式为:,C正确;
D.NaHSO4溶液与少量溶液混合,完全反应,反应的离子方程式为:,D错误;
故选D。
11.C
【详解】足量的不断通入、、的混合溶液中,先与反应生成沉淀,再与反应,生成沉淀,再和反应生成沉淀,继续通入,与反应生成,最后与反应生成,沉淀部分溶解,符合题意的为C选项;故选C。
12.B
【分析】由流程可知,铝溶于过量氢氧化钠溶液反应生成偏铝酸钠,LiMn2O4,碳粉不溶于水,过滤后滤液Ⅰ为偏铝酸钠溶液和过量的氢氧化钠,加入过量二氧化碳发生反应和,LiMn2O4在酸性环境下能被氧气氧化,发生反应4LiMn2O4+O2+4H+=4Li++8MnO2+2H2O,过滤分离出二氧化锰、C,滤液中含硫酸锂,可能有过量的硫酸,滤液中加入碳酸钠生成碳酸锂。
【详解】A.加入过量NaOH溶液,与铝反应生成偏铝酸钠和氢气,离子方程式为 ,故A项正确;
B.在酸性环境下,LiMn2O4能被氧气氧化,离子方程式为:4 LiMn2O4+O2+4H+=4Li++8MnO2+2H2O,故B项错误;
C.滤液Ⅱ加入饱和碳酸钠溶液,生成碳酸锂沉淀,离子方程式为,故C项正确;
D.滤液Ⅰ含有氢氧化钠和偏铝酸钠,通入过量二氧化碳,分别发生、,故D项正确;
答案选B。
13.C
【详解】A.高氯酸HClO4为强酸,与碳酸钠反应分为两步:,由于碳酸钠过量,所以只发生第一步反应:,故A正确;
B.石灰岩的溶蚀过程是碳酸钙与二氧化碳、水反应的过程,离子方程式为:,故B正确;
C.过氧化钠转化为烧碱,过氧化钠为氧化物,不能拆成离子形式,应为:故C错误;
D.溶液电离出的OH-与溶液电离出的反应生成与H2O,Ba2+与生成BaCO3沉淀,由于为少量,所以离子方程式为:,故D正确;
故选C。
14.C
【分析】根据图像,所加入的NaOH的量为0-2mL时候没有沉淀生成说明溶液中含有氢离子,接下来生成沉淀,并且沉淀最终完全溶解,说明生成的沉淀为氢氧化铝,则溶液中一定有铝离子,一定没有镁离子和偏铝酸根,NaOH的体积为5-8mL的时候加入碱没有沉淀生成,则溶液中含有铵根,根据电荷守恒,溶液中需要有阴离子氯离子,综合可知溶液中肯定含有、、和,肯定不存在和,以此分析;
【详解】A.根据分析,溶液中肯定含有的阳离子为,、、,A错误;
B.根据分析,溶液中肯定含有的阴离子为,B错误;
C.结合图像中的数量关系可得,C正确;
D.反应到最后溶液中的溶质为、和,D错误;
故答案为:C。
15.A
【详解】A.在溶液中滴入溶液至恰好中和:,A正确;
B.溶液腐蚀印刷电路铜板,离子方程式为:,B错误;
C.向溶液中滴入少量澄清石灰水,离子方程式为:,C错误;
D.醋酸腐蚀大理石台面,离子方程式为:2CH3COOH+CaCO3=Ca2++CO2+H2O+2CHCOO-,D错误;
故选A。
16.(1) 右侧较高 2Na2O2+2H2O=4Na++4OH−+O2↑ 2NA
(2) 1mol/L 过氧化氢或H2O2 c(OH- )大 不能
【分析】探究过氧化钠中加入水和酚酞出现褪色的原因,可以从题给信息结合计算,从两个角度探究原因、找到解题的切入口:一是物质的漂白性,二是氢氧根离子的浓度大小。
【详解】(1)①若反应放热,锥形瓶中气体的压强增大,会导致U形管内液面左低右高,观察到U形管内液面右侧较高,说明该反应为放热反应,故答案为右侧较高;
②32gO2的物质的量为1mol,过氧化钠与水反应生成氢氧化钠和氧气,离子方程式为:2Na2O2+2H2O=4Na++4OH−+O2↑,反应中Na2O2既是氧化剂,又是还原剂,则生成1mol氧气转移电子数为2NA,故答案为2Na2O2+2H2O=4Na++4OH−+O2↑;2NA。
(2)①取1.56g Na2O2粉末加入到40mL水中,充分反应得溶液A(忽略溶液体积变化),发生反应2Na2O2+2H2O=4Na++4OH−+O2↑,1.56g Na2O2粉末产生的氢氧化钠的物质的量为,氢氧化钠的浓度为,故答案为1mol/L;
②由Ⅱ中步骤i的现象可知,溶液A中加入二氧化锰产生大量能使带火星木条复燃的气体为氧气,说明溶液中含过氧化氢;答案为过氧化氢或H2O2;
③由Ⅲ、Ⅳ可知,在碱溶液中酚酞变红色和氢氧根离子浓度有关,1mol/L的氢氧化钠溶液中滴入酚酞溶液变红色,10分钟后溶液褪色,再滴入盐酸反应后氢氧根离子浓度减小,溶液变红色,说明Ⅱ中溶液红色褪去是因为c(OH- )大;
④Ⅰ中溶液红色褪去的主要原因是生成的过氧化氢具有氧化性,把有色物质氧化为无色物质,向Ⅰ中褪色后的溶液中滴加5滴6mol·L-1盐酸,溶液最终不能变成红色。
【点睛】本题考查了探究实验的相关内容,掌握相关物质的性质以及是解答关键。
17.(1) ③ ⑦
(2)H2SO4=2H++
(3)Cl2+2OH-=Cl-+ClO-+H2O
(4) 淡黄 -1
(5) 检验装置的气密性 CaCO3+2H+=Ca2++H2O+CO2↑
(6) HCl NaHCO3+HCl=NaCl+H2O+CO2↑ 78%
【详解】(1)根据酸性氧化物性质及组成可知,酸性氧化物为CO2;电解质为在水溶液或熔融状态下导电的化合物,故CaO为电解质,
故答案为:③ ;⑦;
(2)硫酸为强电解质,故电离式为:H2SO4=2H++
故答案为:H2SO4=2H++;
(3)Cl2溶于强碱2中,离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(4)纯净的Na2O2是淡黄色固体,其中氧元素的化合价为+1价;
故答案为:淡黄;-1;
(5)①实验探究测定方法是测定二氧化碳和过氧化钠反应生成的氧气,装置中必须是气密性完好,将仪器连接好以后,必须进行的第一步操作是检查装置的气密性;A中发生反应是碳酸钙和盐酸反应生成二氧化碳、水和氯化钙,反应的离子方程式为:CaCO3+2H+=Ca2++H2O+CO2↑,
故答案为:检查装置的气密性;CaCO3+2H+=Ca2++H2O+CO2↑;
(6)②B为洗气装置,A中反应生成的二氧化碳混有HCl气体,可以通过B中的饱和碳酸氢钠溶液除去,化学方程式为:NaHCO3+HCl=NaCl+H2O+CO2↑;测定出量筒内水的体积后,折算成标准状况下氧气的体积为2.24L,物质的量= =0.1mol,则样品中过氧化钠的质量分数为=×100%=78%;
故答案为:HCl;NaHCO3+HCl=NaCl+H2O+CO2↑;78%。
18.(1) +3价 <
(2)1∶1
(3)2H3AsO4+2SO2=2+As2O3+H2O+4H+
(4)酸化
(5)19.8/m
【分析】酸性高浓度含砷废水加入NaOH溶液生成Na3AsO3、Na3AsO4,加入过氧化氢等氧化剂,Na3AsO3被氧化生成Na3AsO4,然后加入石灰乳分离出Ca3(AsO4)2沉淀,加入硫酸酸化溶解同时将钙转化为硫酸钙沉淀,过滤滤液加入二氧化硫,SO2与Na3AsO4在酸性条件下发生氧化还原反应生成As2O3;
【详解】(1)H3AsO3中氢氧化合价分别为+1、-2,则As的化合价是+3;非金属性越强,最高价氧化物对应水化物的酸性越强,则酸性强弱:H3AsO4
相关试卷
这是一份鲁科版 (2019)必修 第一册第2节 电解质的电离 离子反应课时练习,共21页。试卷主要包含了单选题,填空题,实验探究题等内容,欢迎下载使用。
这是一份鲁科版 (2019)必修 第一册第2章 元素与物质世界第2节 电解质的电离 离子反应一课一练,共14页。试卷主要包含了是否符合事实;,符号使用是否正确;,是否漏掉离子反应;,反应物或产物的配比是否正确等内容,欢迎下载使用。
这是一份鲁科版 (2019)必修 第一册第2节 电解质的电离 离子反应课时作业,共24页。试卷主要包含了单选题,填空题,实验探究题等内容,欢迎下载使用。










