

化学鲁科版 (2019)第2节 化学能转化为电能——电池当堂检测题
展开
这是一份化学鲁科版 (2019)第2节 化学能转化为电能——电池当堂检测题,共16页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
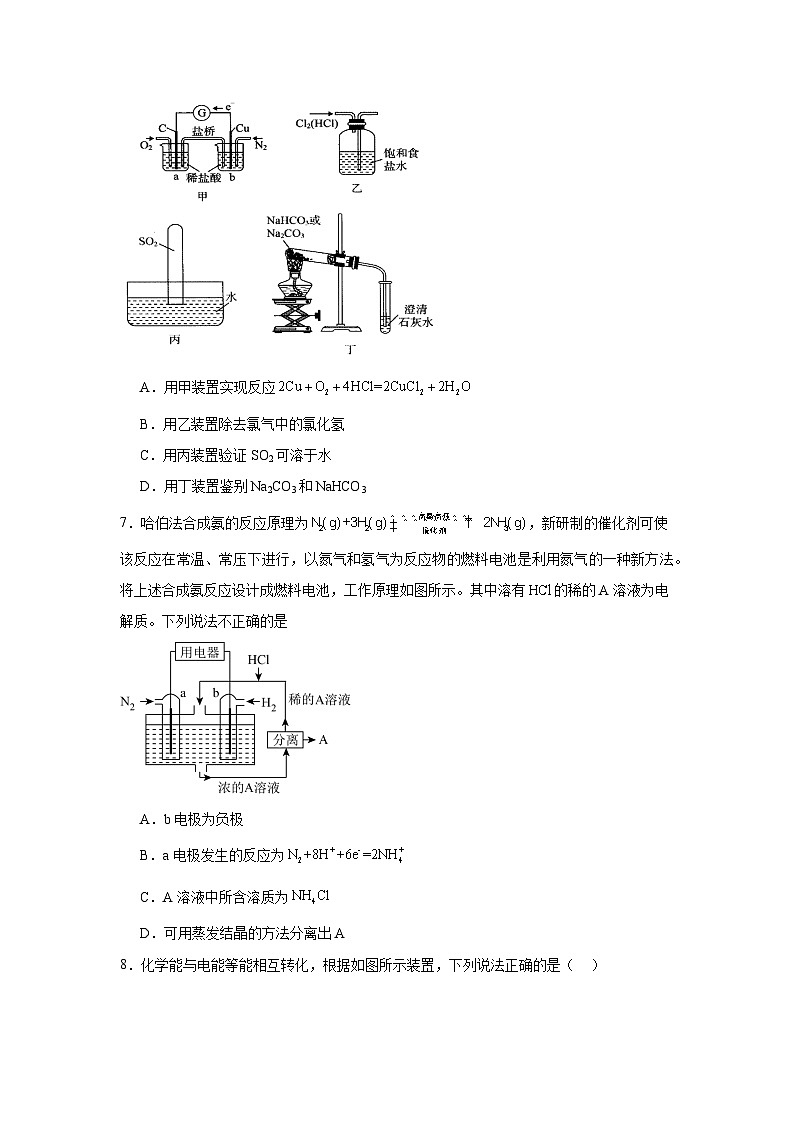
1.2化学能转化为电能——电池同步练习-鲁科版高中化学选择性必修1学校:___________姓名:___________班级:___________考号:___________ 一、单选题1.某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2 转变为H2、CO。其过程如下:mCeO2(m-x)CeO2·xCe+xO2(m-x)CeO2·xCe+xH2O+xCO2mCeO2+xH2+xCO下列说法不正确的是A.该过程中CeO2为H2O、CO2 转变为H2、CO的催化剂B.该过程实现了太阳能向化学能的转化C.1mol CeO2参加反应,共生成2xmol的气体D.以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH--2e-=CO+2H2O2.通过CO传感器可监测CO的含量,总反应为2K2FeO4+3CO+2KOH+2H2O=2Fe(OH)3+3K2CO3,其工作原理示意图如下,下列说法正确的是A.电极为负极,可以用Fe电极代替B.工作时OH-向K2FeO4电极移动C.每转化3molCO,有2molK2FeO4被氧化D.K2FeO4电极上的电极反应式是2FeO42-+8H2O+6e-=2Fe(OH)3↓+10OH-3.微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示,质子交换膜只允许质子和水通过。下列有关微生物电池的说法不正确的是A.微生物促进了反应中电子的转移B.正极反应中有生成C.质子通过交换膜从负极区移向正极区D.正极的电极反应式为4.研究人员最近发明了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl。下列“水”电池在海水中放电时的有关说法不正确的是( )A.“水”电池的负极是Ag,AgCl是氧化产物B.正极反应为5MnO2+2e-+2NaCl=Na2Mn5O10+2Cl-C.每生成1molNa2Mn5O10,转移2mol电子D.“水”电池工作时,Na+往MnO2电极方向移动5.下列反应原理不能设计成原电池的是A.Zn+2H+=Zn2++H2↑B.2Fe3++Fe=3Fe2+C.2Al+2OH-+2H2O =2AlO+3 H2↑D.Cu+2H+=Cu2++H2↑6.利用下列装置进行实验,不能达到实验目的的是A.用甲装置实现反应B.用乙装置除去氯气中的氯化氢C.用丙装置验证SO2可溶于水D.用丁装置鉴别Na2CO3和NaHCO37.哈伯法合成氨的反应原理为,新研制的催化剂可使该反应在常温、常压下进行,以氮气和氢气为反应物的燃料电池是利用氮气的一种新方法。将上述合成氨反应设计成燃料电池,工作原理如图所示。其中溶有的稀的A溶液为电解质。下列说法不正确的是A.b电极为负极B.a电极发生的反应为C.A溶液中所含溶质为D.可用蒸发结晶的方法分离出A8.化学能与电能等能相互转化,根据如图所示装置,下列说法正确的是( )A.图1、图2都能将化学能转化为电能B.图1中锌、铜都溶解C.图2中铁失去电子,石墨得到电子D.图2中铁作负极,电极反应为Fe-2e-=Fe2+9.燃料电池是一种高效:环境友好的发电装置。下图为氢氧燃料电池示意图,下列有关说法错误的是A.该电池工作时可将化学能转化为电能B.电池工作时,电子从电极b移向电极aC.负极的电极反应式为D.电池总反应的化学方程式为10.锌-空气电池适宜用作城市电动车的动力电源,原理如图。该电池放电时Zn转化为ZnO。以下说法正确的是A.氧气在石墨电极上发生氧化反应B.负极反应:Zn+H2O-2e-→ZnO+2H+C.OH-向石墨电极移动D.电子从Zn电极经导线流向石墨电极 二、填空题11.载人航天工程对科学研究及太空资源开发具有重要意义,其发展水平是衡量一个国家综合国力的重要指标。中国正在逐步建立自己的载人空间站“天宫”,神舟十三号载人飞船在北京时间10月16日0时23分点火发射,又一次正式踏上飞向浩渺星辰的征途。(1)氢氧燃料电池(构造示意图如图)单位质量输出电能较高,反应生成的水可作为航天员的饮用水,氧气可以作为备用氧源供给航天员呼吸。由此判断X极为电池的 极,OH-向 (填“正”或“负”)极作定向移动,Y极的电极反应式为 。(2)在宇宙飞船或潜艇中,还可利用氢氧燃料电池所产生的水作为饮用水,今欲得常温下1L水,则电池内电子转移的物质的量约为 mol(保留整数)(3)“神舟”飞船的电源系统共有3种,分别是太阳能电池帆板、镉镍蓄电池和应急电池。①飞船在光照区运行时,太阳能电池帆板将 能转化为电能,除供给飞船使用外,多余部分用镉镍蓄电池储存起来。其工作原理为:Cd+2NiOOH+2H2OCd(OH)2+2Ni(OH)2,充电时,阳极的电极反应式为 ;当飞船运行到地影区时,镉镍蓄电池开始为飞船供电,此时负极附近溶液的碱性 (填“增大”“减小”或“不变”)。②紧急状况下,应急电池会自动启动,工作原理为Zn+Ag2O+H2O2Ag+Zn(OH)2,其负极的电极反应式为 。12.燃料电池的正、负两极必须是两种活泼性不同的金属或一种金属与一种导电的非金属吗? 13.原电池的基本工作原理是 和 分别在两个不同的区域发生氧化反应和还原反应,并通过 形成闭合回路产生电流。其中, 在负极上 电子,是负极反应物; 在正极上 电子,是正极反应物;电极材料(如石墨电极)通常是 。此外,还要有能传导电荷的 作为离子导体;而导线则作为 ,起到传导电子形成闭合回路的作用。14.铝是最常见的金属之一。(1)浓硝酸、浓硫酸可贮存在铝制容器的原因是 。(2)纳米铝主要应用于火箭推进剂。工业上利用无水氯化铝与氢化铝锂(LiAlH4)在有机溶剂中反应制得纳米铝,化学方程式如下:3LiAlH4+AlCl3=4Al+3LiCl+6H2↑,该反应的氧化剂为 。(3)氢化铝钠(NaAlH4)是一种重要的储氢材料,已知:NaAlH4(s)=Na3AlH6 (s)+Al (s) + H2(g) ΔH=+ 37 kJ·mol-1Na3AlH6(s)=3NaH(s)+Al (s) +H2(g) ΔH=+ 70.5 kJ·mol-1则NaAlH4(s)=NaH(s)+Al (s) +H2(g) ΔH= 。(4)已知H2O2是一种弱酸,在强碱性溶液中主要以HO形式存在。目前研究比较热门的Al-H2O2燃料电池,其原理如图所示,电池总反应如下:2Al+3HO+3H2O =2[Al(OH) 4]-+OH-①正极反应式为 。②与普通锌锰干电池相比,当消耗相同质量的负极活性物质时,Al-H2O2燃料电池的理论放电量约为普通锌锰干电池的 倍。③Al电极易被NaOH溶液化学腐蚀,这是该电池目前未能推广使用的原因之一。反应的离子方程式为 。15.阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池总反应为2H2+O2===2H2O。若电解质溶液为KOH溶液,其电极反应式分别为:负极 ,正极 。若电解质溶液为稀H2SO4,其电极反应式分别为:负极 ,正极 。16.据报道,MOTOROLA公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量是镍氢电池和锂电池的10倍,可连续使用1个月充电一次。假定放电过程中,甲醇完全氧化产生的CO2被充分吸收生成CO。(1)该电池反应的总离子方程式为 。(2)甲醇在 极发生反应(填正或负),电池在放电过程中溶液的pH将 (填降低或上升、不变);(3)最近,又有科学家制造出一种固体电解质的燃料电池,其效率更高。一个电极通入空气,另一电极通入汽油蒸气。其中固体电解质是掺杂了Y2O3(Y:钇)的ZrO2(Zr:锆)固体,它在高温下能传导O2-离子(其中氧化反应发生完全)。以辛烷(C8H18)代表汽油蒸气。①电池的负极反应式为 。 ②放电时固体电解质里的O2-离子的移动方向是向 极移动(填正或负)。17.短周期元素X、Y、Z、W在周期表中的位置关系如右图所示,已知在同周期元素的常见简单离子中,W的简单离子半径最小,X、Y、Z、W的单质及其化合物在日常生活中用途极其广泛。 XYZW (1)X元素在元素周期表中的位置 。(2)X、Y、Z元素的氢化物均有两种或两种以上,其中一定条件下,液态YH3与液态H2Z可以发生类似方式电离,则液态YH3中阳离子的电子式为 。(3)超细WY粉末被应用于大规模集成电路领域。其制作原理为W2Z3、Y2、X在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1∶1;其反应的化学方程式为 。(4)以W为材料制成的容器在空气中具有自我保护作用,这种容器 (填“能”或“不能”)用来腌制咸菜,原因是 。(5)某汽车尾气分析仪以燃料电池为工作原理测定XZ的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中Z2-可以在固体介质NASICON中自由移动。则负极的反应式 。关于该电池的下列说法,正确的是 A.工作时电极b作正极,Z2- 通过固体介质NASICON由电极b流向电极aB.工作时电流由电极a通过传感器流向电极bC.传感器中通过的电流越大,尾气中XZ的含量越高(6)由元素X与元素Z组成的某种阴离子具有还原性其对应的酸常存在于自然界中的植物中,能被酸性KMnO4氧化,请填写相应的离子,并给予配平: 18.甲醇(CH3OH)是一种绿色能源。如图所示某同学设计一个甲醇燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.根据要求回答相关问题:(1)写出负极的电极反应式为 (2)铁电极为 (填“阳极或“阴极),石墨电极(C)的电极反应式为 (3)若在标准状况下,有2.24L氧气参加反应,丙装置中阴极析出铜的质量为 g(4)若将乙装置中两电极与位置互换,其它装置不变,此时以装置中发生的总反应式 19.锌银电池比能量大、电压平稳,广泛用于电子手表、照相机、计算器和其他微型电子仪器。电解质溶液是KOH溶液,电池总反应为。请回答下列问题:(1)该电池的正极材料是 ;电池工作时,阳离子向 (填“正极”或“负极”)移动;负极的反应式为 。(2)①电极材料锌可由闪锌矿在空气中煅烧成氧化锌,然后用碳还原来制取,化学反应方程式为,此法为 。A.电解法B.热还原法C.热分解法②电极材料氧化银可回收利用得到银,其化学方程式为 。20.能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率,请回答下列问题。(1)①工业合成氨反应:N2+3H22NH3是放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知1molN2完全反应生成NH3可放出92kJ热量。如果将10molN2和足量H2混合,使其充分反应,放出的热量 (填“大于”、“小于”或“等于”)920kJ。②已知断开1molNN键吸收的能量为945.6kJ,形成1molN﹣H键放出的能量为391kJ,根据化学方程式N2+3H22NH3,生成标准状况下44.8LNH3时放出的能量为92.4kJ,则断开1molH﹣H键吸收的能量是 。(2)某实验小组同学进行如图1所示实验,以检验化学反应中的能量变化。请根据你掌握的反应原理判断,②中的温度 (填“升高”或“降低”)。反应过程 (填“①”或“②”)的能量变化可用图2表示。(3)已知化学反应A2(g)+B2(g)═2AB(g)的能量变化如图2所示,该反应是 (填“吸热”或“放热”)反应。(4)用CH3OH和O2组合形成的质子交换膜燃料电池的结构如图3所示:①则d电极是 (填“正极”或“负极”),c电极的电极反应式为 。②若线路中转移2mol电子,则该燃料电池理论上消耗的O2在标准状况下的体积为 L。 三、实验题21.当反应物中的某离子或过量反应物影响产物的检验时,用电化学装置探究,将产物与反应物隔离开,能更准确地检验产物。例如,某实验小组对KSCN的性质进行探究,设计了如下实验:装置实验步骤现象i.先加溶液无明显现象ii.再加硫酸酸化的溶液溶液先变红后褪色(1)实验步骤ii中溶液变红的原因: 、 (用离子方程式说明)。(2)针对实验步骤ii中红色褪去的原因,该实验小组同学认为是被酸性溶液氧化为,由于硫酸酸化的高锰酸钾溶液中存在,所以不能直接取褪色后的溶液来验证的氧化产物是,故设计了如图所示实验装置来证实上述猜想是成立的。检验产物中的操作及现象是 。22.有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入 2 mol·L−1的H2SO4溶液中,乙同学将电极放入 6 mol·L−1 的 NaOH 溶液中,如图所示。(1)写出甲中正极的电极反应式: 。(2)装置乙中负极为 ,该电极的反应式为 ,写出总反应的离子方程式: 。(3)当装置乙的导线中通过0.3mol电子时,装置乙烧杯中溶液的质量的变化为 (填增加或减轻多少g)(4)由此实验得出的下列结论中,正确的有_______A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质B.镁的金属性不一定比铝的金属性强C.该实验说明金属活动性顺序已过时,没有实用价值了D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析23.无水MgBr2广泛用作有机反应催化剂。实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图,主要步骤如下:步骤1 三颈瓶中装入10g镁屑和150mL无水乙醚;装置 B中加入15mL液溴。步骤2 缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。步骤3 反应完毕后恢复至室温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。步骤4 常温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品。已知:①Mg和Br2反应剧烈放热;乙醚极易挥发;②MgBr2具有强吸水性。③MgBr2+3C2H5OC2H5MgBr2·3C2H5OC2H5∆H<0(1)仪器D的名称是 ;冷凝水从 (填a或b)口流出;(2)干燥的N2可将液溴吹出,是因为液溴具有 的性质;实验中不能用干燥空气代替干燥N2,用化学方程式解释其原因 ;(3)步骤3中,第一次过滤除去的物质是 ;(4)试用平衡移动的原理说明得到三乙醚合溴化镁后,加热有利于其分解,得无水MgBr2产品的原因: ;(5)为测定产品的纯度,可用EDTA标准溶液滴定,反应的离子方程式:Mg2++EDTA=EDTA-Mg2+;测定前,先称取0.2000g无水MgBr2产品,溶解后,用0.1000mol/L的EDTA标准溶液滴定至终点,消耗EDTA标准溶液10.00mL,则测得无水MgBr2产品的纯度是 (以质量分数表示,用百分数形式表示,保留到小数点后一位)。(6)本实验乙醚的应用是关键,其同系物甲醚也有重要用途。某大学实验室在模拟研究固体载氢硝酸盐燃料电池的实验中发现新发明的固体氢气载体RCNT对甲醚有独特的装载、卸载特性。吸附的甲醚会在RCNT内部以CH3O-和CH形式分别嵌入内部空穴,可以表示为CH3O-RCNT-CH3,这种载体不仅对甲醚的装载、卸载率非常高(注意并没有完全卸载),而且不改变甲醚性质,安全、高效、体积小、容量大,具有很好的应用前景。如下图所示:请写出这种RCNT固体载甲醚硝酸盐燃料电池负极电极反应方程式: 。 参考答案:1.C2.D3.B4.B5.D6.B7.D8.D9.B10.D11.(1) 负 负 O2+2H2O+4e-=4OH-(2)111(3) 太阳 Ni(OH)2-e-+OH-=NiOOH+H2O 减小 Zn-2e-+2OH-=Zn(OH)2 12.不一定,如氢氧燃料电池的正、负极均为Pt13. 氧化剂 还原剂 导线 还原剂 失去 氧化剂 得到 反应载体 电解质溶液 导体14. 常温下,铝易被浓硝酸、浓硫酸钝化 LiAlH4、AlCl3 + 60.5 kJ·mol-1 3HO+3H2O+6e-=9OH-(或HO+H2O+2e-=3OH-) 3.6 2Al+6H2O+2OH-=2[Al(OH) 4]-+3H2↑15. H2-2e-+2OH-=2H2O O2+2H2O+4e-=4OH- H2-2e-=2H+ O2+4e-+4H+=2H2O16.(1)2CH3OH + 3O2 + 4OH- = 2CO+ 6H2O(2) 负 降低(3) C8H18 - 50 e- + 25 O2- = 8CO2+ 9H2O 负 17.(1)第二(或2)周期ⅣA 族(2)(3)Al2O3 + N2 + 3C2AlN + 3CO(4) 不能 氯离子会破坏铝表面氧化膜(5) CO + O2- -2e-=CO2 AC(6) 18. H2-2e-+2OH-=2H2O 阴极 12.8g Fe+2H2OFe(OH)2↓+H2↑19.(1) Ag2O 正极 Zn-2e-+2OH-=ZnO+H2O(2) B 2Ag2O4Ag+O2↑ 20. 小于 436kJ 降低 ① 放热 正极 2CH3OH+2H2O-12e-=2CO2+12H+ 11.221.(1) (2)电池工作一段时间后,取少量左侧烧杯中的溶液,先加盐酸酸化,再加氯化钡溶液,出现白色沉淀 22.(1)2H++2e-=H2↑(2) 铝 Al-3e-+4OH-=AlO+2H2O 2Al+2OH-+2H2O=2 AlO+3H2↑(3)增加2.4g(4)AD 23. 球形冷凝管 b 极易挥发 2Mg+O2 =2MgO 镁屑 加热促使乙醚挥发,且逆反应是吸热反应,加热后平衡朝有利于三乙醚合溴化镁分解的方向移动 92.0% CH3O-RCNT-CH3 -12xe-+12x=(1-x)CH3O-RCNT-(1-x)CH3+6xN2O5↑+2xCO2↑+3xH2O或CH3O-RCNT-CH3 -12xe-+12x=(1-x)CH3O-RCNT-(1-x)CH3+3xN2O5↑+2xCO2↑+6xHNO3
相关试卷
这是一份高中鲁科版 (2019)第2节 化学能转化为电能——电池同步训练题,共38页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
这是一份高中化学鲁科版 (2019)选择性必修1第2节 化学能转化为电能——电池测试题,共17页。试卷主要包含了单选题,填空题,实验题等内容,欢迎下载使用。
这是一份鲁科版 (2019)选择性必修1第1章 化学反应与能量转化第2节 化学能转化为电能——电池第1课时精练,共4页。试卷主要包含了下列装置中,能构成原电池的是,元素周期表中钌等内容,欢迎下载使用。










