
新高考化学一轮复习精品学案 第6章 热点强化14 微粒空间结构 大π键的判断(含解析)
展开
这是一份新高考化学一轮复习精品学案 第6章 热点强化14 微粒空间结构 大π键的判断(含解析),共5页。
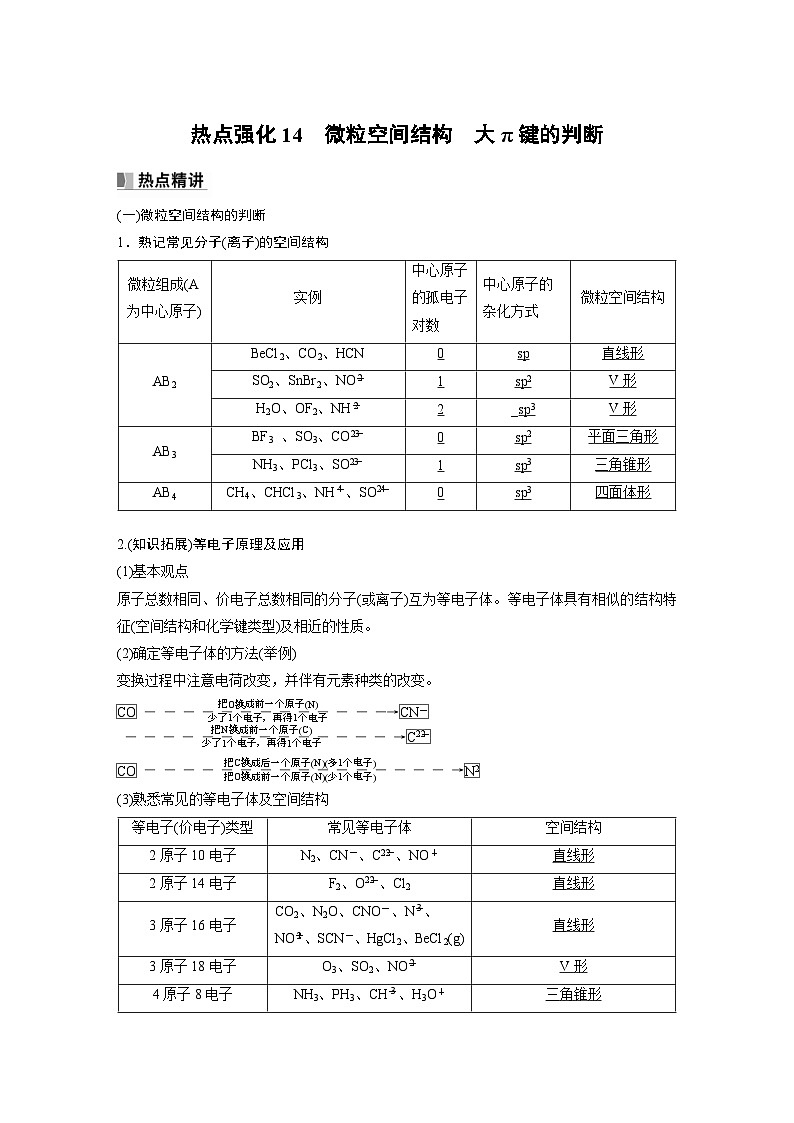
热点强化14 微粒空间结构 大π键的判断(一)微粒空间结构的判断1.熟记常见分子(离子)的空间结构微粒组成(A为中心原子)实例中心原子的孤电子对数中心原子的杂化方式微粒空间结构AB2BeCl2、CO2、HCN0sp直线形SO2、SnBr2、NO1sp2V形H2O、OF2、NH2_sp3V形AB3BF3 、SO3、CO0sp2平面三角形NH3、PCl3、SO1sp3三角锥形AB4CH4、CHCl3、NH、SO0sp3四面体形 2.(知识拓展)等电子原理及应用(1)基本观点原子总数相同、价电子总数相同的分子(或离子)互为等电子体。等电子体具有相似的结构特征(空间结构和化学键类型)及相近的性质。(2)确定等电子体的方法(举例)变换过程中注意电荷改变,并伴有元素种类的改变。(3)熟悉常见的等电子体及空间结构等电子(价电子)类型常见等电子体空间结构2原子10电子N2、CN-、C、NO+直线形2原子14电子F2、O、Cl2直线形3原子16电子CO2、N2O、CNO-、N、NO、SCN-、HgCl2、BeCl2(g)直线形3原子18电子O3、SO2、NOV形4原子8电子NH3、PH3、CH、H3O+三角锥形4原子24电子SO3(g)、CO、NO、BO、BF3平面三角形4原子26电子SO、ClO、BrO、IO、XeO3三角锥形5原子8电子CH4、SiH4、NH、PH、BH正四面体形5原子32电子CCl4、SiF4、SiO、SO、ClO正四面体形12原子30电子C6H6、N3B3H6(俗称无机苯)平面六边形 (二)大π键(离域π键)1.形成条件(1)中心原子采取sp或sp2杂化。(2)参与形成大π键的多个原子应在同一个平面或同一直线上。2.大π键共用电子数分析方法(1)大π键中共用电子的数目等于垂直于分子或离子平面的p轨道中的电子数目总和。(2)判断出中心原子的杂化方式,并画出价层电子轨道表示式。未参与成键的杂化轨道,优先填充两个电子,形成孤电子对,杂化轨道中的电子不参与形成大π键。(3)根据配位原子的价层电子轨道表示式,判断配位原子中未参与成键且垂直该分子或离子平面的p轨道中电子数目(单电子优先形成π键)。示例 推测CO中的大π键为________。分析 根据价层电子对互斥模型判断CO为平面三角形结构,中心C原子为sp2杂化,价层电子轨道表示式为,每个O原子有两个单电子,三个O分别用一个单电子与中心C原子形成三个C—O σ键,另一个单电子参与形成大π键,形成两个负电荷的电子也参与形成大π键。则大π键的电子总数为1+3+2=6,表示为Π。1.下列关于NH、NH3、NH三种粒子的说法不正确的是( )A.三种粒子所含有的电子数相等B.三种粒子中氮原子的杂化方式相同C.三种粒子的空间结构相同D.键角大小关系:NH>NH3>NH答案 C解析 NH、NH3、NH含有的电子数均为10,A正确;NH、NH3、NH三种粒子中氮原子的杂化方式均为sp3杂化,B正确;NH的空间结构为正四面体形,NH3为三角锥形,NH为V形,C错误;NH、NH3、NH三种粒子的键角大小关系为NH>NH3>NH,D正确。2.(1)[2020·全国卷Ⅰ,35(3)]磷酸根离子的空间结构为________,其中P的价层电子对数为________,杂化轨道类型为________。(2)[2018·全国卷Ⅰ,35(3)节选]LiAlH4中的阴离子空间结构是________,中心原子的杂化形式为________。答案 (1)正四面体形 4 sp3 (2)正四面体形 sp3解析 (1)PO的中心原子P的价层电子对数为4,孤电子对数为0,中心原子P为sp3杂化,故PO的空间结构为正四面体形。(2)LiAlH4中的阴离子是AlH,中心原子铝原子含有的价层电子对数是4,且不存在孤电子对,所以空间结构是正四面体形,中心原子的杂化轨道类型是sp3杂化。3.[2017·全国卷Ⅱ,35(3)②]经X射线衍射测得化合物(N5)6(H3O)3(NH4)4Cl的晶体结构,其局部结构如图所示。该化合物中阴离子N中的σ键总数为________个。分子中的大π键可用符号Π表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π),则N中的大π键应表示为________。 答案 5 Π解析 根据图可知,N中的σ键总数为5;N中每个N原子采取sp2杂化,未参与杂化的p轨道,垂直于该离子平面形成大π键,每个p轨道各提供一个电子,再加上一个单位的负电荷,所以N中一共有6个电子参与形成大π键,应表示为Π。4.[2022·山东,16(3)节选]吡啶()中含有与苯类似的Π大π键,则吡啶中N原子的价层孤电子对占据________(填标号)。A.2s轨道 B.2p轨道C.sp杂化轨道 D.sp2杂化轨道答案 D解析 已知吡啶中含有与苯类似的Π大π键,则说明吡啶中N原子也是采用sp2杂化,杂化轨道只用于形成σ键和容纳孤电子对,则吡啶中N原子的价层孤电子对占据sp2杂化轨道。5.已知吡咯为平面形结构,如图:则吡咯环中的大π键应表示为________。答案 Π解析 吡咯环中形成大π键的原子数为5个;氮原子中未参与成键的电子为1对,可提供2个电子形成π键,碳碳原子间除了形成σ键外,还有4个碳分别提供1个电子形成π键,共有电子数为6,所以吡咯环中的大π键应表示为Π。6.已知:多原子分子中,若原子都在同一平面上且这些原子有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”(或大π键)。大π键可用Π表示,其中m、n分别代表参与形成大π键的电子数和原子个数,如苯分子中大π键表示为Π。按要求回答下列问题:(1)下列微粒中存在“离域π键”的是________(填字母)。a.O3 b.SO c.H2S d.NO(2)N2O分子中的大π键表示为__________。(3)叠氮酸(HN3)是一种弱酸,在水中能微弱电离出H+和N,则N中的大π键应表示为________________________________________________________________________。答案 (1)ad (2)Π (3)Π解析 (1)形成“离域π键”的形成条件是“原子都在同一平面上且这些原子有相互平行的p轨道” ,O3为V形结构,有相互平行的p轨道,可以形成“离域π键”;硫酸根离子是正四面体结构,原子不处于同一平面内,不能形成“离域π键”;硫化氢中H原子和S原子没有平行的p轨道,不能形成“离域π键”;NO为平面三角形,有相互平行的p轨道,可以形成“离域π键”。(3)N价电子总数为16,原子总数为3,所以与CO2为等电子体,二者成键方式类似,参与形成大π键的原子数为3,形成两个Π,如图 。7.(1)Cu2+处于[Cu(NH3)4]2+的中心,若将配离子[Cu(NH3)4]2+中的2个NH3换为CN-,则有2种结构,则Cu2+是否为sp3杂化?__________(填“是”或“否”),理由为__________________________________________________________________________________________。(2)用价层电子对互斥模型推断甲醛中H—C—H的键角________(填“>”“<”或“=”)120°。(3)SO2Cl2和SO2F2中S==O之间以双键结合,S—Cl、S—F之间以单键结合。请你预测SO2Cl2和SO2F2分子的空间结构为________________。SO2Cl2分子中∠Cl—S—Cl______SO2F2分子中∠F—S—F(填“<”“>”或“=”)。(4)抗坏血酸的分子结构如图所示,该分子中碳原子的杂化轨道类型为__________________。答案 (1)否 若是sp3杂化,[Cu(NH3)4]2+的空间结构为正四面体形,将配离子[Cu(NH3)4]2+中的2个NH3换为CN-,则只有1种结构 (2)< (3)四面体形 > (4)sp2、sp3解析 (2)甲醛分子中,碳氧之间为双键,根据价层电子对互斥模型可知双键与单键之间的斥力大于单键与单键之间的斥力,所以H—C—H的键角小于120°。(3)当中心原子的价层电子对数为4时,VSEPR模型为四面体形,硫原子无孤电子对,所以空间结构为四面体形;配位原子得电子能力越弱,其与中心原子形成的共用电子对之间的斥力越强,F原子的得电子能力大于氯原子,所以SO2Cl2分子中∠Cl—S—Cl>SO2F2分子中∠F—S—F。
相关学案
这是一份新高考化学一轮复习精品学案 第9章 热点强化22 水解常数及应用(含解析),共3页。
这是一份新高考化学一轮复习精品学案 第9章 热点强化20 电离常数的相关计算(含解析),共4页。
这是一份新高考化学一轮复习精品学案 第7章 热点强化17 电解原理创新应用(含解析),共7页。








