
所属成套资源:新高考化学一轮复习精品学案 (含解析)
新高考化学一轮复习精品学案 第11章 第68讲 简单实验方案的设计与评价(含解析)
展开
这是一份新高考化学一轮复习精品学案 第11章 第68讲 简单实验方案的设计与评价(含解析),共13页。
[复习目标] 1.掌握评价检验类化学实验方案设计的一般思路。2.掌握评价性质探究类化学实验方案设计的一般思路。
类型一 物质检验类实验方案的评价
检验类实验方案评价的一般思路
1.检验试剂选择及用量是否正确,对检验试剂的要求是:
(1)检验试剂不能对其他物质的检验有干扰,即不能与其他被检验的物质反应,也不能生成被检验的物质。
(2)宏观现象要明显。
2.实验操作是否简单可行。
3.操作顺序是否正确,注意排除干扰因素。
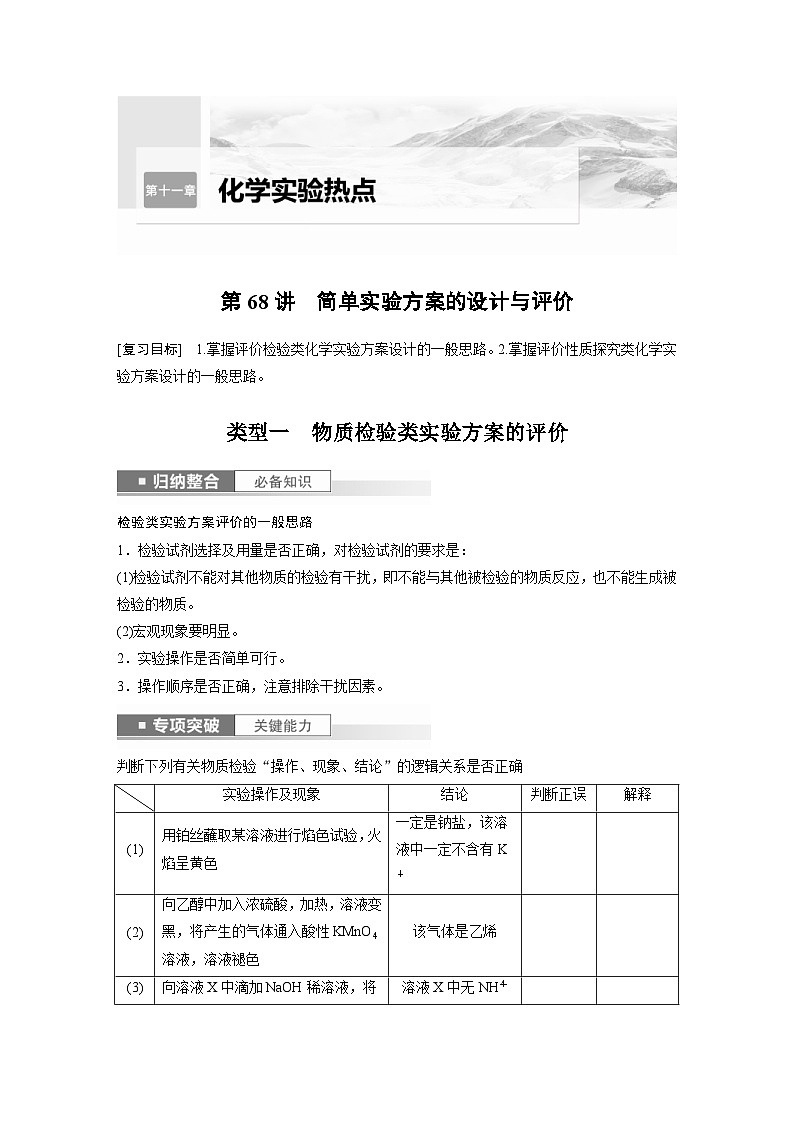
判断下列有关物质检验“操作、现象、结论”的逻辑关系是否正确
答案 (1)× NaOH焰色试验火焰也是黄色,检验钾元素要透过蓝色钴玻璃,透过蓝色钴玻璃火焰呈紫色说明含有钾元素,否则不含有
(2)× 未反应的乙醇、生成的乙烯、SO2都能使酸性KMnO4溶液褪色
(3)× NH3极易溶于水,在溶液中加入NaOH稀溶液,生成的氨水浓度小,不加热时NH3不会挥发出来
(4)× 淀粉碘化钾试纸检验的是具有强氧化性的气体,Y可能是Cl2,也可能是O3、NO2等气体
(5)× O3、Cl2也能使品红褪色
(6)× 若溶液Y中含有SOeq \\al(2-,3),滴加硝酸时能被氧化成SOeq \\al(2-,4),加入BaCl2也会有白色沉淀产生
(7)× 碳碳双键和醛基都能使酸性高锰酸钾溶液褪色,故用KMnO4溶液无法证明分子中含有碳碳双键
(8)× 只要是挥发性的浓酸遇蘸有浓氨水的玻璃棒都能产生白烟,浓盐酸、浓硝酸都符合
(9)× 稀硫酸在淀粉水解实验中作催化剂,在未中和硫酸的情况下加入的新制的Cu(OH)2会与硫酸反应生成CuSO4,在加热时得不到沉淀,应该先加氢氧化钠中和硫酸后再加新制的Cu(OH)2
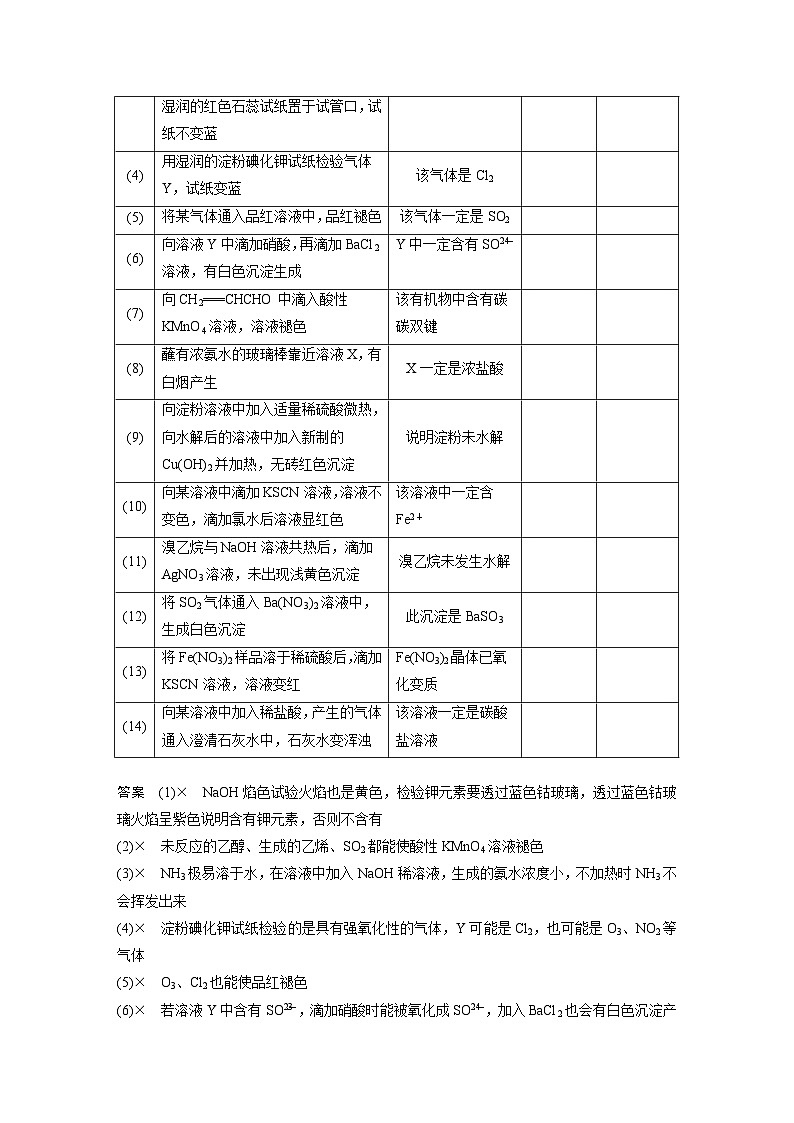
(10)√ Fe2+的检验方法正确
(11)× NaOH与AgNO3溶液反应生成的AgOH极不稳定,分解生成棕褐色的氧化银,干扰溴离子的检验,应该先加稀硝酸中和NaOH后再加AgNO3溶液
(12)× H2SO3是中强酸,电离出的H+与溶液中的NOeq \\al(-,3)能将SOeq \\al(2-,3)氧化成SOeq \\al(2-,4),故该白色沉淀是BaSO4
(13)× 在Fe(NO3)2中加入稀硫酸后,Fe2+能被H+、NOeq \\al(-,3)(两者同时存在相当于HNO3)氧化成Fe3+而干扰实验
(14)× 碳酸氢盐、亚硫酸盐、亚硫酸氢盐溶液也有相同现象
类型二 原理或性质探究类实验方案分析评价
1.原理或性质探究类简单实验方案设计常考点总结
(1)探究物质氧化性或还原性的强弱。
(2)探究物质酸性的强弱。
(3)探究物质的其他特殊性质,如漂白性、不稳定性。
(4)探究物质溶解能力(溶解度)的大小。
(5)探究化学反应是否为可逆反应。
2.原理及性质探究类实验方案评价的一般思路
(1)理论依据是否正确(物质的性质、化学原理等)。
(2)是否注意控制变量。
(3)实验操作是否规范。
(4)实验现象与结论是否具有因果关系。
判断下列有关原理或性质实验中“操作、现象、结论”的描述逻辑关系是否正确
答案 (1)× 探究温度对化学反应速率的影响,要先将混合液加热到所需要的温度后再混合,若先混合则会发生反应,影响实验的判断,且需设置对照实验
(2)× 向蛋白质溶液中加入饱和氯化钠溶液发生盐析
(3)× 醋酸具有挥发性,生成的CO2气体中混有挥发出的醋酸,苯酚钠变浑浊可能是因为CO2,也可能是因为醋酸,无法比较碳酸与苯酚的酸性强弱
(4)× 还原产物是NO,在试管口被氧化为NO2
(5)× NaCl和NaI溶液的浓度未知,无法比较Ksp大小
(6)√ 使淀粉溶液显蓝色的一定是I2,与AgNO3反应生成黄色沉淀的是I-,所以KI3溶液中存在I2和I-,故可推知Ieq \\al(-,3)存在平衡
(7)√ HS-水解生成OH-:HS-+H2OH2S+OH-,HS-电离生成H+:HS-S2-+H+,溶液呈碱性,说明HS-的水解程度大于其电离程度
1.(2022·浙江6月选考,25)亚硝酸钠俗称“工业盐”,其外观、口感与食盐相似,人若误服会中毒。现将适量某样品(成分为亚硝酸钠或氯化钠)溶于水配成溶液,分别取少量该溶液于试管中进行实验。下列方案设计、现象和结论都正确的是( )
答案 C
解析 酸性条件下,KClO3被NaNO2还原为Cl-,NaCl中也含有Cl-,都会生成白色沉淀,A错误;氯化钠电离出的氯离子也可以被酸性高锰酸钾氧化,而使其褪色,B错误;NOeq \\al(-,2)在酸性条件下有较强的氧化性,可以把二价铁氧化为三价铁,溶液变为黄色,C正确;稀硝酸可以把亚硫酸根离子氧化为硫酸根离子,再加入氯化钡溶液可以生成硫酸钡白色沉淀,D错误。
2.(高考组合题)根据实验目的,下列实验及现象、结论都正确的是( )
答案 B
解析 浓盐酸也能与KMnO4发生反应,使溶液紫色褪去,A错误;加入稀盐酸,亚硫酸根离子会转化为二氧化硫气体,加入氯化钡生成的沉淀只能是硫酸钡沉淀,可以说明样品已经变质,B正确;乙醇和水均会与金属钠发生反应生成氢气,C错误;先滴加氯水,再加入KSCN溶液,溶液变红,说明加入KSCN溶液前溶液中存在Fe3+,但不能确定Fe3+是否由Fe2+氧化而来,故D错误。
3.(2022·全国乙卷,10)由实验操作和现象,可得出相应正确结论的是( )
答案 C
解析 过量的氯水可以将碘离子氧化为碘单质,无法证明溴单质的氧化性强于碘单质,A错误;向蔗糖溶液中滴加稀硫酸,水浴加热后,应先加入氢氧化钠溶液使体系呈碱性,再加新制氢氧化铜悬浊液检验,若不加氢氧化钠,未反应的稀硫酸会和新制的氢氧化铜反应,则不会产生砖红色沉淀,不能说明蔗糖是否发生水解,B错误;聚氯乙烯加强热会发生焦化、分解反应,产生能使湿润的蓝色石蕊试纸变红的气体,说明产生了氯化氢,与氯乙烯加聚反应条件不同,不能说明氯乙烯加聚是可逆反应,D错误。
4.(2020·江苏,13)根据下列实验操作和现象所得到的结论正确的是( )
答案 B
解析 A项,加入少量碘水,溶液变蓝,只能证明溶液中含有淀粉,但无法得出淀粉未水解的结论,可能是部分淀粉发生水解反应,错误;C项,白色沉淀中还可能含有碳酸钙,错误;D项,反应物H2O2中-1价的O变为0价的O,H2O2失电子,说明H2O2具有还原性,错误。
5.(2020·天津,6)检验下列物质所选用的试剂正确的是( )
答案 C
解析 淀粉遇碘单质才会变蓝,海水中的碘元素主要是以离子的形式存在,无法检验,A错误;SO2气体和CO2气体均可使澄清石灰水变浑浊,B错误;铜离子可以和氨水先生成氢氧化铜蓝色沉淀,再与氨水结合生成铜氨络合离子[Cu(NH3)4]2+,可以检验,C正确;氨气可使湿润的红色石蕊试纸变蓝,D错误。
6.(2018·天津,4)由下列实验及现象推出的相应结论正确的是( )
答案 B
解析 A错,可以证明含有Fe2+,但不能确定是否含有Fe3+;C错,由于ZnS难溶而Na2S易溶,且浓度未知,向悬浊液中滴加CuSO4溶液产生黑色沉淀,不能比较ZnS和CuS的Ksp大小;D错,若原溶液中存在SOeq \\al(2-,3),也会产生同样的现象。
课时精练
1.(2022·沈阳高三模拟)下列根据实验操作和现象所得出的结论正确的是( )
答案 C
解析 将浓硫酸滴到纸上,纸张变黑,说明浓硫酸具有脱水性,故A错误;H2SO3的酸性比H2CO3强,但S的最高价氧化物对应的水化物为H2SO4,则无法判断S、C的非金属性强弱,故B错误;由实验操作和现象可知,碘化银更难溶,则Ksp(AgCl)>Ksp(AgI),故C正确;甲醇能被酸性高锰酸钾氧化生成甲酸,甲酸分子中含有醛基,能被过量的酸性高锰酸钾氧化,最终产物不是甲酸,故D错误。
2.(2022·广东韶关模拟)下列实验中,现象及推论都正确的是( )
答案 D
解析 烧杯壁变凉说明反应的焓变ΔH>0,该反应有氨气生成,则熵变ΔS>0,A错误;NaOH溶液过量,两种沉淀均能生成,不能比较Ksp[Fe(OH)3]和Ksp [Mg(OH)2] 的相对大小,B错误;铝箔在酒精灯上加热,表面生成难熔的氧化铝,故被包裹在里面的熔化后的铝难以滴落下来,C错误。
3.(2022·石家庄二中模拟)下列实验操作及现象与结论对应关系正确的是( )
答案 D
解析 加热NaI固体和浓H3PO4溶液可制得HI,说明HI比H3PO4易挥发,A不符合题意;KI溶液中先加淀粉,后加硫酸,试剂顺序不合理,B不符合题意;Ca(ClO)2溶液中通入SO2,发生氧化还原反应生成硫酸钙,则白色沉淀为CaSO4,体现SO2的还原性,C不符合题意;由于Fe、Fe3O4均为可以被磁铁吸引的黑色固体,根据反应:Fe3O4+8HCl===2FeCl3+FeCl2+4H2O、Fe+2FeCl3===3FeCl2,故D符合题意。
4.(2022·哈尔滨三中高三月考)下列实验中,对应的实验以及结论都正确且二者具有因果关系的是( )
答案 B
解析 MgSO4不足量,CuSO4能与溶液中过量的NaOH直接反应生成Cu(OH)2,不能体现两种沉淀的转化,A不符合题意;Fe2+遇K3[Fe(CN)6]会生成蓝色沉淀,B符合题意;乙烯被酸性高锰酸钾溶液氧化,生成物是CO2,无难溶于水的有机物生成,液体不会分层,C不符合题意;该反应无明显现象,无法清晰分辨反应速率快慢,D不符合题意。
5.由下列实验操作及现象所得结论错误的是( )
答案 A
解析 A项,CH3COONa和NaNO2溶液浓度未知,所以无法根据pH的大小比较两种盐溶液的水解程度,也就无法比较HNO2和CH3COOH电离出H+的难易程度,错误;B项,发生反应:Cl2+2I-===I2+2Cl-,淀粉溶液遇I2变蓝,正确;C项,Al(OH)3溶于NaOH溶液生成NaAlO2和H2O,体现了Al(OH)3的酸性,正确;D项,AgCl转化为溶解度更小的Ag2S,正确。
6.(2022·北京北大附中模拟)下列实验方案能达到相应实验目的的是( )
答案 D
解析 不宜用石蕊溶液检验SO2,因为SO2在溶液中易被氧化生成H2SO4,A错误;稀硫酸催化纤维素水解后,应先加入NaOH溶液至溶液呈碱性,再加入新制的Cu(OH)2,加热,观察是否有砖红色沉淀生成,B错误;向Na2SO3溶液中加入Ba(NO3)2和稀硝酸,SOeq \\al(2-,3)会被氧化为SOeq \\al(2-,4),会产生BaSO4白色沉淀,则不能说明Na2SO3是否变质,C错误;溶剂醇与溴水不反应,若溴水褪色,说明1-溴丁烷发生了消去反应产生了丁烯,D正确。
7.根据下列实验操作和现象所得到的结论正确的是( )
答案 D
解析 挥发的乙醇及反应产生的乙烯都可以被酸性KMnO4溶液氧化而使溶液褪色,A错误;苯酚与碳酸钠反应产生可溶性苯酚钠和碳酸氢钠,可证明酸性:苯酚>HCOeq \\al(-,3),B错误;检验水解后溶液中含有Br-应该在酸性溶液中,C错误。
8.根据下列实验操作和现象所得到的结论正确的是( )
答案 D
解析 乙酸能除去水垢,说明乙酸的酸性强于碳酸的酸性,A项错误;Ca2+、Ba2+与SOeq \\al(2-,4)反应生成的CaSO4、BaSO4均为白色沉淀,B项错误;氯气与甲烷发生取代反应生成的氯化氢溶于水显酸性,能使蓝色石蕊试纸变红,C项错误;0.1 ml·L-1 Na2SO3溶液的pH为10,说明SOeq \\al(2-,3)+H2OHSOeq \\al(-,3)+OH-,0.1 ml·L-1 NaHSO3溶液的pH约为5,说明HSOeq \\al(-,3)H++SOeq \\al(2-,3),所以HSOeq \\al(-,3)结合H+的能力比SOeq \\al(2-,3)的弱,D项正确。
9.下列有关实验操作及现象和实验结论均正确的是( )
答案 C
解析 水蒸气和铁粉反应生成黑色的四氧化三铁,故A错误;酸性高锰酸钾溶液具有氧化性,若褪色,则被还原,故C正确;NaClO溶液具有漂白性,能漂白试纸,故D错误。
10.(2022·沈阳高三模拟)为完成下列实验目的,对应的实验操作及现象正确的是( )
答案 D
解析 丙烯醛分子中的碳碳双键和醛基都能与酸性高锰酸钾溶液发生反应使溶液褪色,故A错误;玻璃中含有钠元素,则火焰出现黄色不能证明溶液中含有钠元素,故B错误;加入少量蒸馏水溶解氢氧化钠固体后,应冷却至室温后将溶液转移至容量瓶中,洗涤烧杯和玻璃棒2~3次,并将洗涤液转移至容量瓶中,否则会出现实验误差,故C错误。
11.(2023·宁夏高三模拟)下列实验操作和现象及实验结论均正确的是( )
答案 C
解析 氨水是混合物,不属于电解质,A项错误;该溶液中也可能含有S2Oeq \\al(2-,3)、HSOeq \\al(-,3)等,B项错误;石蕊不褪色说明氯水中已不含有Cl2或HClO,已经完全变质,C项正确;结论应为浓硫酸具有脱水性,D项错误。实验操作及现象
结论
判断正误
解释
(1)
用铂丝蘸取某溶液进行焰色试验,火焰呈黄色
一定是钠盐,该溶液中一定不含有K+
(2)
向乙醇中加入浓硫酸,加热,溶液变黑,将产生的气体通入酸性KMnO4溶液,溶液褪色
该气体是乙烯
(3)
向溶液X中滴加NaOH稀溶液,将湿润的红色石蕊试纸置于试管口,试纸不变蓝
溶液X中无NHeq \\al(+,4)
(4)
用湿润的淀粉碘化钾试纸检验气体Y,试纸变蓝
该气体是Cl2
(5)
将某气体通入品红溶液中,品红褪色
该气体一定是SO2
(6)
向溶液Y中滴加硝酸,再滴加BaCl2溶液,有白色沉淀生成
Y中一定含有SOeq \\al(2-,4)
(7)
向CH2===CHCHO中滴入酸性KMnO4溶液,溶液褪色
该有机物中含有碳碳双键
(8)
蘸有浓氨水的玻璃棒靠近溶液X,有白烟产生
X一定是浓盐酸
(9)
向淀粉溶液中加入适量稀硫酸微热,向水解后的溶液中加入新制的Cu(OH)2并加热,无砖红色沉淀
说明淀粉未水解
(10)
向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色
该溶液中一定含Fe2+
(11)
溴乙烷与NaOH溶液共热后,滴加AgNO3溶液,未出现浅黄色沉淀
溴乙烷未发生水解
(12)
将SO2气体通入Ba(NO3)2溶液中,生成白色沉淀
此沉淀是BaSO3
(13)
将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液,溶液变红
Fe(NO3)2晶体已氧化变质
(14)
向某溶液中加入稀盐酸,产生的气体通入澄清石灰水中,石灰水变浑浊
该溶液一定是碳酸盐溶液
实验操作及现象
实验结论
判断正误
解释
(1)先将硫代硫酸钠与硫酸两种溶液混合后再用水浴加热,观察出现浑浊所用的时间
探究温度对化学反应速率的影响
(2)向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液,均有固体析出
蛋白质均发生变性
(3)向Na2CO3溶液中加入冰醋酸,将产生的气体直接通入苯酚钠溶液中,产生白色浑浊
酸性:醋酸>碳酸>苯酚
(4)向盛有Fe(NO3)2溶液的试管中加入0.1 ml·L-1 H2SO4,试管口出现红棕色气体
溶液中NOeq \\al(-,3)被Fe2+还原为NO2
(5)向NaCl和NaI稀溶液中滴加少量AgNO3溶液,先出现黄色沉淀
Ksp(AgCl)>Ksp(AgI)
(6)向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液,前者溶液变蓝色,后者有黄色沉淀生成
KI3溶液中存在平衡:Ieq \\al(-,3)I2+I-
(7)向NaHS溶液中滴入酚酞,溶液变红色
HS-水解程度大于其电离程度
方案设计
现象和结论
A
先加入少量KClO3溶液,再加AgNO3溶液和足量稀硝酸,振荡
若产生白色沉淀,则样品为亚硝酸钠
B
加到少量KMnO4溶液中,再加硫酸酸化,振荡
若溶液褪色,则样品为亚硝酸钠
C
先加到少量FeCl2溶液中,再加入稀盐酸酸化,振荡
若溶液变黄色,则样品为亚硝酸钠
D
先加入少量Na2SO3溶液,再加入BaCl2溶液和稀硝酸,振荡
若产生白色沉淀,则样品为亚硝酸钠
选项
实验目的
实验及现象
结论
A.(2022·全国甲卷,13B)
检验铁锈中是否含有二价铁
将铁锈溶于浓盐酸,滴入KMnO4溶液,紫色褪去
铁锈中含有二价铁
B.(2021·浙江6月选考,25D)
探究Na2SO3固体样品是否变质
取少量待测样品溶于蒸馏水,加入足量稀盐酸,再加入足量BaCl2溶液,有白色沉淀产生
样品已经变质
C.(2022·全国甲卷,13D)
检验乙醇中是否含有水
向乙醇中加入一小粒金属钠,产生无色气体
乙醇中含有水
D.(2019·江苏,13A)
检验X溶液中是否含有Fe2+
向X溶液中滴加几滴新制氯水,振荡,再加入少量KSCN溶液,溶液变为红色
X溶液中一定含有Fe2+
选项
实验操作
现象
结论
A
向NaBr溶液中滴加过量氯水,再加入淀粉-KI溶液
先变橙色,后变蓝色
氧化性:Cl2>Br2>I2
B
向蔗糖溶液中滴加稀硫酸,水浴加热,加入新制的Cu(OH)2悬浊液
无砖红色沉淀
蔗糖未发生水解
C
石蜡油加强热,将产生的气体通入Br2的CCl4溶液
溶液由红棕色变无色
气体中含有不饱和烃
D
加热试管中的聚氯乙烯薄膜碎片
试管口湿润的蓝色石蕊试纸变红
氯乙烯加聚是可逆反应
选项
实验操作和现象
结论
A
向淀粉溶液中加适量20%H2SO4溶液,加热,冷却后加NaOH溶液至中性,再滴加少量碘水,溶液变蓝
淀粉未水解
B
室温下,向0.1 ml·L-1 HCl溶液中加入少量镁粉,产生大量气泡,测得溶液温度上升
镁与盐酸反应放热
C
室温下,向浓度均为0.1 ml·L-1的BaCl2和CaCl2混合溶液中加入Na2CO3溶液,出现白色沉淀
白色沉淀是BaCO3
D
向0.1 ml·L-1 H2O2溶液中滴加0.01 ml·L-1 KMnO4溶液,溶液褪色
H2O2具有氧化性
待检验物质
所用试剂
A
海水中的碘元素
淀粉溶液
B
SO2气体
澄清石灰水
C
溶液中的Cu2+
氨水
D
溶液中的NHeq \\al(+,4)
NaOH溶液,湿润的蓝色石蕊试纸
实验
现象
结论
A.某溶液中滴加K3[Fe(CN)6]溶液
产生蓝色沉淀
原溶液中有Fe2+,无Fe3+
B.向C6H5ONa溶液中通入CO2
溶液变浑浊
酸性:H2CO3>C6H5OH
C.向含有ZnS和Na2S的悬浊液中滴加CuSO4溶液
生成黑色沉淀
Ksp(CuS)<Ksp(ZnS)
D.①某溶液中加入Ba(NO3)2溶液
②再加足量盐酸
①产生白色沉淀
②仍有白色沉淀
原溶液中有SOeq \\al(2-,4)
选项
实验操作
实验现象
结论
A
将浓硫酸滴到纸上
纸张变黑
浓硫酸具有吸水性
B
测定等浓度的Na2CO3和Na2SO3溶液的pH
前者pH比后者大
非金属性:S>C
C
向2.0 mL浓度均为0.1 ml·L-1的KCl、KI的混合溶液中滴加1~2滴0.01 ml·L-1 AgNO3溶液,振荡
沉淀呈黄色
Ksp(AgCl)>Ksp(AgI)
D
将甲醇和过量酸性高锰酸钾溶液混合
紫红色褪去或变浅
甲醇被氧化成甲酸
选项
实验操作
现象
推论
A
常温下将Ba(OH)2·8H2O 晶体与NH4Cl晶体在小烧杯中混合
烧杯壁变凉
该反应的熵变ΔS<0
B
往盛有1 mL 0.1 ml·L-1 MgCl2溶液的试管中加入4 mL 0.1 ml·L-1 NaOH溶液,再滴加2滴0.1 ml·L-1 FeCl3溶液
先有白色沉淀生成,后有红褐色沉淀生成
Ksp[Fe(OH)3]<Ksp [Mg(OH)2]
C
用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热
熔化后的铝滴落下来
铝的熔点较低
D
取5 mL 0.1 ml·L-1 KI溶液与1 mL 0.1 ml·L-1 FeCl3溶液混合,充分反应后,滴加少量KSCN溶液
溶液变为红色
化学反应存在限度
选项
实验操作及现象
结论
A
加热NaI固体和浓磷酸的混合物,有气体产生
浓磷酸的酸性强于氢碘酸
B
分别在20 ℃、30 ℃下,取0.1 ml·L-1 KI溶液,向其中先加入0.1 ml·L-1的硫酸,再加入淀粉溶液,发生反应4H++O2+4I-===2I2+2H2O
探究反应速率与温度的关系
C
将SO2通入Ca(ClO)2溶液,出现白色沉淀
SO2是酸性氧化物
D
探究氧化铁和乙醇反应得到黑色固体成分,该黑色固体能被磁铁吸引且加入足量稀盐酸,振荡,固体全部溶解,未观察到有气体生成
不能确定是否含有0价铁
选项
实验操作及现象
结论
A
向2 mL 0.1 ml·L-1 NaOH溶液中滴加3滴0.1 ml·L-1 MgSO4溶液,再滴加0.1 ml·L-1 CuSO4溶液,先生成白色沉淀,后生成浅蓝色沉淀
Cu(OH)2的溶度积比Mg(OH)2的小
B
向某溶液中滴加K3[Fe(CN)6]溶液,产生蓝色沉淀
原溶液中有Fe2+
C
向盛有酸性高锰酸钾溶液的试管中通入足量的乙烯后静置,溶液的紫红色逐渐褪去,溶液分层
乙烯发生了氧化反应
D
探究浓度对反应速率的影响,向2支盛有5 mL不同浓度NaHSO3溶液的试管中同时加入2 mL 5% H2O2溶液,观察实验现象
反应物浓度越大,反应速率越快
选项
实验操作及现象
结论
A
用pH试纸测得:CH3COONa溶液的pH约为9,NaNO2溶液的pH约为8
HNO2电离出H+的能力比CH3COOH的强
B
向待测溶液中加入淀粉溶液,无明显变化,再加入新制氯水,变蓝
待测溶液中有I-存在
C
向Al2(SO4)3溶液中逐滴加入NaOH溶液至过量,先生成白色沉淀,后沉淀消失
Al(OH)3具有酸性
D
向AgCl悬浊液中,加入少量Na2S溶液,白色沉淀转化为黑色沉淀
Ag2S溶解度小于AgCl
选项
实验目的
实验方案
A
证明铜与浓硫酸反应生成了SO2
将铜单质与浓硫酸在试管中加热,产生的气体通入石蕊溶液,观察石蕊是否变红
B
检验稀硫酸催化纤维素水解的产物含有还原糖
向水解后的溶液中加入新制的Cu(OH)2,加热,观察是否有砖红色沉淀生成
C
检验Na2SO3是否变质
向Na2SO3溶液中加入Ba(NO3)2和稀硝酸,观察是否产生白色沉淀
D
证明1-溴丁烷发生了消去反应
将1-溴丁烷与NaOH醇溶液共热,将产生的气体通入溴水,观察溴水是否褪色
选项
实验操作和现象
结论
A
将乙醇与浓H2SO4混合加热,将产生的气体通入酸性KMnO4溶液,溶液紫红色褪去
产生的气体中一定含有乙烯
B
向苯酚浊液中滴加碳酸钠溶液,浊液变澄清
苯酚的酸性强于碳酸的酸性
C
向1-溴丙烷中加入KOH溶液,加热几分钟,冷却后再加入AgNO3溶液,无淡黄色沉淀生成
1-溴丙烷没有水解
D
向20%蔗糖溶液中加入稀硫酸加热,再加入NaOH溶液调成碱性,再加入银氨溶液水浴加热,出现银镜
蔗糖水解产物具有还原性
选项
实验操作和现象
结论
A
用乙酸浸泡水壶中的水垢,可将其清除
乙酸的酸性弱于碳酸的酸性
B
室温下,向浓度均为0.1 ml·L-1 BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀
Ksp(BaSO4)<Ksp(CaSO4)
C
甲烷与氯气在光照条件下反应后的混合气体能使湿润的蓝色石蕊试纸变红
生成的氯代物具有酸性
D
室温下,用pH试纸测得0.1 ml·L-1 Na2SO3溶液的pH为10,0.1 ml·L-1 NaHSO3溶液的pH约为5
HSOeq \\al(-,3)结合H+的能力比SOeq \\al(2-,3)的弱
选项
实验操作及现象
实验结论
A
将水蒸气通过灼热的铁粉,粉末变红褐色
铁与水在高温下发生反应
B
向3 mL KI溶液中滴加几滴溴水,振荡,再滴加1 mL淀粉溶液,溶液显蓝色
Br2的还原性比I2的强
C
将某气体通入酸性高锰酸钾溶液中,溶液紫红色褪去
该气体具有还原性
D
用pH试纸测定NaClO溶液的酸碱性,试纸显蓝色
NaClO水解显碱性
选项
实验目的
实验操作及现象
A
证明丙烯醛(CH2==CHCHO)中含有碳碳双键
取样,滴加KMnO4溶液,KMnO4溶液褪色
B
证明某溶液中含Na元素
在火焰上灼烧搅拌过该无色溶液的玻璃棒,火焰出现黄色
C
配制0.400 ml·L-1的NaOH溶液
称取4.0 g NaOH固体于烧杯中,加入少量蒸馏水溶解,转移至250 mL容量瓶中定容
D
探究SO2与HClO漂白原理的不同
加热分别用SO2和HClO漂白后的品红溶液,用SO2漂白的品红溶液恢复红色
选项
实验操作和现象
实验结论
A
向盛有氨水的烧杯中插入两个石墨电极,接通电源,电流表指针发生较大偏转
氨水是电解质
B
向某溶液中滴加稀盐酸,产生的气体通入品红溶液,品红溶液褪色
该溶液中一定含有SOeq \\al(2-,3)
C
取久置的氯水于试管中,加入几滴紫色石蕊溶液,溶液变为红色,且一段时间内不褪色
氯水已经完全变质
D
向蔗糖晶体中加入浓硫酸,轻轻搅拌,有海绵状的碳生成
浓硫酸具有吸水性
相关学案
这是一份新高考化学一轮复习精品学案10.3化学实验方案的设计与评价(含解析),共23页。
这是一份人教版高考化学一轮复习第11章化学实验基础第3节化学实验方案的设计与评价学案含答案
这是一份鲁科版高考化学一轮总复习第9章第3节化学实验方案的设计与评价课时学案,共44页。









