



所属成套资源:【期中知识点归纳】(人教版2019)2023-2024学年高二上册化学 选修1 知识点归纳 讲义
【期中知识点归纳】(人教版2019)2023-2024学年高二上册化学 选修1 第三章 水溶液中的离子反应与平衡 试卷.zip
展开
这是一份【期中知识点归纳】(人教版2019)2023-2024学年高二上册化学 选修1 第三章 水溶液中的离子反应与平衡 试卷.zip,文件包含期中知识点归纳人教版20192023-2024学年高二上册化学选修1第三章水溶液中的离子反应与平衡讲义学生版docx、期中知识点归纳人教版20192023-2024学年高二上册化学选修1第三章水溶液中的离子反应与平衡讲义教师版docx等2份试卷配套教学资源,其中试卷共54页, 欢迎下载使用。
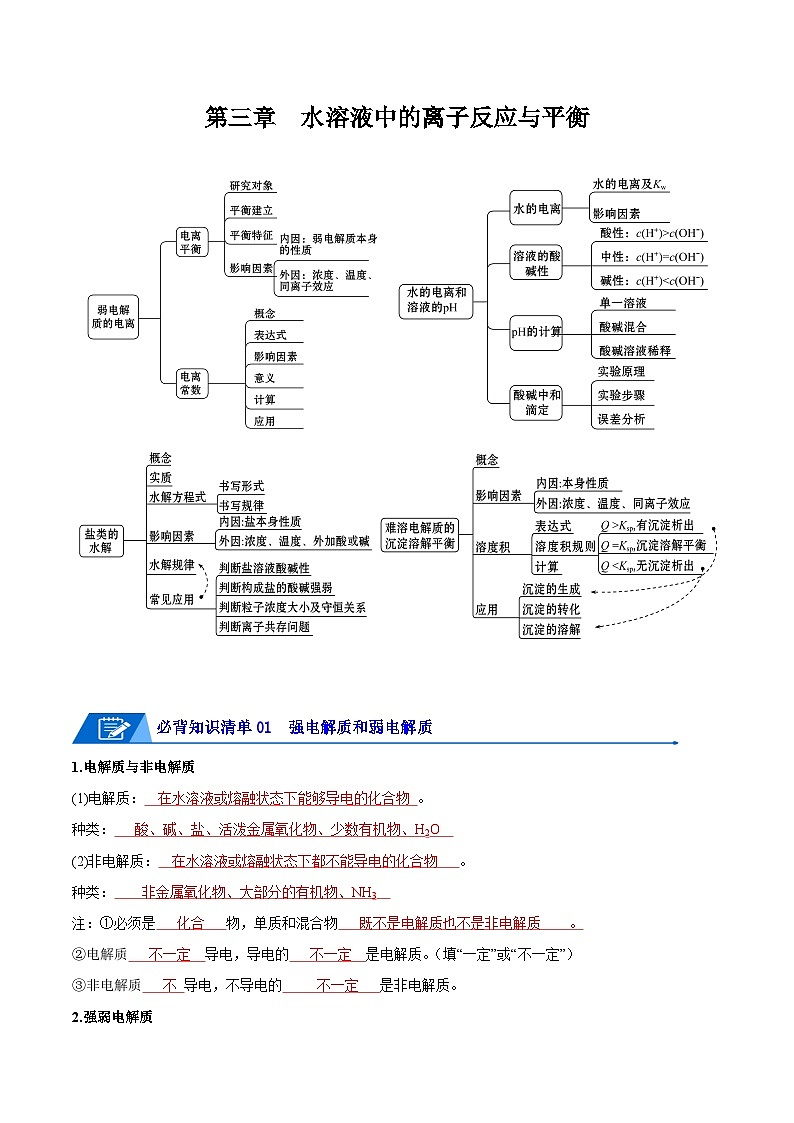
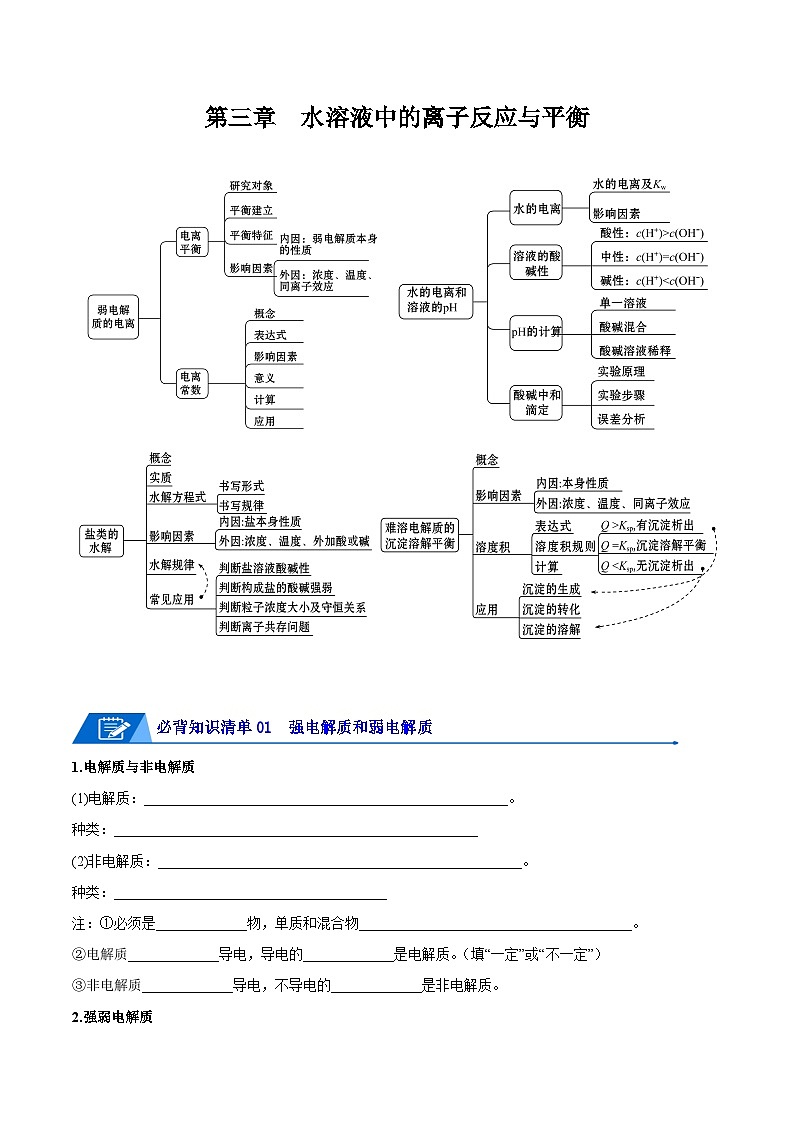
第三章 水溶液中的离子反应与平衡
必背知识清单01 强电解质和弱电解质
1.电解质与非电解质
(1)电解质:____________________________________________________。
种类:____________________________________________________
(2)非电解质:____________________________________________________。
种类:_______________________________________
注:①必须是_____________物,单质和混合物_______________________________________。
②电解质_____________导电,导电的_____________是电解质。(填“一定”或“不一定”)
③非电解质_____________导电,不导电的_____________是非电解质。
2.强弱电解质
(1)强电解质:①定义:在水溶液中能够_____________电离的电解质。
②特点:___________电离,只有___________,无___________,不可逆,电离方程式用“_________”连接
③类别:强酸:_______________________________________
强碱:__________________________
大部分盐(包括难溶盐)、活泼金属氧化物
(2)弱电解质:①定义:在水溶液中能够_____________电离的电解质。
②特点:_____________电离,既有_____________又有_____________,可逆,存在_____________,电离方程式用“ ”连接
③类别:_____________
注:①电解质的强弱与_____________无关,与溶液的_____________无必然联系
②电解质的导电性与溶液中自由移动的_____________有关,自由移动的离子浓度越大,离子所带电荷数越多,导电性_____________
(3)强电解质与弱电解质的比较
强电解质
弱电解质
概念
在水溶液中能_____________电离的电解质
在水溶液中只能_____________电离的电解质
电解质在溶液中的存在形式
只有_____________
既有___________,又有电解质___________
化合物类型
离子化合物、部分共价化合物
共价化合物
实例
①多数盐(包括难溶性盐);
②强酸,如HCl、H2SO4等;
③强碱,如KOH、Ba(OH)2等
①弱酸,如CH3COOH、HClO等;
②弱碱,如NH3·H2O等;
③水
3.电离方程式的书写
(1)原则:遵循__________________________
(2)书写: 多元弱酸_____________电离,以第_____________步电离为主,_____________书写;
多元弱碱_____________电离,_____________书写
(3)常见物质电离方程式的书写:
①NaCl:__________________________
②CH3COONH4:__________________________
③Na2CO3:__________________________
④NaHCO3:__________________________
⑤NaHSO4:在水溶液中:__________________________
在熔融状态下:__________________________
⑥CH3COONa:_______________________________________
⑦NaHS:____________________________________________________
⑧KHSO3:____________________________________________________
⑨NH4Cl:____________________________________________________
⑩CaCO3:____________________________________________________
(11)AgCl:____________________________________________________
(12)BaSO4:____________________________________________________
(13)HCl:____________________________________________________
(14)HNO3:____________________________________________________
(15)H2SO4:____________________________________________________
(16)HBr:____________________________________________________
(17)HI:____________________________________________________
(18)HClO4:____________________________________________________
(19)NaOH:____________________________________________________
(20)KOH:____________________________________________________
(21)Ba(OH)2:____________________________________________________
(22)CH3COOH:____________________________________________________
(23)HF:____________________________________________________
(24)HClO:____________________________________________________
(25)H2CO3:____________________________________________________
(26)H2SO3:____________________________________________________
(27)H2S:____________________________________________________
(28)H2C2O4:____________________________________________________
(29)H3PO4:_________________________________________________________________
(30)NH3·H2O:____________________________________________________
(31)Cu(OH)2:____________________________________________________
(32)Mg(OH)2:____________________________________________________
(33)Fe(OH)3:_______________________________________
(34)Al(OH)3: 碱式电离:____________________________________________________
酸式电离:_______________________________________
(35)H2O:___________________________________或______________________________________
必背知识清单02 弱电解质的电离平衡
1.电离平衡状态
(1)概念:在一定条件(如温度、浓度)下,弱电解质分子_______________________________________与_______________________________________相等,溶液中各分子和离子的浓度都不再发生变化,电离过程就达到了电离平衡状态。
(2)建立过程
(3)电离平衡的特征
2.电离平衡的影响因素
(1)温度:弱电解质的电离一般是_____________过程,升高温度使电离平衡向_____________的方向移动,电离程度_____________。
(2)浓度:在一定温度下,同一弱电解质溶液,浓度越小,离子相互碰撞结合为分子的几率_____________,电离程度_____________。
(3)同离子效应:加入与弱电解质具有相同离子的电解质时,可使电离平衡向结合成弱电解质分子的方向移动,电离程度_____________。
(4)化学反应:加入能与弱电解质电离出的离子发生反应的离子时,电离平衡向_____________方向移动。
举例:以醋酸电离为例:CH3COOH(aq) CH3COO-(aq)+H+(aq) ΔH>0
改变条件
平衡移动方向
电离程度
n(H+)
c(H+)
c(CH3COO-)
导电能力
加水稀释
正向
_____________
增大
减小
减小
减弱
加入少量冰醋酸
正向
_____________
增大
增大
增大
增强
通入HCl(g)
逆向
_____________
增大
增大
减小
增强
加入NaOH(s)
正向
_____________
减小
减小
增大
增强
加入镁粉
正向
_____________
减小
减小
增大
增强
升高温度
正向
_____________
增大
增大
增大
增强
加入CH3COONa(s)
逆向
_____________
减小
减小
增大
增强
加入NaCl(s)
不移动
_____________
不变
不变
不变
增强
3.电离平衡常数
(1)定义:在一定条件下,达到电离平衡时,__________________________与__________________________比是一个常数,这个常数称为电离平衡常数,简称电离常数。一般弱酸用_____________表示,弱碱用_____________表示
(2)表达式:以ABA++B-为例,则_____________
注:在计算电离平衡常数时,弱电解质分子的浓度,常用_____________浓度代替_____________浓度进行忽略计算
(3)影响因素:
①__________________________
②只受_____________影响,升高温度,电离平衡常数_____________,电离程度_____________
(4)意义:相同条件下,K值越大,表示该弱电解质越_____________电离,所对应溶液的酸性或碱性越_____________
(5)说明:
多元弱酸是分步电离的,每一步都有相应的K,对于同一种弱酸的K1、K2、K3,总有K1_____________K2_____________K3,即电离程度逐渐_____________。这是因为上一级电离产生的H+,对下一级电离起到_____________作用。所以计算多元弱酸溶液的c(H+)或比较弱酸酸性相对强弱时,通常只考虑第_____________步电离
4.电离度
(1)定义:弱电解质在溶液中达到电离平衡状态时,已电离的电解质分子数占原有电解质分子总数(包括已电离和未电离)的百分率,称为电离度。
(2)表达式:电离度通常用ɑ表示。
(3)意义:电离度实质上表示的是弱电解质达到电离平衡时的转化率,即表示弱电解质在水中的电离程度。
特别提示:
①温度相同,浓度相同时,不同弱电解质的电离度不同。若不同的一元弱酸的电离度越大,表示其酸性相对越强。
②同一弱电解质的浓度不同,电离度也不同,溶液越稀,电离度越大。
必背知识清单03 水的电离
1.水的电离
(1)电离方程式:__________________________或__________________________
(2)特点:①_____________电离
②_____________过程,_____________热
③25℃,水中的c(H+)=c(OH-)=_____________mol/L
④由水电离出的H+与OH-浓度_____________,即c(H+)水_____________c(OH-)水
(3)影响因素:
促进:____________________________________________________
抑制:____________________________________________________
水的电离H2OH++OH- ΔH>0
条件变化
移动方向
c(H+)
c(OH-)
Kw
程度
影响
升高温度
右移
增大
增大
增大
________
促进
加酸
左移
增大
减小
不变
________
抑制
加碱
左移
减小
增大
不变
________
抑制
加活泼金属如Na
右移
减小
增大
不变
________
促进
2.水的离子积
(1)定义:当水的电离达到平衡时,电离产物_____________和_____________浓度之积是一个常数,称为水的离子积常数,简称水的离子积,用_____________表示。
(2)表达式:Kw=_____________
说明:①Kw不仅适用于纯水,也适用于酸、碱、盐的稀溶液
酸溶液中:Kw= _____________
碱溶液中:Kw=_____________
盐溶液中:Kw= _____________
②不同溶液中的c(H+)、c(OH-)可能 _____________同,但任何溶液中的c(H+)水_____________c(OH-)水
③25℃时,水中的c(H+)=c(OH-)=_____________mol/L,Kw=_____________
100℃时,水中的c(H+)=c(OH-)≈_____________mol/L,Kw=_____________
④Kw只与_____________有关,温度升高,Kw_____________,水更_____________电离
必背知识清单04 溶液的酸碱性与pH
1.溶液的酸碱性
(1)讨论探究(常温下,利用平衡移动原理分析完成下表):
体系
c(H+)变化
c(OH-)变化
c(H+)与c(OH-)的关系
纯水
c(H+) __________c(OH-)
纯水中加入少量盐酸
_____________
_____________
c(H+) _________c(OH-)
纯水中加入少量氢氧化钠溶液
_____________
_____________
c(H+) _________c(OH-)
(2)结论:在任意溶液中,
c(H+) _________c(OH-),溶液呈中性;
c(H+) _________c(OH-),溶液呈酸性,c(H+)越大,酸性越强;
c(H+) _________c(OH-),溶液呈碱性,c(OH-)越大,碱性越强。
2.溶液的pH
(1)c(H+)、pH与溶液酸碱性的关系。
25 ℃时,溶液中c(H+)、pH与酸碱性的关系如图所示:
溶液
性质
c(H+)与c(OH-)
c(H+)/(mol·L-1)
pH(25 ℃)
任意温度
25 ℃
中性
c(H+)=c(OH-)
c(H+)=
c(H+)=1×10-7
pH=7
酸性
c(H+)>c(OH-)
c(H+)>
c(H+)>1×10-7
pHa>b。
(2)同一溶液中不同离子浓度的大小比较。
(3)混合溶液中各离子浓度的比较。
根据电离程度、水解程度的相对大小分析。
①分子的电离大于相应离子的水解:
例如:等物质的量浓度的NH4Cl与NH3·H2O混合溶液中,c(NH)>c(Cl-)>c(NH3·H2O)>c(OH-)>c(H+)。
②分子的电离小于相应离子的水解:
例如:在0.1 mol·L-1的NaCN和0.1 mol·L-1的HCN溶液的混合液中,各离子浓度的大小顺序为c(HCN)>c(Na+)>c(CN-)>c(OH-)>c(H+)。
(4)抓“四点”,突破酸碱中和滴定曲线中的粒子浓度关系:
①抓反应“一半”点,判断是什么溶质的等量混合。
②抓“恰好”反应点,生成的溶质是什么,判断溶液的酸碱性。
③抓溶液的“中性”点,生成什么溶质,哪种物质过量或不足。
④抓反应的“过量”点,溶液中的溶质是什么,判断哪种物质过量。
实例分析:向CH3COOH溶液中逐滴加入NaOH溶液,溶液pH与加入NaOH溶液的关系如图所示:
(注:a点为反应一半点,b点呈中性,c点恰好完全反应,d点NaOH过量一倍)
分析:
a点,溶质为CH3COONa CH3COOH
离子浓度关系:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
b点,溶质为CH3COONa CH3COOH
离子浓度关系:c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
c点,溶质为CH3COONa
离子浓度关系:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
d点,溶质为CH3COONa NaOH
离子浓度关系:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
七、沉淀溶解平衡的再理解
1.难溶电解质的溶解平衡与弱电解质的电离平衡的区别:
区别角度
沉淀溶解平衡
电离平衡
物质类别
难溶电解质可以是强电解质也可以是弱电解质
难电离物质只能是弱电解质
变化
过程
已溶解溶质与未溶解溶质之间形成的沉淀与溶解的平衡状态
溶解的弱电解质分子与离子之间的转化达到的平衡状态
表示方法
如Al(OH)3:Al(OH)3(s)Al3+(aq)+3OH-(aq)
如Al(OH)3:Al(OH)3Al3++3OH-
2.影响溶解平衡的因素:
3.比较难溶电解质在水中的溶解能力:
—
—
4.判断给定条件下沉淀能否生成或溶解:
判断依据
结论
Q>Ksp
溶液过饱和,有沉淀析出
Q=Ksp
溶液饱和,沉淀与溶解处于平衡状态
Q
相关试卷
这是一份【期中知识点归纳】(苏教版2019)2023-2024学年高二上册化学 选修1 专题2 化学反应速率与化学平衡 讲义,文件包含期中知识点归纳苏教版20192023-2024学年高二上册化学选修1专题2化学反应速率与化学平衡讲义教师版docx、期中知识点归纳苏教版20192023-2024学年高二上册化学选修1专题2化学反应速率与化学平衡讲义学生版docx等2份试卷配套教学资源,其中试卷共50页, 欢迎下载使用。
这是一份【期中知识点归纳】(人教版2019)2023-2024学年高二上册化学 选修1 第二章 化学反应速率与化学平衡 试卷.zip,文件包含期中知识点归纳人教版20192023-2024学年高二上册化学选修1第二章化学反应速率与化学平衡讲义学生版docx、期中知识点归纳人教版20192023-2024学年高二上册化学选修1第二章化学反应速率与化学平衡讲义教师版docx等2份试卷配套教学资源,其中试卷共33页, 欢迎下载使用。
这是一份【期中知识点归纳】(人教版2019)2023-2024学年高二上册化学 选修1 第一章 化学反应的热效应 试卷.zip,文件包含期中知识点归纳人教版20192023-2024学年高二上册化学选修1第一章化学反应的热效应讲义学生版docx、期中知识点归纳人教版20192023-2024学年高二上册化学选修1第一章化学反应的热效应讲义教师版docx等2份试卷配套教学资源,其中试卷共27页, 欢迎下载使用。