





化学第二节 分子的空间结构优质课第二课时教案设计
展开(人教版高中化学选择性必修2)
《分子的空间结构》第二课时 教学设计
课题名 | 《分子的空间结构 》第二课时 |
教材分析 | 本节内容介绍杂化轨道理论,一是介绍了杂化理论的主要内容,二是运用杂化理论去解释分子的空间构型。教材以学生熟悉的甲烷分子空间结构为例,引入杂化轨道理论,通过图片的呈现方式,介绍了sp3、sp2、sp杂化,给出了杂化后杂化轨道的电子云形状。有了杂化轨道理论后,运用该理论可以确定分子的中心原子的杂化轨道类型,从而解释分子的空间结构。 |
核心素养 | 宏观辨识与微观探析:通过杂化轨道理论的学习,能从微观角度理解中心原子的杂化类型对分子空间结构的影响。 证据推理与模型认知:通过杂化轨道理论的学习,掌握中心原子杂化轨道类型判断的方法,建立分子空间结构分析的思维模型。 科学探究与创新意识:认识科学探究是进行科学解释和发展、创造和应用的科学实践活动。 |
教学重点 | 理解杂化轨道理论,能对分子空间结构进行解释,能判断共价分子或离子中的杂化类型。 |
教学难点 | 理解杂化轨道理论,能对分子空间结构进行解释,能判断共价分子或离子中的杂化类型。 |
教学方法 | 讲解,举例 |
教学准备 | 教师准备:PPT 学生准备:预习课本 |
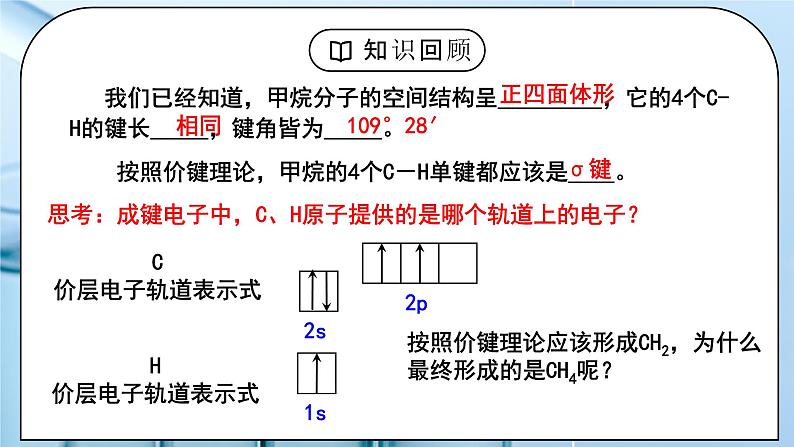
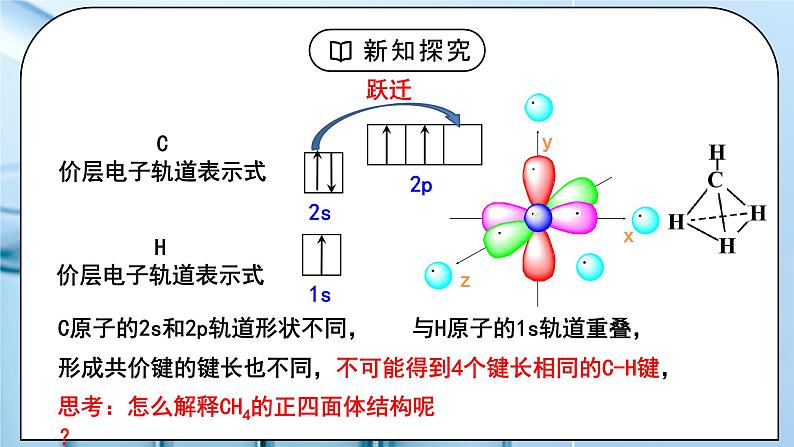
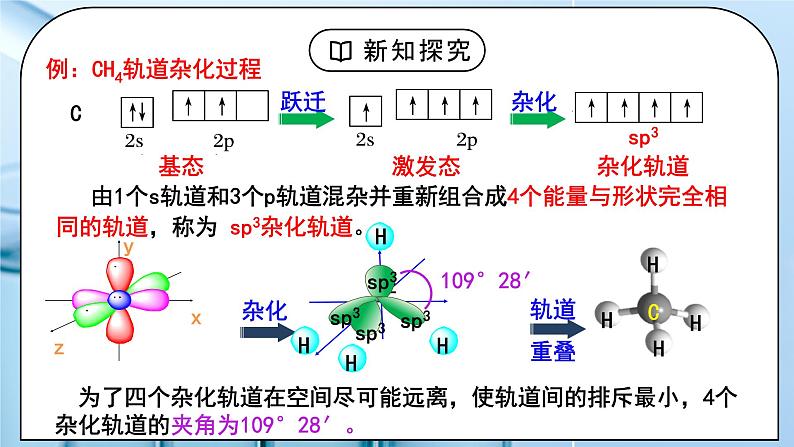
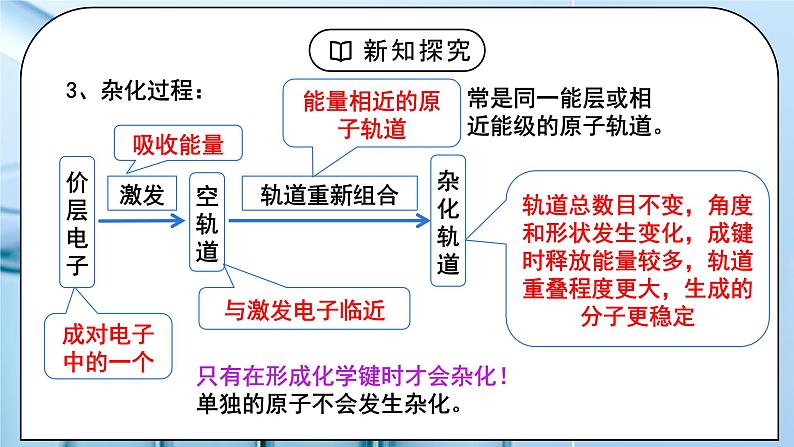
教学过程 | 一、新课导入 1.甲烷的4个C-H单键的形成 教师:我们已经知道,甲烷分子的空间结构呈_________,它的4个C-H的键长_____,键角皆为_____。 学生: 思考:成键电子中,C、H原子提供的是哪个轨道上的电子? [设计意图]通过甲烷的4个C-H单键的形成过程分析,引出杂化轨道理论。 二、探究新知 1.一、杂化轨道理论 教师:杂化轨道理论是一种价键理论,是鲍林为了解释分子的立体构型提出的。 1.原子轨道的杂化 在外界条件的影响下,原子内部能量相近的原子轨道发生混杂,重新组合成一组新的轨道的过程。 注意:“双原子分子中不存在杂化过程”。 2.杂化轨道 原子轨道杂化后形成的一组新的原子轨道,叫做杂化原子轨道,简称杂化轨道。 例:CH4轨道杂化过程 由1个s轨道和3个p轨道混杂并重新组合成4个能量与形状完全相同的轨道,称为 sp3杂化轨道。 为了四个杂化轨道在空间尽可能远离,使轨道间的排斥最小,4个杂化轨道的夹角为109°28′。 3、杂化过程: 4、杂化的特点: ①杂化前后轨道数目不变 ②能量相近的原子轨道才能形成杂化轨道,常是同一能级或相近能级的原子轨道。 ③杂化后轨道形状、方向发生改变,成键能力增强 ④杂化轨道之间要满足最小排斥、最大夹角原理 ⑤杂化轨道只用于形成σ键和容纳孤电子对,未参与杂化的p轨道可用于形成π键。 学生:学习杂化轨道理论的内容和杂化特点。 [设计意图]通过学习杂化轨道理论的内容和杂化特点,引人杂化类型的学习。 2.二、杂化的类型 教师: 1、sp3杂化 1个s轨道和3个p轨道杂化而得到4个sp3杂化轨道 sp3杂化轨道间的夹角是_______,空间结构为_________。 2、sp2杂化 1个s轨道和2个p轨道杂化而得到3个sp2杂化轨道 sp2杂化轨道间的夹角是_____,空间结构为_________。 sp2杂化后,未参与杂化的一个np轨道可以用于形成π键,如:乙烯分子碳碳双键的形成。 乙烯中sp2杂化C原子成键过程: 3、sp杂化 1个s轨道和1个p轨道杂化而得到2个sp杂化轨道 sp杂化轨道间的夹角是_____,空间结构为_________。 sp杂化后,未参与杂化的两个np轨道可以用于形成π键,如乙炔分子中的碳碳三键的形成。 乙炔中sp杂化C原子成键过程: 价层电子对数=杂化轨道数(x),中心原子采取 spx-1 杂化 中心原子的杂化轨道类型与VSEPR模型有什么联系?填写下表,回答问题。 中心原子的杂化轨道模型与VSEPR模型相同。 学生:学习杂化的类型。 [设计意图]掌握杂化的类型。 3.三、判断中心原子的杂化类型 教师: 1、计算价层电子对数=σ键电子对数+中心原子孤电子对数 杂化轨道数(x)=价层电子对数,中心原子采取 spx-1 杂化 2、根据分子空间构型或键角 四面体形 sp3 109° 三角锥形 sp3 107° 平面三角形 sp2 120° V形 sp3或sp2 105° 直线形 sp 180° 3、有机物中碳原子杂化类型判断方法 单键碳原子采取sp3杂化; 双键碳原子采取sp2杂化; 三键碳原子采取sp杂化。 思考:苯分子中的碳原子是什么杂化类型? 学生: 练习1、下列分子的空间结构可用sp2杂化轨道来解释的是( ) ①BF3 ②CH2=CH2 ③CH≡CH ④NH3 ⑤CH4 A.①② B.①⑤⑥ C.②③④ D.③⑤⑥ 练习2、下列说法中正确的是( ) A.PCl3分子呈三角锥形,是P原子采取sp2杂化的结果 B.sp3杂化轨道是由任意的1个s轨道和3个p轨道混合形成的四个sp3杂化轨道 C.凡中心原子采取sp3杂化的分子,其VSEPR模型都是四面体 D.AB3型的分子立体构型必为平面三角形 练习4、 “三鹿奶粉事件”在社会上引起了人们对食品质量的恐慌,三鹿奶粉中掺杂了被称为“蛋白精”的工业原料三聚氰胺。已知三聚氰胺的结构简式如图所示。三聚氰胺是氰胺(H2N—C≡N)的三聚体,请回答下列问题: (1) 写出基态碳原子的电子排布式:____________。 (2) 三聚氰胺环状结构中的氮原子和氨基中的氮原子,这三种氮原子的杂化轨道类型分别是_____、______。 (3) 一个三聚氰胺分子中有_____个σ键。 [设计意图]学生能判断中心原子的杂化类型,并能用杂化理论解释粒子的结构。 |
板书设计 | 一、杂化轨道理论 二、杂化的类型 1、sp3杂化 2、sp2杂化 3、sp杂化 三、判断中心原子的杂化类型 |
课后作业 |
练习册上相关习题。 |
教学反思 | 亮点:本节内容介绍杂化轨道理论,一是介绍了杂化理论的主要内容,二是运用杂化理论去解释分子的空间构型。要求学生结合实例了解共价分子具有特定的空间结构,并利用杂化理论进行解释。 课堂教学建议:让学生了解杂化轨道的形成过程,结合具体的共价分子或离子分析中心原子的杂化类型,从而解释分子或离子的构型。 |
人教版 (2019)选择性必修2第三章 晶体结构与性质第四节 配合物与超分子精品教学设计及反思: 这是一份人教版 (2019)选择性必修2第三章 晶体结构与性质第四节 配合物与超分子精品教学设计及反思,文件包含核心素养人教版高中化学选修二《配合物与超分子》课件pptx、核心素养人教版高中化学选修二《配合物与超分子》教学设计含教学反思docx等2份教案配套教学资源,其中教案共12页, 欢迎下载使用。
高中化学人教版 (2019)选择性必修2第二节 分子晶体与共价晶体优质第二课时教学设计: 这是一份高中化学人教版 (2019)选择性必修2第二节 分子晶体与共价晶体优质第二课时教学设计,文件包含核心素养人教版高中化学选修二《分子晶体与共价晶体》第二课时课件pptx、核心素养人教版高中化学选修二《分子晶体与共价晶体》第二课时教学设计含教学反思docx等2份教案配套教学资源,其中教案共9页, 欢迎下载使用。
高中化学人教版 (2019)选择性必修2第二节 分子晶体与共价晶体优质第一课时教案: 这是一份高中化学人教版 (2019)选择性必修2第二节 分子晶体与共价晶体优质第一课时教案,文件包含核心素养人教版高中化学选修二《分子晶体与共价晶体》第一课时课件pptx、核心素养人教版高中化学选修二《分子晶体与共价晶体》第一课时教学设计含教学反思docx等2份教案配套教学资源,其中教案共7页, 欢迎下载使用。














