



所属成套资源:【期中考点梳理】(苏教版2019)2023-2024学年高二上学期化学 选择性必修1 单元考点梳理
【期中考点梳理】(苏教版2019)2023-2024学年高二上学期化学 选择性必修1 专题2 化学反应速率与化学平衡 试卷
展开
这是一份【期中考点梳理】(苏教版2019)2023-2024学年高二上学期化学 选择性必修1 专题2 化学反应速率与化学平衡 试卷,文件包含期中单元知识点归纳苏教版20192023-2024学年高二上学期化学选择性必修1专题2化学反应速率与化学平衡讲义教师版docx、期中单元知识点归纳苏教版20192023-2024学年高二上学期化学选择性必修1专题2化学反应速率与化学平衡讲义学生版docx等2份试卷配套教学资源,其中试卷共50页, 欢迎下载使用。
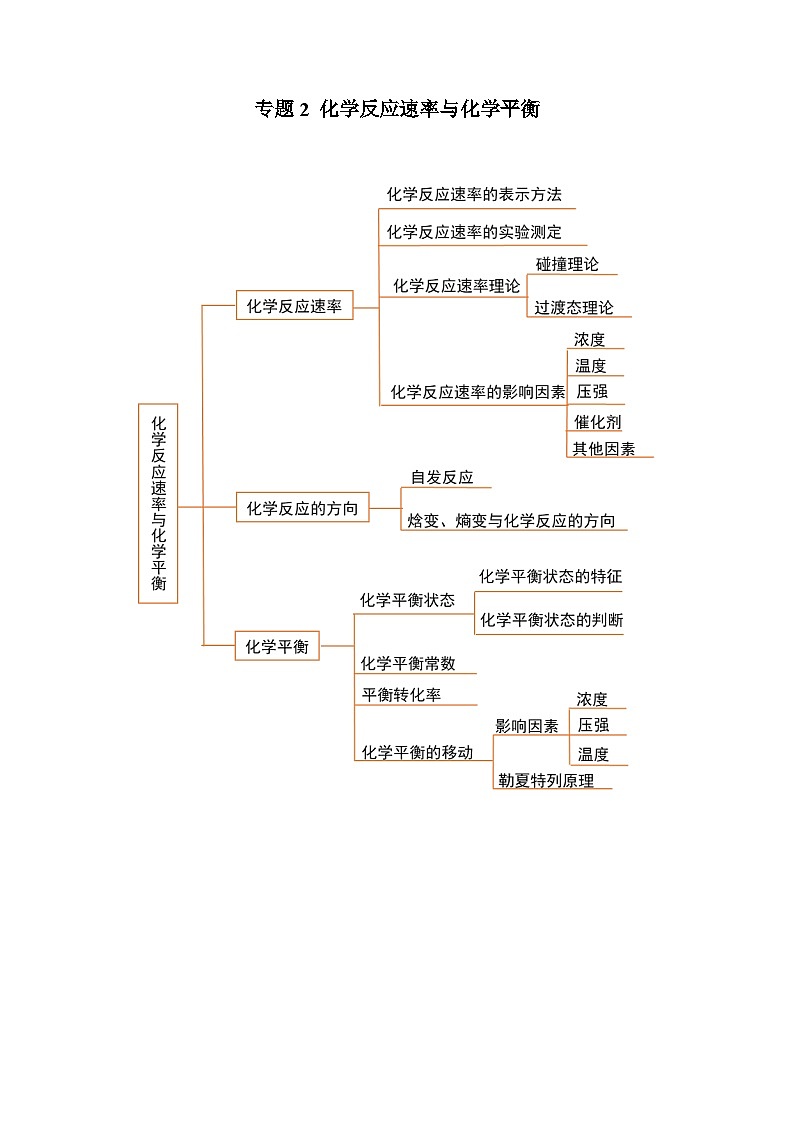
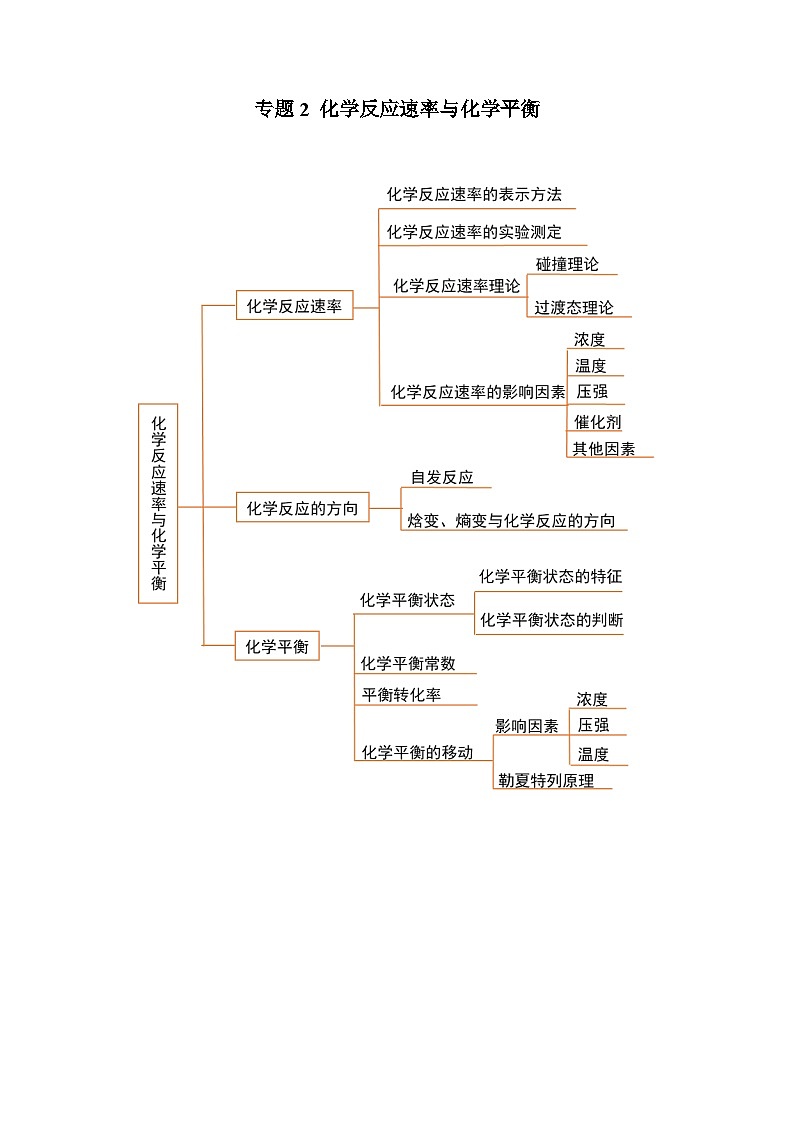
专题2 化学反应速率与化学平衡
必背知识清单01 化学反应速率
一、化学反应速率的表示方法
1.化学反应速率的表示方法
化学反应速率是衡量化学反应快慢的物理量,可以用单位时间内____________________或_________ ___________来表示化学反应速率。
数学表达式:v=__________。
Δc表示______________________________,常用单位__________。
Δt表示____________________,常用单位_____________。
常用单位:__________或__________。
用浓度变化表示化学反应速率只适用于气体和溶液中的溶质,不适用于__________和__________。
2.平均速率与瞬时速率
根据求得的反应速率是在__________内化学反应的的平均速率。
若Δt非常小,则平均速率__________某一时刻的瞬时速率,瞬时速率也可以在__________________曲线上通过数学方法求得。
3.化学反应速率与化学计量数的关系
对于化学反应:aA(g)+bB(g)===cC(g)+dD(g)
v(A)= __________,v(B)= __________,v(C)= __________,v(D)= __________
在同一化学反应中,选用不同物质表示化学反应速率,其__________可能相同也可能不相同,但表示的__________相同。
同一化学反应中,用不同反应物表示化学反应速率时,化学反应速率(v)之比__________物质的量浓度变化(Δc)之比__________物质的量变化(Δn)之比__________化学计量数之比。
二、化学反应速率的测定
1.测定原理
要测定不同反应物或生成物的浓度,可观察、测量体系中某一物质的__________,再进行适当的转换和计算。
2.常用方法
(1)测量在____________________下释放出来的体积的气体。
(2)用比色的方法测量溶液颜色的深浅,再根据溶液颜色的深浅与____________________的正比关系,确定反应物或生成物在不同时刻的浓度。
三、化学反应速率的计算模式——三段式
1.计算步骤
(1)写出正确的化学方程式
(2)标出各物质的起始量、转化量、某时刻量
(3)按要求分别计算
2.应用举例
mA(g) + nB(g) = pC(g)
起始浓度(mol/L) a b c
转化浓度(mol/L) mx nx px
某时刻浓度(mol/L) a-mx b-nx c+px
【归纳小结】化学反应速率大小的比较
在同一化学反应中,选用不同物质表示化学反应速率,其数值可能相同也可能不相同,因此,在比较化学反应速率大小时,要进行一定的转换。
(1)换算成同一种物质来表示,同时注意单位的统一。
(2)比较化学反应速率与化学计量数的比值。
如反应aA+bB=cC,要比较v(A)与v(B)的相对大小,即比较与的大小,若>,则A表示的反应速率比B大。
必背知识清单02 影响化学反应速率的因素
一、碰撞理论
1.碰撞理论
(1)碰撞理论要点:反应物分子间必须相互碰撞才有__________发生反应,反应速率的大小与______ ________________________成正比。
(2)有效碰撞的定义:能__________的碰撞。
(3)发生有效碰撞的条件:
①分子必须具有__________的能量;
②分子在________________发生碰撞。
2.活化分子与活化能
(1)活化分子:能量__________,有可能发生__________的分子。
(2)活化能:活化分子的__________与所有分子的__________之差称为活化能。
3.基元反应
(1)基元反应:反应物分子经过一__________就转化为产物分子的反应,称为基元反应,反应过程中没有任何__________生成。
(2)复杂反应:经过____________________步骤完成的反应。
(3)基元反应的活化能与反应速率的关系
每个基元反应都有对应的活化能,活化能越大,活化分子所占比例越小,有效碰撞的比例就__________,化学反应速率__________。
二、影响化学反应速率的主要因素和外部因素
1.主要因素
影响化学反应速率的主要因素是____________________。例如:金属钠与冷水剧烈反应,而镁和沸水仅能微弱反应。
2.外部因素
影响反应速率的外部因素有:__________、__________、__________、__________及________________________________________等。
三、浓度对化学反应速率的影响
1.浓度对反应速率的影响规律
其他条件相同时,增大反应物的浓度,反应速率_________;减小反应物浓度,反应速率________。
2.微观解释
增大反应物浓度,单位体积内活化分子数__________,反应物放生有效碰撞次数__________,反应速率__________ (注意:浓度改变引起了活化分子浓度的改变,而活化分子百分数不变。)
③适用对象:在溶液中的化学反应或气体反应
对于固体或纯液体,其浓度可视为__________,因而其物质的量的改变不影响化学反应速率。固体物质的反应速率与________有关,固体颗粒越小,固体反应物总表面积________,反应速率就________。
对于离子反应,只有实际参加反应的各离子浓度发生变化,才会引起化学反应速率的改变。
四、压强对化学反应速率的影响
1.压强对反应速率的影响规律
对有气体参加的反应,在密闭容器中保持温度不变时,增大压强,气体体积__________,相当于__________反应物的浓度,反应速率__________;减小压强,气体体积__________,相当于__________反应物的浓度,反应速率__________。
2.微观解释
压强对反应速率的影响,可以归结为__________改变对反应速率的影响。
3.适用对象
针对有气体参加的反应。
由于固体、液体粒子间的空隙很小,改变压强几乎不能改变它们的__________,因此对只有固体或液体参加的反应,压强的变化对于反应速率的影响可以忽略不计。
4.改变压强对反应速率影响的本质
压强的影响其本质是改变了气体的__________,从而引起化学反应速率的变化。
要注意改变压强后浓度的变化:通过改变容器的体积改变压强,反应物和生成物的浓度同时发生了改变。
如增大压强,反应物和生成物的浓度都__________,正反应速率和逆反应速率都__________;减小压强,反应物和生成物的浓度都__________,正反应速率和逆反应速率都__________。
5.不同条件下改变压强对反应速率的影响
(1)恒温恒容条件下:
①充入气体反应物→反应物浓度__________(总压__________)→反应速率__________;
②充入“惰气”(即不与反应体系中物质反应的气体)引起总压__________,但各气体的分压__________,即各气体的浓度__________,反应速率__________。
(2)恒温恒压条件下:
充入“惰气” →体积__________→各反应物浓度__________→反应速率__________。
(3)实例分析:
对于反应N2+3H22NH3,不同条件下,压强对化学反应速率的影响
(1)恒温恒容密闭容器
①充入N2,压强__________,c(N2) __________,化学反应速率__________。
②充入He(注He与反应无关),压强__________,但c(N2)、c(H2)、c(NH3)都__________,化学反应速率__________。
(2)恒温恒压密闭容器
充入He,体积__________,c(N2)、c(H2)、c(NH3)都__________,化学反应速率__________。
五、用碰撞理论解释浓度和压强对反应速率的影响
1.基元反应
(1)基元反应发生的条件
研究发现,大多数化学反应并不是经过简单碰撞就能完成的,而往往经过多个反应步骤才能实现。
如H2(g)+I2(g)===2HI(g),经历了两步基元反应:I2===2I H2+2I===2HI
每一步反应都称为基元反应,这两个先后进行的基元反应反映了2HI= H2+ I2 的反应历程。反应历程又称反应机理。
基元反应发生的条件就是要发生__________碰撞。
(2)反应物、生成物的能量与活化能的关系
如图所示,是基元反应反应物和生成物的能量与活化能的关系,其中:E1表示__________的活化能,E2表示__________的活化能;E1-E2表示__________。
2.碰撞理论解释浓度和压强对反应速率的影响
(1)浓度对反应速率的影响
在其他条件不变时,对某一反应来说,活化分子百分数是__________的,即单位体积内的活化分子数与反应物的浓度__________。当反应物的浓度增大时,单位体积内的分子数__________,单位体积内的活化分子数目__________,有效碰撞次数__________,反应速率__________。
增大浓度,单位体积内的活化分子数__________,活化分子的百分数__________。
(2)压强对反应速率的影响
对气体来说,若其他条件不变,增大压强,气体体积减小,就是__________单位体积里活化分子数,即__________反应物的浓度,因而__________化学反应的速率。
对于压强的改变,只有引起反应体系中气体反应物浓度的变化,才对反应速率产生影响。改变压强,其实质是改变了气体反应物的__________。
3.可逆反应的反应速率
可逆反应是指既向正反应方向进行,同时又向逆反应方向进行的反应,正反应的速率是反应物生成生成物的速率,逆反应速率是指生成物生成反应物的速率。
对于可逆反应来说,若增大反应物浓度,正反应速率__________,随着反应的进行,生成物浓度也__________,因此逆反应速率也__________。
若增大生成物浓度,逆反应速率__________,随着反应的进行,反应物浓度也__________,因此正反应速率也__________。即不管增大反应物浓度还是增大生成物浓度,正反应速率和逆反应速率都__________,反之亦然。
若增大压强,体积缩小,反应物和生成物浓度都________,因此正反应速率和逆反应速率都_______。反之亦然。
六、温度对反应速率的影响
1.温度变化对化学反应速率的影响
其他条件相同时,升高温度,反应速率__________;降低温度,反应速率__________。
2.用活化能理论解释:
在浓度一定时,升高温度,反应物分子的能量增大,使一部分原来能量较低的分子变成活化分子,从而__________了反应物分子中活化分子的百分数,使单位体积内活化分子数目__________,因而使反应速率__________。
此外,由于温度升高,会使分子的运动速率__________,这样单位时间里反应物分子间的碰撞次数__________,反应速率也会相应地__________。但前者是反应加快的主要原因。
3.适用对象:
温度对反应速率的影响,对放热反应和吸热反应都适用,且不受反应物状态的限制。
温度每升高10K,反应速率通常增大到原来的__________倍。
七、其他因素对化学反应速率的影响
(1)增大反应物之间的接触面积,反应速率__________。如硫酸工业中,硫铁矿在焚烧前先____________________,以增大矿石与氧气的接触面积,加快燃烧;三氧化硫吸收阶段,吸收塔填装__________,增大气液接触面积。
(2)____________________等因素,也会对化学反应速率产生影响。
八、催化剂对反应速率的影响——过渡态理论
1.过渡态理论的要点
过渡状态理论认为,化学反应不只是通过反应物分子之间简单碰撞就能完成的,而是在碰撞后先要经过一个__________的过渡状态,然后再分解为产物。
过渡状态的平均能量与反应物分子的平均能量的差为反应的__________, Ea为__________的活化能,Ea'为__________的活化能。
在过渡状态理论中,活化能的实质为反应进行所必须克服的势能垒。由此可见,过渡状态理论中活化能的定义与分子碰撞理论不同,但其含义实质上是一致的。
2.基元反应模型
(1)反应历程:一个化学反应自开始后____________________称为反应历程。
(2)基元反应的逆反应也是__________,并且经过__________过渡状态。
(3)复杂反应中的__________步骤决定了该反应的速率。
3.加入催化剂后反应历程
如图所示:反应A+B→AB的活化能为Ea,加入催化剂K后,反应分两步进行:
①A+K→AK 活化能为Ea1(慢反应)
②AK+B→AB+K 活化能为Ea2(快反应)
总反应:A+BAB 活化能为Ea1
可以看出,加入催化剂K后,两步反应的活化能Ea1和Ea2均小于原反应的活化能Ea,因此反应速率加快。仔细分析这两步反应可以看出:由于Ea1>Ea2,第1步反应是慢反应,是决定整个反应快慢的步骤,称为“定速步骤”或“决速步骤”,第1步反应越快,则整体反应速率就越快。因此对总反应来说,第一步反应的活化能Ea1就是在催化条件下总反应的活化能。
4.酶的催化作用
(1)酶的定义:酶是一种__________的、具有__________的生物催化剂。
(2)酶的催化原理
酶的催化作用是酶与反应物先形成__________,然后__________分解成产物并释放酶。
(3)酶的催化特点
①____________________;
②____________________;
③____________________。
必背知识清单03 化学反应的方向
一、自发过程和自发反应
1.自发过程
(1)自发过程是在一定条件下,____________________而自发进行的过程。
(2)特点:
①体系趋向于从__________状态转变为__________状态(体系对外部做功或者__________热量)。
②在密闭条件下,体系有从__________自发转变为__________的倾向。
2.自发反应
(1)在一定条件下能____________________的反应。
(2)特点:
具有__________,即反应的某个方向在一定条件下是自发的,而其逆方向在该条件下是肯定_______的。
一定条件指温度、光照、催化剂、压强等条件。
二、化学反应自发进行的判据
1.焓变与反应的自发性的关系
(1)焓判据:
放热反应(ΔH0
(3)焓变是一个与反应能否自发进行有关的因素,但不是决定反应能否自发进行的惟一因素。多数自发进行的化学反应是__________反应,但也有很多__________反应能自发进行,因此,反应焓变是与反应进行的方向有关的因素之一,但不是决定反应能否自发进行的唯一因素。
2.熵变与反应的自发性的关系
(1)熵的概念
自发过程的体系趋向于由__________转变为__________,体系的混乱度__________。
体系的混乱度常用熵来描述,熵的概念是衡量一个体系__________的物理量,其符号为S。熵值越大,体系的__________越大。
(2)影响熵大小的因素
①同一条件下,不同的物质熵值__________。
②同一物质的熵与其聚集状态及外界条件有关,如对同一种物质不同状态时熵值大小为S(g)_______S(l)_______S(s)。
(3)熵判据
在与外界隔离的体系中,自发过程将导致体系的熵__________,这个原理叫做熵增原理。在用熵变来判断过程的方向时,就称为熵判据。
若化学反应为熵增(ΔS>0)反应,反应过程中反应体系的混乱度__________,在一定条件下能自发进行。
(4)自发反应与熵变的关系
①许多熵增加的反应在常温、常压下可以自发进行。如:2H2O2(aq)=2H2O(l)+O2(g) ΔS>0
②有些熵增加的反应在常温、常压下不能自发进行,但在较高温度下可以自发进行。如:CaCO3(s)CaO(s)+CO2(g) ΔS>0
③少数熵减小的反应,在一定条件下也可自发进行。如:NH3(g)+HCl(g)=NH4Cl(s) ΔS
相关试卷
这是一份苏教版 (2019)选择性必修1第一单元 化学反应速率课堂检测,共10页。试卷主要包含了全卷满分100分,可能用到的相对原子质量等内容,欢迎下载使用。
这是一份苏教版 (2019)选择性必修1第一单元 化学反应速率课时训练,共23页。试卷主要包含了已知某密闭容器中发生反应,4 kJ·ml-1,2 kJ·ml-1,6 kJ·ml-1等内容,欢迎下载使用。
这是一份【期中考点梳理】(苏教版2019)2023-2024学年高二上学期化学 选择性必修1 专题1 化学反应与能量变化 试卷,文件包含期中考点梳理苏教版20192023-2024学年高二上学期化学选择性必修1专题1化学反应与能量变化讲义教师版docx、期中考点梳理苏教版20192023-2024学年高二上学期化学选择性必修1专题1化学反应与能量变化讲义学生版docx等2份试卷配套教学资源,其中试卷共46页, 欢迎下载使用。








