
2024鹤壁高三上学期第二次模拟考试(10月)化学含解析
展开2024届高三年级第二次模拟考试·化学试卷
相对原子质量:H 1 C 12 O 16 Cl 35.5 S 32 Cu 64 Cr 52 Ce 140
一、选择题:本题共14小题,每小题3分。在每小题给出的四个选项中,只有一项是符合题目要求的。
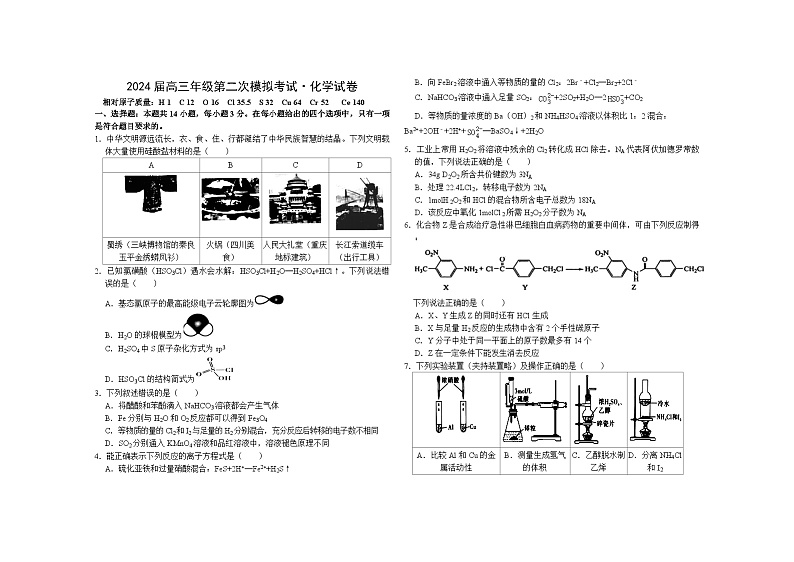
1.中华文明源远流长,衣、食、住、行都凝结了中华民族智慧的结晶。下列文明载体大量使用硅酸盐材料的是( )
A
B
C
D
蜀绣(三峡博物馆的秦良玉平金绣蟒凤衫)
火锅(四川美食)
人民大礼堂(重庆地标建筑)
长江索道缆车(出行工具)
2.已知氯磺酸(HSO3Cl)遇水会水解:HSO3Cl+H2O═H2SO4+HCl↑。下列说法错误的是( )
A.基态氯原子的最高能级电子云轮廓图为
B.H2O的球棍模型为
C.H2SO4中S原子杂化方式为sp3
D.HSO3Cl的结构简式为
3.下列叙述错误的是( )
A.将醋酸和苯酚滴入NaHCO3溶液都会产生气体
B.Fe分别与H2O和O2反应都可以得到Fe3O4
C.等物质的量的Cl2和I2与足量的H2分别混合,充分反应后转移的电子数不相同
D.SO2分别通入KMnO4溶液和品红溶液中,溶液褪色原理不同
4.能正确表示下列反应的离子方程式是( )
A.硫化亚铁和过量硝酸混合:FeS+2H+═Fe2++H2S↑
B.向FeBr2溶液中通入等物质的量的Cl2:2Br﹣+Cl2═Br2+2Cl﹣
C.NaHCO3溶液中通入足量SO2:+2SO2+H2O═2+CO2
D.等物质的量浓度的Ba(OH)2和NH4HSO4溶液以体积比1:2混合:Ba2++2OH﹣+2H++═BaSO4↓+2H2O
5.工业上常用H2O2将溶液中残余的Cl2转化成HCl除去。NA代表阿伏加德罗常数的值,下列说法正确的是( )
A.34g D2O2所含共价键数为3NA
B.处理22.4LCl2,转移电子数为2NA
C.1molH2O2和HCl的混合物所含电子总数为18NA
D.该反应中氧化1molCl2所需H2O2分子数为NA
6.化合物Z是合成治疗急性淋巴细胞白血病药物的重要中间体,可由下列反应制得:
下列说法正确的是( )
A.X、Y生成Z的同时还有HCl生成
B.X与足量H2反应的生成物中含有2个手性碳原子
C.Y分子中处于同一平面上的原子数最多有14个
D.Z在一定条件下能发生消去反应
7.下列实验装置(夹持装置略)及操作正确的是( )
A.比较Al和Cu的金属活动性
B.测量生成氢气的体积
C.乙醇脱水制乙烯
D.分离NH4Cl和I2
8.下列实验操作及现象与对应结论匹配的是( )
选项
实验操作及现象
结论
A
常温下,用pH计测得NaOH饱和溶液的pH=a,Mg(OH)2饱和溶液的pH=b
若a>b,则金属性:Na>Mg
B
向0.1mol•L﹣1FeCl3溶液中滴加碘化钾淀粉溶液,
溶液变蓝
还原性:Fe2+>I﹣
C
将浸透了石蜡油的石棉放置在硬质试管中(内有碎瓷片)并加热,将产生的气体通过酸性高锰酸钾溶液,溶液褪色
产生的气体是乙烯
D
I2能与KI反应生成KI3,向两支盛有KI3溶液的试管中分别滴加淀粉溶液和AgNO3溶液,前者变蓝,后者有黄色沉淀生成
KI3溶液中存在⇌I2+I﹣
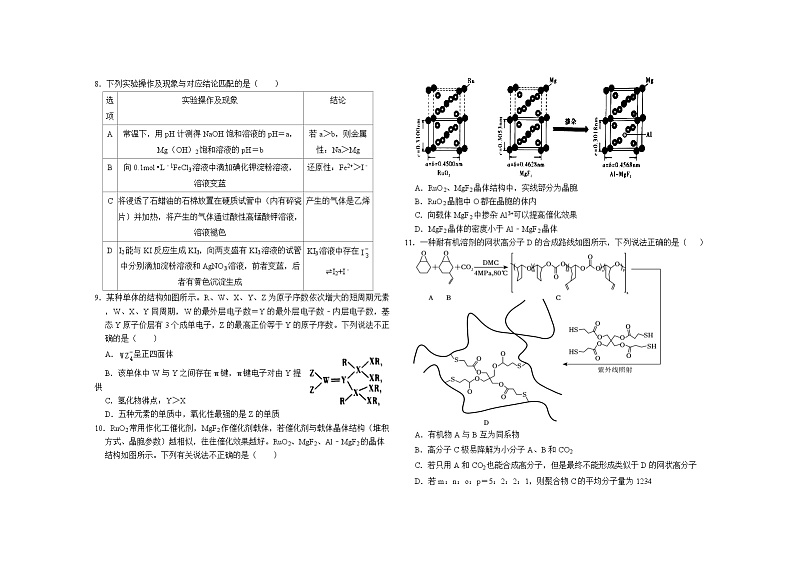
9.某种单体的结构如图所示。R、W、X、Y、Z为原子序数依次增大的短周期元素,W、X、Y同周期,W的最外层电子数=Y的最外层电子数﹣内层电子数,基态Y原子价层有3个成单电子,Z的最高正价等于Y的原子序数。下列说法不正确的是( )
A.呈正四面体
B.该单体中W与Y之间存在π键,π键电子对由Y提供
C.氢化物沸点:Y>X
D.五种元素的单质中,氧化性最强的是Z的单质
10.RuO2常用作化工催化剂,MgF2作催化剂载体,若催化剂与载体晶体结构(堆积方式、晶胞参数)越相似,往往催化效果越好。RuO2、MgF2、Al﹣MgF2的晶体结构如图所示。下列有关说法不正确的是( )
A.RuO2、MgF2晶体结构中,实线部分为晶胞
B.RuO2晶胞中O都在晶胞的体内
C.向载体MgF2中掺杂Al3+可以提高催化效果
D.MgF2晶体的密度小于Al﹣MgF2晶体
11.一种耐有机溶剂的网状高分子D的合成路线如图所示,下列说法正确的是( )
A.有机物A与B互为同系物
B.高分子C极易降解为小分子A、B和CO2
C.若只用A和CO2也能合成高分子,但是最终不能形成类似于D的网状高分子
D.若m:n:o:p=5:2:2:1,则聚合物C的平均分子量为1234
12.我国科学家研究出一种四室电催化还原有机物的装置。该装置以重氢氧化钾(KOD)溶液为电解质,利用电解原理将质子源在钯(Pd)膜电极上变成活性氢原子(H),活性氢通过钯膜电极渗透到加氢的隔室与有机物发生氢化反应,工作原理示意图如图所示,该实验中为验证质子的来源,采用了同位素示踪法。下列说法错误的是( )
A.Pd(a)电极接外电源负极
B.若共有1mol被加氢还原,则通过阴离子交换膜的OD﹣的数目为
4NA
C.Pd(b)电极上所发生的电极反应方程式为HCHO﹣e﹣+2OD﹣═HCOO﹣
+H+D2O
D.当外电路流过的电子数为1mol,则Ⅱ室与Ⅲ室质量变化的差值
Δm=|Δm(Ⅱ)|﹣|Δm(Ⅲ)|=3g
13.300K,反应CaSO4(s)+2H2O(g)⇌CaSO4(s)•2H2O(s) Kp=2500atm﹣2,将足量的CaSO4(s)•2H2O(s)置于某干燥密闭容器中达到平衡。已知密度:CaSO4(s):2.96g/cm3,CaSO4(s)•2H2O(s):2.32g/cm3;该温度下,纯水存在如下平衡H2O(l)⇌H2O(g) Kp=0.04atm,相对湿度=×100%。下列说法正确的是( )
A.该容器的相对湿度为50%
B.恒温、恒容,向100mL已达到平衡的体系中再加入29.6gCaSO4(s),平衡不移动
C.恒温、压缩体积,重新达到平衡后,正逆反应速率比原平衡快
D.恒温、恒压,再向平衡体系中加入CaSO4•2H2O(s),其转化率增大
14.室温下,Ka1(H2SO3)=10﹣1.81,Ka2(H2SO3)=10﹣6.99。室温下通过下列实验探究Na2SO3、NaHSO3溶液的性质。
实验1:测定某浓度的NaHSO3溶液的pH,测得pH为5.2。
实验2:向0.10mol•L﹣1NaHSO3溶液中加氨水至pH=6。
实验3:向0.10mol•L﹣1Na2SO3溶液中滴加HCl至pH=7。
实验4:向0.10mol•L﹣1Na2SO3溶液中加入BaO2固体,有气体产生,同时有白色沉淀。
下列说法错误的是( )
A.实验1的溶液中:c()>c(H2SO3)
B.实验2得到的溶液中有=10﹣3.2
C.实验3得到的溶液中有c(H2SO3)+c(Cl﹣)=c()
D.实验4的上层清液中有c()•c(Ba2+)=Ksp(BaSO4),产生的气体为O2
二、非选择题:本题共4小题,共58分。
15.(14分)氯化亚铜(CuCl)是一种白色固体,微溶于水,难溶于乙醇,易水解,在空气中易被氧化。以低品位铜矿砂(主要成分为CuS)为原料制备氯化亚铜的工艺流程如图:
回答下列问题:
(1)锰元素在周期表中的位置为 。
(2)“除锰”中发生反应的离子方程式为 。
(3)①已知“蒸氨”时得到CuO固体,则“合成”中发生反应的离子方程式为 。
②“合成”时加入Na2SO3的速率不宜过快,可能的原因是 。
(4)采用真空干燥氯化亚铜的原因是 。
(5)氯化亚铜的定量分析:
称取产品0.25g置于预先放入30粒玻璃珠和10mLFeCl3溶液的250mL锥形瓶中,不断摇动,待样品完全反应后,加水50mL,邻菲罗啉指示剂2滴,立即用0.10mol/L硫酸铈标准溶液滴至绿色出现为终点,并记录读数。消耗硫酸铈溶液25.00mL。已知CuCl+FeCl3=CuCl2+FeCl2,Fe2++Ce4+=Fe3++Ce3+
计算CuCl的纯度为 (结果保留三位有效数字)。
(6)“CuCl﹣H2O热电循环制氢”经过溶解、电解、热水解和热分解4个步骤,其过程如图所示。电解在质子交换膜电解池中进行,阳极区为酸性CuCl2-溶液,阴极区为盐酸,电解过程中CuCl2-转化为CuCl42-。电解时阳极发生的主要电极反应式为 。
16.(15分)配合物三氯三(四氢呋喃)合铬[CrCl3(THF)3](相对分子质量为374.5)易溶于四氢呋喃[THF,],若有水存在,THF迅速被水取代,CrCl3(THF)3的制备如下:
Ⅰ.制备无水CrCl3:按如图组装仪器,称取1.52gCr2O3粉末放在石英反应管中央摊平,通入N2并控制气流速率,打开管式炉加热电源,水浴加热CCl4,反应2h。
(1)仪器A的名称为 。
(2)氮气通入速率过快可能产生的后果为 。
(3)反应管中只有两种生成物,其中一种为三元化合物,请写出发生反应的化学方程式: 。
Ⅱ.THF的除水处理:在圆底烧瓶中先加入约150mLTHF,先加入物质A,一天后再加入固体B,经过操作X后再蒸馏,收集66℃的馏分。
(4)物质A、固体B可能是 (填序号)。
A.硫酸铜、钠 B.KOH、钠 C.浓硫酸、钠 D.碱石灰、钠
(5)操作X的名称为 。
Ⅲ.合成CrCl3(THF)3:按如图连接好仪器(夹持及加热装置略),将步骤Ⅰ所得的无水CrCl3和0.15g锌粉放入纸质反应管内,圆底烧瓶中加入步骤Ⅱ所得的100mLTHF,通N25min后关闭,通入冷却水,加热四氢呋喃至沸腾,回流2.5h后再通入N2冷却至室温。处理掉多余的THF,使反应混合物体积约为10mL,抽滤、干燥后称量,得产品4.60g。
(6)100mLTHF在本实验中作用是 (任写两点)。
(7)处理掉多余的THF可采用的方法为 (填序号)。
A.蒸发皿中蒸发溶剂 B.水浴蒸馏
C.降温结晶,过滤除去
(8)本实验制得产品CrCl3(THF)3的产率为 (结果保留三位有效数字)。
17.(14分)己二腈[NC(CH2)4CN]是制造“尼龙﹣66”(聚己二酰己二胺)的原料,工业需求量大。其制备工艺很多,发展前景较好的是利用丙烯腈(CH2=CHCN)电合成己二腈。
Ⅰ.制备丙烯腈
以3﹣羟基丙酸乙酯通过腈化反应合成丙烯腈,产率达90%~92%,远高于目前丙烯法。其反应过程如图:
ⅰ.
ⅱ.
(1)以上两个反应在 (填“高温”“低温”或“任意温度”)条件下可自发进行。
(2)能提高丙烯腈的平衡产率的措施有 。(写两种)
(3)向总压为p0kPa的恒压密闭容器中加入催化剂,按投料比=加入反应物,测得平衡时体系中含碳物质(除乙醇)的物质的量分数随温度的变化如图所示[A的物质的量分数=×100%]。
①随温度升高,图中B(g)的物质的量分数先增大后减小的原因是 。
②a点对应反应ⅰ的Kp= kPa(用含p0的代数式表示)。
Ⅱ.丙烯腈电合成己二腈: [NC(CH2)4CN]
电解原理如图甲所示(两极均采用惰性电极),电解过程中主要副产物为丙腈(C2H5CN)。实验测得,向B极区电解液中加入少量季铵盐,并调pH值为8,此时己二腈的产率最高。
(4)电极A为 极(填“阳”或“阴”),写出B电极上①的电极反应式: 。
(5)B极区溶液呈酸性会导致己二腈的产率降低,原因可能为 。
(6)己二腈、丙腈的生成速率与加入季铵盐的浓度关系如图乙所示(纵坐标的单位是10-3moL.h-1)。当季铵盐的浓度为1.5×10﹣2mol/L时,通过质子交换膜的H+的物质的量为 moL。
18.(15分)葛根素具有广泛的药理作用,临床上主要用于心脑血管疾病的治疗,其一种合成路线如图:
已知:
i.BnBr为
ii.
iii.RCH2CHO+R1CH2CHORCH2CH=CHCHO+H2O
iv:
(1)A的名称为 ,D的分子式为 。
(2)由B到C的化学方程式为 ,
反应4的反应类型为 。
(3)试剂2中官能团名称是 。
(4)反应1和反应3的目的是 。
(5)B的同分异构体有多种,其中符合下列条件的结构有 种。
①属于芳香族化合物;
②与B具有相同种类的数目的官能团。
(6)结合题述信息。由乙醇和苯甲醇合成的路线是 。
2024届高三年级第二次模拟考试 化学答案
选择题:1-5 C B A D C 6-10 A B D C B 11-14 C B A C
非选择题:除特别标注外,每空2分。
15.(14分)(1)第四周期第ⅦB族;
(2)Mn2++NH3•H2O+=MnCO3↓++H2O;
(3)①2Cu2+++2Cl﹣+H2O=2CuCl↓++2H+;
②Na2SO3与溶液中的H+反应;
(4)减少CuCl的溶解损耗,并除去杂质,提高产率,防止CuCl在空气中被氧化; (5)99.5%; (6)+2Cl﹣﹣e﹣=。
16.(15分)(1)三颈烧瓶(1分);
(2)速率过快会吹走Cr2O3或带出CCl4(g)过多过快而不能充分反应;
(3)Cr2O3+3CCl42CrCl3+3COCl2;
(4)BD; (5)过滤; (6)反应物、萃取剂;
(7)B; (8)61.4%或0.614
17.(14分)(1)高温(1分);
(2)升高温度、增加氨的浓度、移除水蒸气、减压等(合理即可);
(3)①反应ⅰ、ⅱ均为吸热反应,升高温度,两平衡均正向移动,B物质在反应i产生增多,在反应ii消耗减少,最高点前反应ⅰ进行程度大,最高点后反应ⅱ进行程度大; ②;
(4)阳(1分);2CH2CHCN+2H2O+2e﹣→NC(CH2)4CN+2OH﹣;
(5)H+直接在阴极放电,使电流效率降低,同时生成H更有利于丙烯腈转化为丙腈; (6)8.6×10﹣3。
18.(15分)(1)间苯二酚;C15H12O4Br;
(2)+CH3COCl +HCl; 取代反应(1分);
(3)羟基、醛基;
(4)保护醇羟基;
(5)5;
(6)
试题解析:
一、 选择题:
1.【解答】解:A.蜀绣主要成分是蛋白质,故A错误;
B.火锅中主要成分为有机物,故B错误;
C.建筑会大量使用水泥、陶瓷和玻璃,主要成分为硅酸盐,故C正确;
D.缆车的主要成分为金属,故D错误;
故选:C。
2.【解答】解:A.基态氯原子核外电子排布式为1s22s22p63s23p5,最高能级为3p,电子云轮廓图为,故A正确;
B.水是V形分子,其球棍模型为,空间充填模型为,故B错误;
C.H2SO4中S原子的价层电子对数为4,VSEPR模型为正四面体,则S原子杂化方式为sp3,故C正确;
D.S原子最外层电子数为6,能形成6个共价键,HSO3Cl分子中含有﹣OH,C=O键和C﹣Cl键,则HSO3Cl的结构简式为,故D正确;
故选:B。
3.【解答】解:A.苯酚酸性比碳酸弱,故苯酚与NaHCO3不能产生CO2,故A错误;
B.铁在纯氧中燃烧生成四氧化三铁,高温下和水蒸气反应生成四氧化三铁和氢气,铁在纯氧中燃烧或高温下和水蒸气反应均能得到Fe3O4,故B正确;
C.Cl2与H2完全反应,I2与H2的反应是可逆反应,故等物质的量的Cl2和I2与足量的H2分别混合,充分反应后转移的电子数不相同,故C正确;
D.二氧化硫可被酸性高锰酸钾溶液氧化,体现其还原性,可使品红褪色,体现其漂白性,溶液褪色原理不同,故D正确;
故选:A。
4.【解答】解:A.硫化亚铁和过量硝酸混合,离子方程式为:3+FeS+6H+=Fe3++2H+++3NO↑+2H2O,故A错误;
B.向FeBr2中通入等量Cl2,亚铁离子优先反应,然后部分溴离子被氯气氧化,反应的离子方程式为:2Fe2++2Br﹣+2Cl2═2Fe3++Br2+4Cl﹣,故B错误;
C.NaHCO3溶液中通入足量SO2,离子方程式为:+SO2═+CO2,故C错误;
D.将等物质的量浓度的Ba(OH)2和NH4HSO4溶液以体积比1:2混合,离子方程式为:Ba2++2OH﹣+2H++═BaSO4↓+2H2O,故D正确;
故选:D。
5.【解答】解:A.由于2H2O2的摩尔质量为38g/mol,34g2H2O2的物质的量=<1mol,所以共价键数不是3NA,故A错误;
B.由于不确定是不是标准状态,所以无法计算气体物质的量,故B错误;
C.H2O2和HCl都是18电子微粒,1molH2O2和HCl的混合物所含电子总数为18NA,故C正确;
D.该反应中Cl2转化成HCl是被还原,而不是氧化,故D错误;
故选:C。
6.【解答】解:A.X中氨基上的一个氢原子被取代生成Z和HCl,所以有HCl生成,且该反应为取代反应,故A正确;
B.X与足量氢气反应后产物结构不对称,且硝基被还原为氨基,连接两个氨基和甲基的碳原子都是手性碳原子,所以有3个手性碳原子,故B错误;
C.Y分子中苯环及直接连接苯环的原子共平面,饱和碳原子最多有3个原子共平面,﹣COCl中所有原子共平面,单键可以旋转,则该分子中最多有15个原子共平面,故C错误;
D.连接氯原子的碳原子相邻碳原子上含有氢原子的氯代烃能发生消去反应,该分子中连接碳原子的碳原子相邻碳原子上不含氢原子,所以氯原子不能发生消去反应,故D错误;
故选:A。
7.【解答】解:A.常温下Al遇浓硝酸发生钝化,生成致密的氧化膜阻止反应的进一步发生,Cu与浓硝酸发生持续反应,不能比较金属性强弱,故A错误;
B.恒压漏斗可排除空气对氢气体积的影响,针筒可测定气体的体积,故B正确;
C.乙醇在170℃时发生消去反应生成乙烯,温度计应测定反应液的温度,故C错误;
D.加热时碘易升华,氯化铵分解生成氨气与氯化氢,遇冷时碘凝华,氨气与氯化氢化合生成氯化铵,图中装置不能分离碘和氯化铵,故D错误;
故选:B。
8.【解答】解:A.NaOH饱和溶液、Mg(OH)2饱和溶液的浓度不同,应测定等浓度溶液的pH,比较碱性强弱,故A错误;
B.氯化铁与KI反应生成碘,淀粉遇碘单质变蓝,由实验操作和现象可知,还原性:Fe2+<I﹣,故B错误;
C.不饱和烃可使酸性高锰酸钾溶液褪色,溶液褪色,不能证明产生的气体为乙烯,故C错误;
D.两支盛有KI3溶液的试管中分别滴加淀粉溶液和AgNO3溶液,前者变蓝,后者有黄色沉淀生成,可知溶液中含碘单质和碘离子,则KI3溶液中存在⇌I2+I﹣,故D正确;
故选:D。
9.【解答】解:R、W、X、Y、Z分别为H、B、C、N、Cl;
A.中B的价层电子对数为4+=4,为sp3杂化,呈正四面体,故A正确;
B.该单体中B有空轨道,N有孤对电子,故存在π键,π电子由N提供,故B正确;
C.所有的烃都是碳的氢化物,沸点大小无法确定,故C错误;
D.五种元素的单质中,氧化性最强的是Cl2的单质,故D正确;
故选:C。
10.【解答】解:A.晶胞是最小的重复单元,图中实现部分是最小的重复单元,属于晶胞,故A正确;
B.RuO2晶胞Ru的个数为8×+1=2,由化学式子可知O的个数为4,O有两个在体内,另外四个在面上,故B错误;
C.Al3+半径小于Mg2+,在MgF2中引入Al3+可降低晶胞参数,Al﹣MgF2晶体结构和RuO2更接近,相互作用更强,催化效果更好,故C正确;
D.Al﹣MgF2晶体是Al取代了Mg,铝的相对原子质量为27,镁的相对原子质量为24,则MgF2晶体的密度小于Al﹣MgF2晶体,故D正确;
故选:B。
11.【解答】解:A.有机物B中有一个碳碳双键,而A不含,则有机物A与B不是同系物,故A错误;
B.高分子C中酯基容易降解,而醚键不易降解,则高分子C降解有CO2生成,没有A、B生成,故B错误;
C.若只用A和CO2能合成线型高分子,不能形成类似于D的网状高分子,故C正确;
D.若m:n:o:p=5:2:2:1,链节的平均相对分子质量为1234,而C的聚合度为x,则聚合物C的平均分子量为1234x,故D错误;
故选:C。
12.【解答】解:A.由于OD﹣从左边移动到右边,故Pd(a)电极为阴极,接外电源负极,故A正确;
B.由于a、b两极上都有 参与反应,当电子转移数为4mol时,a、b两极各有1mol被加氢还原,故若有1mol被加氢还原,电子转移数为2mol,则通过阴离子交换膜的OD﹣的数目为2NA,故B错误;
C.由上述分析可知,Pd(a)电极为阴极,电极反应方程式为:HCHO−e﹣+2OD﹣=HCOO﹣+H+D2O,故C正确;
D.当外电路流过的电子数为1mol,则Ⅱ室中少了1molD和1molOD﹣共2g+18g=20g,Ⅲ室增加1mol OD﹣并减少1molH,共增加18g﹣1g=17g,Δm=|Δm (Ⅱ)|﹣|Δm (Ⅲ)|=20g−17g=3g,故D正确;
故选:B。
13.【解答】解:A.反应CaSO4(s)+2H2O(g)⇌CaSO4(s)•2H2O(s) Kp==2500atm﹣2,故p(H2O)=0.02atm;纯水存在如下平衡H2O(l)⇌H2O(g) Kp=p(H2O)=0.04atm,该容器的相对湿度为50%,故A正确;
B.恒温、恒容,向100mL已达到平衡的体系中再加入29.6g CaSO4(s),则占据容器的体积为=10mL,相当于压缩体积,则平衡向正向移动,故B错误;
C.恒温、压缩体积,重新达到平衡后,因为平衡常数不变,故平衡时水的分压不变,故正逆反应速率不变,故C错误;
D.恒温、恒压,再向平衡体系中加入CaSO4•2H2O(s),体系体积不变,平衡不移动,其转化率不变,故D错误;
故选:A。
14.【解答】解:A.NaHSO3溶液的pH=5.2,呈酸性,说明的电离程度大于其水解程度,则c()>c(H2SO3),故A正确;
B.实验2得到的溶液中有====10﹣3.2,故B正确;
C.实验3得到的溶液呈中性,c(OH﹣)=c(H+),物料守恒关系为c(Na+)=2c()+2c()+2c(H2SO3),电荷守恒关系为c()+c(Cl﹣)+2c()+c(OH﹣)=c(H+)+c(Na+),则c(Cl﹣)=c()+2c(H2SO3),故C错误;
D.实验4中BaO2氧化Na2SO3生成Na2SO4,生成的气体为O2,生成的白色沉淀为BaSO4,存在沉淀溶解平衡,则上层清液中满足c()•c(Ba2+)=Ksp(BaSO4),故D正确;
故选:C。
二、非选择题:本题共4小题,共58分。
15.【解答】解:(1)Mn元素核电荷数25,价电子3d54s2,位于周期表的:第四周期第ⅦB族,
故答案为:第四周期第ⅦB族;
(2)“除锰”过程中,Mn2+、NH3•H2O、NH4HCO3反应生成MnCO3、和H2O,该反应中发生反应的离子方程式为Mn2++NH3•H2O+=MnCO3↓++H2O,
故答案为:Mn2++NH3•H2O+=MnCO3↓++H2O;
(3)①已知“蒸氨”时得到CuO固体,在合成步骤中,NaCl、Na2SO3、CuCl2反应生成CuCl和Na2SO4、HCl,则“合成”中发生反应的离子方程式为2Cu2+++2Cl﹣+H2O=2CuCl↓++2H+,
故答案为:2Cu2+++2Cl﹣+H2O=2CuCl↓++2H+;
②“合成”时加入Na2SO3的速率不宜过快,可能的原因是Na2SO3与溶液中的H+反应,
故答案为:Na2SO3与溶液中的H+反应;
(4)CuCl易水解,在空气中易被氧化,采用真空干燥氯化亚铜的原因是减少CuCl的溶解损耗,并除去杂质,提高产率,防止CuCl在空气中被氧化,
故答案为:减少CuCl的溶解损耗,并除去杂质,提高产率,防止CuCl在空气中被氧化;
(5)根据“CuCl+FeCl3=CuCl2+FeCl2、Fe2++Ce4+=Fe3++Ce3+”得关系式CuCl~Fe2+~Ce4+,n(CuCl)=n[Ce(SO4)2]=0.10mol/L×0.025L=0.0025mol,CuCl的纯度=(0.0025mol×99.5g/moL)/ 0.25 ×100% =99.5%,
故答案为:99.5%;
(6)电解在质子交换膜电解池中进行,阳极区为酸性溶液,阴极区为盐酸,电解过程中转化为,则电解时阳极发生的主要电极反应式为+2Cl﹣﹣e﹣=,
故答案为:+2Cl﹣﹣e﹣=。
16.【解答】解:(1)图中仪器A为三颈烧瓶,
故答案为:三颈烧瓶;
(2)制备无水CrCl3时,通入N2的速率不宜过快,是因为通入N2速率过快会吹走Cr2O3或带出CCl4(g)过多而不能充分反应,
故答案为:速率过快会吹走Cr2O3或带出CCl4(g)过多过快而不能充分反应;
(3)Cr2O3与CCl4反应生成CrCl3和COCl2,反应的化学方程式为:Cr2O3+3CCl42CrCl3+3COCl2,
故答案为:Cr2O3+3CCl42CrCl3+3COCl2;
(4)为除去四氢呋喃的水,可先加入干燥剂,再加入金属钠反应掉剩余的少量水,但不可使用浓硫酸作干燥剂,浓硫酸与乙醚反应。
故答案为:BD;
(5)操作X是将固体与液体进行分离的过程,即过滤,
故答案为:过滤;
(6)由题目中的信息可知,THF是反应物之一,另外四氢呋喃在圆底烧瓶和纸质反应器中循环,只有CrCl3不溶于四氢呋喃、CrCl3(THF)3溶于四氢呋喃方能实现四氢呋喃与CrCl3的连续反应及产物的连续萃取,THF是萃取剂,
故答案为:反应物、萃取剂;
(7)THF的沸点是66℃,处理掉多余的THF可采用的方法为水浴蒸馏,
故答案为:B;
(8)61.4%
17.【解答】解:(1)该反应为吸热反应,熵增反应,即△H>0,△S>0,当温度较高时,△G=△H﹣T△S<0,反应可自发进行,
故答案为:高温;
(2)该反应是吸热反应,升高温度平衡正向移动,增加氨的浓度、移除水蒸气、减压等平衡均正向移动,丙烯腈的平衡产率提高;
故答案为:升高温度、增加氨的浓度、移除水蒸气、减压等(合理即可);
(3)①反应ⅰ、ⅱ均为吸热反应,最高点前反应i进行程度大,最高点后反应ⅱ进行程度大,所以随着温度的升高,B(g)平衡的物质的量分数先增大后减小,
故答案为:反应ⅰ、ⅱ均为吸热反应,升高温度,两平衡均正向移动,B物质在反应i产生增多,在反应ii消耗减少,最高点前反应ⅰ进行程度大,最高点后反应ⅱ进行程度大;
②a点时主要发生反应i,假设A投料为2mol,平衡时A、B的物质的量相等,根据三段式可知,平衡时A、B与水蒸气的物质的量均为1mol,再加上NH3 15mol,总压强为p0 kPa,则A、B、水蒸气的分压均为kPa,反应i的Kp==kPa,故答案为:;
(4)甲是电解装置,在电解池中阳离子移向阴极,故B为阴极,A为阳极;B电极上①的电极反应式:2CH2CHCN+2H2O+2e﹣→NC(CH2)4CN+2OH﹣,
故答案为:阳;2CH2CHCN+2H2O+2e﹣→NC(CH2)4CN+2OH﹣;
(5)B极区溶液呈酸性会导致己二腈的产率降低,原因可能为:H+直接在阴极放电,使电流效率降低,同时生成H更有利于丙烯腈转化为丙腈,
故答案为:H+直接在阴极放电,使电流效率降低,同时生成H更有利于丙烯腈转化为丙腈;
(6)如图横坐标取值,每小时生成己二腈3.4×10﹣3mol,转移电子6.8×10﹣3mol,丙腈0.9×10﹣3mol,转移电子1.8×10﹣3mol,转移电子总量8.6×10﹣3mol,即迁移氢离子总量8.6×10﹣3mol。
故答案为:8.6×10﹣3mol。
18.【解答】解:(1)A为,A的名称为间苯二酚,D的分子式为C15H12O4Br,故答案为:间苯二酚;C15H12O4Br;
2024高三上学期第二次模拟考试化学含答案: 这是一份2024高三上学期第二次模拟考试化学含答案,文件包含化学试题doc、2024化学二模参考答案及评分标准docx等2份试卷配套教学资源,其中试卷共12页, 欢迎下载使用。
2024金华十校高三上学期11月模拟考试化学含解析: 这是一份2024金华十校高三上学期11月模拟考试化学含解析,文件包含浙江省金华市十校2024届高三上学期11月模拟考试化学试题含解析docx、浙江省金华市十校2024届高三上学期11月模拟考试化学试题无答案docx等2份试卷配套教学资源,其中试卷共35页, 欢迎下载使用。
2024北海高三上学期第一次模拟考试化学PDF版含解析: 这是一份2024北海高三上学期第一次模拟考试化学PDF版含解析,共11页。











