





2024届高考化学一轮复习原子结构 核外电子排布规律课件
展开1.掌握原子结构中微粒数目的关系。2.了解原子核外电子的运动状态、能级分布和排布原理。3.能正确书写1~36号元素原子核外电子排布式、价层电子排布式和轨道表示式。
考点一 原子结构、核素、同位素
考点二 核外电子运动状态与排布原理
考点一 原子结构、核素、同位素
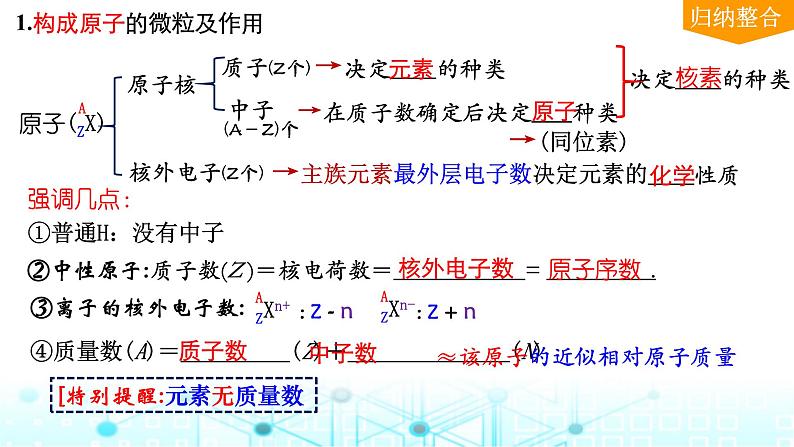
决定 的种类
→主族元素最外层电子数决定元素的 性质
→在质子数确定后决定 种类
→决定 的种类
1.构成原子的微粒及作用
④质量数(A)= (Z)+ (N)
质子数(Z )=核电荷数= = .
[特别提醒:元素无质量数
≈该原子的近似相对原子质量
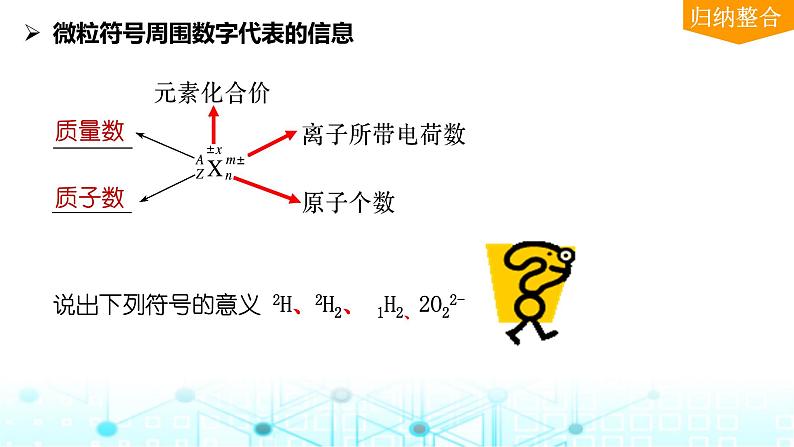
微粒符号周围数字代表的信息
说出下列符号的意义 2H、2H2、 1H2、2O22-
1.现有两种微粒,它们具有相同的质子数和电子数,则这两种微粒不可能是( )A、一种原子与一种分子 B、两种不同的离子 C、两种不同的分子 D、一种原子和一种离子
3.已知阴离子R2-的原子核内有n个中子,R原子的质量数为m,则ω g R原子完全转化为R2-时,含有电子的物质的量是 ( )
具有相同核电荷数(质子数)的同一类原子的总称。
2. 核素、元素和同位素
→(元素由质子数决定)
原子既讲种类又讲个数。
①元素只论种类, 不讲个数。
如:水由氧元素和氢元素组成
一个水分子由1个O原子和2个H原子构成
水分子由O原子和H原子构成
可以是各种状态的原子,只要质子数相同
例如:1H、D、T、H+等均属于“氢元素”
:具有一定数目质子和中子的一种原子
即:“一种原子就是一种核素”
氕 氘 氚
质子数相同而中子数不同
的同一元素不同原子间的互称
(类比:同学关系,同桌关系等)
大多数元素都有同位素。
(元素只有118种,原子却多得多)
同素异形体:由同种元素形成的不同单质,互称为同素异形体。
如:氧气和臭氧、石墨和金刚石、红磷和白磷。
①同位素的化学性质基本相同,物理性质有的相近,有的差异很大。
④天然存在的同位素,相互间保持一定的原子个数百分比(丰度)不变。
②由同位素形成的“单质”混合在一起是纯净物
③同位素之间的转化既不是物理变化也不是化学变化,是核反应
如:H2、D2、T2、HD等混合在一起,都是氢气,属纯净物
例如:氯元素天然存在两种同位素
元素、核素、同位素之间的关系
→同种元素,可以有若干种不同的核素。
→同位素是同一元素的不同核素之间的互相称谓, 不指具体的原子。
②原子的近似相对原子质量
已知:一个16O原子的质量为2.657×10-26 kg
1.993×10-26 kg
2.657×10-26 kg
是该元素各种天然、稳定的核素的相对原子质量与其所占原子个数百分比(也称“丰度”)乘积之和。即: Ar =Ar1·a%+Ar2·b%+Ar3·c%+……
即: Ar =A1·a%+A2·b%+A3·c%+……
③元素的平均相对原子质量:
④元素的近似相对原子质量:
(A1、A2、A3……为质量数)
是按各种天然同位素原子所占百分比算出的平均值。
是该元素各种天然、稳定的核素的相对原子质量与其所占原子个数百分比(也称“丰度”)乘积之和。即: Ar =Ar1·a%+Ar2·b%+Ar3·c%+……
34.969×75.77% + 36.966 × 24.23%
35×75.77% + 37× 24.23%
氯元素的相对原子质量=
原子的近似相对原子质量:
原子的相对原子质量Ar:
是该元素各种天然、稳定的核素的相对原子质量与其所占原子个数百分比(也称“丰度”)乘积之和。
某原子真实质量与12C原子真实质量的1/12的比值。
记住:元素无质量数,原子才有质量数。
(1)一种元素有几种同位素,就有几种核素的相对原子质量。
(2)元素周期表中所列相对原子质量为元素的平均相对原子质量。
(3)在计算中常用质量数代替原子的相对原子质量近似计算。
(4)元素无质量数,原子才有质量数。
写出下列各物质的相对分子质量:
2.下述各对物质, 互为同位素的是 ,互为同素异形体的是 。(A)金刚石和石墨 (B)H2O和D2O (C)11H2和21H2 (D)126C和136C (E) NO2和NO (F) 235U 和 238U (G) O 2 和 O 3 (H)Na和Na+
同素异形体:指同种元素形成的性质不同的单质。
3.若某元素某原子核内的质子数为m,中子数为n,则下列叙述中正确的是( )A.这种元素的质量数是m+nB.不能由此确定该元素的相对原子质量C.若碳原子的质量为wg,则此原子的质量为(m+n)wgD.该原子核内中子的总质量小于质子的总质量
元素无质量数,原子才有质量数。
4. 铜有两种天然同位素63Cu和65Cu,已知铜的相对原子质量是63.5,则63Cu的原子个数百分数是( )A.75% B.25% C.50% D.45%
Cu元素近似相对原子质量= A1×a1 + A2×a2 = 63×a1+ 65×a2 = 63.5
也可以用“十字交叉法”计算
5. 硼元素的平均相对原子质量为10.8,则硼在自然界中的两种同位素10B和11B的原子个数比( )A、1:1 B、1:2 C、1:3 D、1:4
6.氯元素中有3517Cl和3717Cl两种天然、稳定的核素,3517Cl和3717Cl的原子个数比为3∶1。由3517Cl和3717Cl构成的、相对分子质量分别为70、72、74的三种分子的个数比为( )A.6∶6∶1 B.3∶3∶1 C.6∶3∶1 D.9∶3∶1
相对分子质量为70、72、74的三种分子分别是:3517Cl2、3517Cl3717Cl、3717Cl2,
假设其分子个数为x、y、z
则(2x+y)∶(y+2z)=3∶1
→核外电子按 不同分成能层,同一能层的电子,还被分成不同 。
核外电子按能量不同分成能层,也叫电子层
离核越近的能层,具有的能量越低,电子优先占据低能量能层
【知识回顾1】能层与能级
K < L < M < N < O < P
(3)最外电子数不超过 个电子(K层为最外层不超过 个);
(4)次外层电子数不超过 个电子;
1)以上规律是相互联系的,不能孤立地机械套用。
(5)倒数第三层电子数不超过 个电子。
核外电子总是尽先排布在能量较低的电子层,然后再由里向外,依次排布在能量逐步升高的电子层。
即:最外层 8e-,次外层 18e-,倒第三层 32e-
2)特殊地, ⅠA、ⅡA元素原子次外层为2或8e-
问题1:85号At的核外电子排布?
问题2:若有第八周期,其排满的最后一个元素原子结构为 ? 第八周期应有 种元素?
1.下列所画的原子或离子的结构示意图,一定错误的是( )
2. 假设原子核外电子排布的基本规律为最外层电子数不超过5个,次外层电子数不超过10个,倒数第三层不超过15个,而各电子层电子的最大容量仍为2n2个,若按此规律排布周期表,那么该周期表第三、四、五周期含有的元素种类分别有( ) A. 5、10、15 B. 8、18、18 C. 8、10、15 D. 9、12、15
第二、三、四、五周期最后一个原子的结构分别为:
3. 画出所有稀有气体的原子结构示意图
He Ne Ar Kr Xe Rn
一 二 三 四 五 六
记住稀有气体原子核外电子排布
推算主族元素原子结构:
①若原子序数比相应稀有气体元素多1→2,
→比该稀有气体多一个电子层的ⅠA、ⅡA元素
②若原子序数比相应稀有气体元素少1→5,
→与该稀有气体电子层数相同,最外层e-相应变化ⅢA→ⅦA元素
如 20号、37号、55号、56号等
如 35号、53号、51号、84号等
(次外层2e-或8e-)
同一能层中,电子的能量还稍有差异,把一个能层分为1个或若干个能级
(1)能级表示形式:用字母s、p、d、f ┅ ┅
能级的符号:ns np nd nf…
(2)不同能层中,能级数规律
②能级数 = 能层序数
①任一能层的能级总从s能级开始,按s、p、d、f ……排序
③各能级所在能层的取值
④以s、p、d、f…排序的各能级可容纳的最多电子数依次为1、3、5、7…的二倍。
ns np nd nf …
⑤每个原子轨道最多容纳一对自旋相反的电子
:处于一定空间 的电子在原子核外空间的概率密度分布的形象化描述。
电子云图绘制比较困难,常用电子云轮廓图代替。
:将电子出现概率P≧90%的空间圈出来。
如氢原子电子云轮廓图:
小蓝点是1s电子在原子核外出现的概率密度的形象描述
【思考】分析通过H原子的电子云轮廓图, 说明其核外电子运动呈现怎样的特点?
①s电子云呈球形对称。②在离核近的空间电子出现的概率大, 在离核远的空间电子出现的概率小。
:量子力学把电子在原子核外的一个( )称为一个原子轨道。
→各能级的一个伸展方向的电子云轮廓图即表示一个原子轨道
[易错警示] 电子云图与电子云轮廓图不是同一个概念,→电子云轮廓图实际上是电子云图的大部分区域;→电子云轮廓图就是我们通常所说的原子轨道图。
常用电子云轮廓图的形状和取向来表示原子轨道的形状和取向
s原子轨道呈___形对称,即在空间有_个伸展方向,故s轨道只有_个轨道。
不同能层的电子,能量越高,离核越远,电子云半径越大
P轨道呈_____形,P轨道在空间有__个伸展方向,它们互相垂直,包括___、___、__ 共___个轨道。
px py pz
d轨道在空间有__个伸展方向,即d轨道共__个轨道。
f轨道形状更复杂,在空间有7个伸展方向,即f轨道共7个轨道。
①不同能层相同能级电子云轮廓图的形状和取向相同
②能层序数越大,原子轨道的半径越大。如 1s<2s<3s<4s
③形状和大小相同,但取向不同的原子轨道,能量相等。如2Px、2Py、2Pz能量相等
【总结归纳】能层与能级
⑤每个能层最多容纳的电子数不超过2n2
7个能层:K L M N O P Q
1. 电子在核外是分层排布的,按能量不同分成能层,也叫电子层
离核由近到远,能量由低到高
ns
E(ns) = E(np) = E(nd) = E(nf)
E(ns) < E(np) < E(nd) < E(nf)
1)在原子中第n能层,电子占有的轨道数最多为n2。 ( )2)同一原子中的npx与npy轨道形状相同,半径相同且在空间相互垂直。( )3)电子云图中小黑点密度的大小可表示电子的多少。( )4)p轨道呈哑铃形,因此p轨道上的电子运动轨迹呈哑铃形。( )
1.下列有关能层和能级的叙述中正确的是A.M能层有s、p共2个能级,最多能容纳8个电子B.3d能级最多容纳5个电子,3f能级最多容纳7个电子C.无论哪一能层的s能级最多容纳的电子数均为2D.任一能层都有s、p能级,但不一定有d能级
2.下列说法中正确的是A.1s电子云呈球形,表示电子绕原子核做圆周运动B.ns能级的原子轨道图可表示为C.3d3表示3d能级有3个轨道D.电子云图中的小黑点密度大,说明该原子核外空间电子数目多
3.符号3px所代表的含义是A.px轨道上有3个电子B.第三能层px轨道有3个伸展方向C.px电子云有3个伸展方向D.第三能层沿x轴方向伸展的p轨道
基态与激发态 原子光谱
处于最低能量状态的原子
:处于较高能量状态的原子
(电子跃迁到较高能级)
特别提醒 电子的跃迁是物理变化(未发生电子转移),而原子得失电子时发生的是化学变化。
激发态原子不稳定,易释放能量变为较低能量的激发态乃至基态原子。
3.研究原子结构的方法——原子光谱
基态氢原子:处于能量最低状态的氢原子。
基态原子吸收能量,其中的电子会发生跃迁,由于电子跃迁,原子处于比基态能量高的状态,形成激发态原子。
当电子从较高能量的状态跃迁至较低能量的状态,乃至基态时,会释放能量。
光是电子跃迁释放能量的重要形式之一。
每一次跃迁的能量以光的形式产生一条分立的谱线,被记录下来,就形成了原子光谱。
(1)原子核外电子在具有确定能量的轨道上运动,当原子不受外界影响时,电子既不吸收也不放出能量。
(3)当电子吸收了能量(如光能、热能等),就会从能量较低的轨道跃迁到能量较高的轨道上。处于能量较高轨道的电子不稳定,会回到能量较低的轨道上,当电子从能量较高的(E2)轨道跃迁到能量较低的(E0)轨道时发射出光子,发出光的波长取决于两个轨道的能量差。
(2)不同的原子轨道具有不同的能量,轨道能量的变化是不连续的,即量子化的。
→光谱:按照一定能量次序排列的光带。
→可见光光谱:可以被人眼观察的光带。
不同原子的电子发生跃迁时可以吸收或发射不同的光
用光谱仪可以摄取各种原子吸收光谱。
不同原子的电子发生跃迁时可以吸收不同的光
用光谱仪可以摄取各种原子的发射光谱。
不同原子的电子发生跃迁时可以发射不同的光
各种原子的吸收光谱或发射光谱,总称为原子光谱。
特征:暗背景,亮线, 线状不连续
特征:亮背景,暗线,线状不连续
对比二者,它们之间有何联系?
发射光谱中的彩色亮线与吸收光谱中的暗线恰好处于完全相同的位置。
1.发射光谱中的彩色亮线与吸收光谱中的暗线恰好处于完全相同的位置。
相同元素的原子,电子在两个能级之间的跃迁往返时,经历了两个恰好相反的过程,过程中也就必然吸收或放出同样多的能量,对应的光的波长相同。故在吸收光谱和发射光谱相同位置一定出现线状谱。
不同元素的原子具有不同的结构,能级各不相同,因此电子跃迁时发射或吸收光的频率也必定不同,故每种元素在光谱中都会形成“特征谱线”。
在现代化学中,常利用原子光谱上的特征谱线来鉴定元素。
利用原子光谱线(吸收或发射光谱)上的特征谱线来鉴定元素的仪器
4.原子光谱的应用——(1)发现新元素
4.原子光谱的应用——(2)检验元素
生活中,我们看到的许多可见光,如:焰火、激光、霓虹灯……都与原子核外电子跃迁释放能量有关。
主要形式为 (辐射)
利用原子光谱上的特征谱线可以鉴定元素,称为光谱分析。
① :
在构建基态原子时,电子将尽可能地占据能量最低的原子轨道,使整个原子的能量最低。
原子核外电子排布的规范书写
即,电子优先占据能量低的电子轨道,然后依次进入能量高的轨道。
(1)大多数原子的电子排布式只要根据构造原理写出就满足能量最低原理
(2)24Cr、29Cu、47Ag、74Au等原子不符合构造原理,但符合洪特规则(特例),
② :
在一个原子轨道里,最多只能容纳 个电子,它们的自旋 。
常用↑、↓表示自旋相反的电子
自旋方向相反就是自转方向相反
自旋是微观粒子普遍存在的一种属性
根据构造原理、能量最低原理、泡利原理可知,基态原子核外有几个电子就有几种运动状态(要么不同轨道,要么自旋方向不同)
即在任何一个原子中找不到两个完全相同的电子。
③ :
基态原子中,填入简并轨道的电子总是先单独分占,且自旋平行。
洪特规则特例(洪特规则的补充)
对于同一个能级,当电子排布为全充满(p6、d10、f14)、半充满(p3、d5、f7)或全空(p0、d0、f0)时,具有较低的能量和较大的稳定性。
1s22s22p63s23p63d104s24p64d104f145s25p65d106s1
24Cr 1s22s22p63s23p63d54s1
29Cu 1s22s22p63s23p63d104s1
1s22s22p63s23p63d104s24p64d105s1
原子的电子排布遵循构造原理,能使整个原子的能量处于最低状态
在一个原子轨道最多只能容纳2个电子,且它们的自旋状态相反。
当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,而且自旋方向相同。
总结: 基态原子核外电子的排布遵循的规则
实际上,整个原子的能量是由核电荷数、电子数和电子状态三个因素共同决定。
①含义:以 事实为基础,从氢开始,随核电荷数递增,新增电子填入 的顺序称为构造原理。
各圆圈间连接线的方向即电子填入能级的顺序(原则:低能量能级 --- 高能量能级)
即电子所排的能级顺序:1s、2s、2p、3s、3p、4s、 、4p、5s、 、5p、6s、 、 、6p、7s 、 、 、7p ……。
(2)填充顺序——构造原理
各能级的能量高低顺序:
ns < (n-2)f < (n-1)d < np
从第三能层开始部分能级不完全遵循能层顺序,内层能级能量比外层能级高,称之为能级交错现象.
如 E(4s)
提醒: 电子排布虽然存在能级交错,但表示时需要将相同能层的能级写在一块
1s22s22p63s23p63dx4sx4px4dx ┅ 5sx ┅ 5px ……
即:按构造原理顺序填充电子,但书写时同层能级合并在一起。
(3)基态原子核外电子排布表示方法
1s22s22p63s23p4
五种表示方法中,电子排布图最能反映电子的排布情况
[Ne]表示的是Ne的核外电子排布,也称为原子实。
Na:1s22s22p63s1
Ca: 1s22s22p63s23p64s2 或[Ar]4s2
原子实表示的电子称为内层电子,通常不参与成键。
原子实外的电子称为价层电子,决定元素的化学性质。
价电子
化学反应中可能变化的电子
可简化为[Ne]3s1
量子力学把电子在原子核外的一个 称为一个原子轨道。
①在氧原子中,有 个电子对,有 个单电子。②在氧原子中,有 种空间运动状态,有 种运动状态不同的电子。
(3)单电子: 。(4)自旋平行: 。
一个原子轨道中若只有一个电子,则该电子称为单电子
箭头同向的单电子称为自旋平行
(1)简并轨道: 。(2)电子对: 。
同一个原子轨道中,自旋方向相反的一对电子
有几个原子轨道就有几个空间运动状态
基态原子核外有几个电子就有几种运动状态(要么不同轨道,要么自旋方向不同)
2.“电子排布图”中的相关概念
试写出下列原子的价层电子排布:①13Al:_______;②34Se:_______;③ 29Cu:_______; ④ 26Fe:_______;
特点:①主族元素的价电子就是最外层电子数;②过渡金属元素的价电子主要包括:最外层电子和次外层d能级上的电子。
(3)原子得到电子形成阴离子,则得到的电子填充在最外一个能层的某一个能级上。
(1)判断该原子变成离子时会得到或失去的电子数。
(2)原子失去电子时,总是从能量高的能层失去电子,
即失去电子的顺序是由外向里。
一般来说,主族元素只失去它们的最外层电子,而副族元素可能还会进一步向里失去内层电子。
Cl-:1s22s22p63s23p6
Cl:1s22s22p63s23p5
(得到的电子填充在最外面的3p能级上)
Na+ 1s22s22p6
Na 1s22s22p63s1
(失去最外层的3s能级上的电子)
1.试写出Fe、 Fe2+ 、Fe3+的电子排布式。
1s22s22p63s23p63d64s2
(失去最外层的4s能级上的2个电子)
(失去最外层的4s能级上的2个电子和内层3d上的1个电子)
1s22s22p63s23p63d6
1s22s22p63s23p63d5
或者[Ar]3d64s2
2.请写出Fe、Fe2+、Fe3+的轨道表示式。
3.请写出24号铬元素原子的轨道表示式。
①在铬原子中,有 个电子对,有 个单电子。②在铬原子中,有 种空间运动状态,有 种运动状态不同的电子。
有几个电子就有几种运动状态(要么不同轨道,要么自旋方向不同)
只有一组全满的简并轨道
核外电子运动状态的判断
→电子的运动状态与原子核外电子数目相等;→电子的空间运动状态与核外电子填充原子轨道的数目相等。
4.下列原子或离子的电子排布式或轨道表示式正确的是________(填序号,下同),违反能量最低原理的是____,违反洪特规则的是_____,违反泡利原理的是_____。①Ca2+:1s22s22p63s23p6②F-:1s22s23p6③P:
④Fe:1s22s22p63s23p63d64s2⑤Mg2+:1s22s22p6⑥C:
(1)在书写基态原子的轨道表示式时,常出现以下错误:① (违反能量最低原理);② (违反泡利原理);③ (违反洪特规则);④ (违反洪特规则)。
(2)当出现d轨道时,虽然电子按ns、(n-1)d、np的顺序填充,但在书写电子排布式时,仍把(n-1)d放在ns前,如Fe:1s22s22p63s23p63d64s2,而失电子时,却先失4s轨道上的电子,如Fe3+:1s22s22p63s23p63d5。
1、构造原理 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p ... ...
特殊原子的核外电子排布式
(1)基态原子的电子排布(2)简化电子排布式 (3) 价电子排布式(4)离子的电子排布式
注意:熟练书写1~36号元素的电子排布式。
2、电子排布式 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d 5f 6s 6p ...
熟记第四周期未成对电子数规律
规律总结 1~36号元素中原子核外电子排布的特殊性。(1)最外层只有一个未成对电子的元素:(2)最外层有2个未成对电子的元素:(3)最外层有3个未成对电子的元素:(4)3d能级半充满的元素:(5)核外电子排布中,未成对电子数最多的元素:
①第ⅠA族(ns1:H、Li、Na、K), ②第ⅢA族(ns2np1:B、Al、Ga),③第ⅦA族(ns2np5:F、Cl、Br), ④Cr(3d54s1)和Cu(3d104s1)。
①第ⅣA族(ns2np2:C、Si、Ge), ②第ⅥA族(ns2np4:O、S、Se)。
第ⅤA族(ns2np3:N、P、As)。
Cr3d54s1;Mn3d54s2。
Cr(3d54s1),共有6个未成对电子)。
第30讲 原子结构 核外电子排布规律-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材): 这是一份第30讲 原子结构 核外电子排布规律-【精梳精讲】2024年高考化学大一轮精品复习课件(新教材),共60页。PPT课件主要包含了专项突破,归纳整合,p轨道,d轨道,f轨道,为什么等内容,欢迎下载使用。
新高考化学一轮复习精品课件 第6章 第30讲 原子结构 核外电子排布规律 (含解析): 这是一份新高考化学一轮复习精品课件 第6章 第30讲 原子结构 核外电子排布规律 (含解析),共60页。PPT课件主要包含了必备知识,关键能力,核外电子排布常见错误,真题演练明确考向,课时精练等内容,欢迎下载使用。
2024届高三化学高考备考一轮复习专题:原子结构 核外电子排布课件: 这是一份2024届高三化学高考备考一轮复习专题:原子结构 核外电子排布课件,共42页。PPT课件主要包含了核外电子数,质子数,中子数,几乎完全相同,2原子结构示意图,电子层,pdf,概率密度分布,哑铃形,电子自旋等内容,欢迎下载使用。












