






所属成套资源:全套2024年高考化学一轮复习课时教学课件
2024年高考化学一轮复习难溶电解质的溶解平衡与应用课件
展开
这是一份2024年高考化学一轮复习难溶电解质的溶解平衡与应用课件,共52页。PPT课件主要包含了复习目标,网络构建,知识梳理题型归纳,真题感悟,内容索引,考情分析,PARTONE等内容,欢迎下载使用。
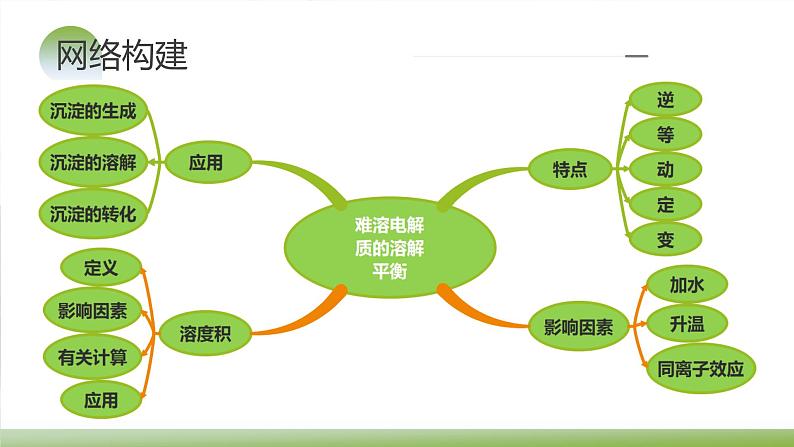
知识梳理
题型归纳
考点要求考题统计考情分析物质的组成、性质、分类2023**卷**题,**分2022**卷**题,**分2021**卷**题,**分……传统文化中的性质与变化2023**卷**题,**分2022**卷**题,**分2021**卷**题,**分
1.从宏观角度理解溶解度
(2)溶解度与溶解性的关系——难溶、可溶、易溶界定:
知识点1 沉淀溶解平衡
(1)定义:在一定温度下,某固体物质在100 g溶剂中形成饱和溶液时,溶解的溶质质量为该物质在该温度下的溶解度,用S表示。
20 ℃时,电解质在水中的溶解度与溶解性存在如下关系:
2.从微观角度理解沉淀溶解平衡
(1)含义:在一定温度下的水溶液中,当难溶电解质沉淀溶解和生成的速率相等时,即建立了沉淀溶解平衡状态。
溶质溶解的过程是一个可逆过程:
(4)特点(同其他化学平衡):逆、等、定、动、变(适用平衡移动原理)
1.内因:难溶电解质本身的性质,这是决定因素。
知识点2 影响沉淀溶解平衡的因素
①绝对不溶的电解质是没有的。
②同是难溶电解质,溶解度差别也很大。
③易溶电解质作溶质时只要是饱和溶液也可存在溶解平衡。
2.外因(研究对象——同种难溶电解质)
①浓度:加水稀释,平衡向沉淀溶解的方向移动;
②温度:绝大多数难溶电解质的溶解是吸热过程,升高温度,平衡向沉淀溶解的方向移动;
③同离子效应:向平衡体系中加入难溶电解质溶解产生的离子,平衡向生成沉淀的方向移动;
④其他:向平衡体系中加入可与体系中某些离子反应生成更难溶或更难电离或气体的离子时,平衡向沉淀溶解的方向移动。
考向1 考查沉淀溶解平衡的特点
考向2 考查沉淀溶解平衡的影响因素
1.原理:当Qc>Ksp时,难溶电解质的溶解平衡向左移动,生成沉淀。
2.应用:可利用生成沉淀来达到除去溶液中杂质离子的目的。
①调节pH法:如除去NH4Cl溶液中的FeCl3杂质,可加入氨水调节pH至7~8,离子方程式为Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+。
②沉淀剂法:如用H2S沉淀Cu2+,离子方程式为H2S+Cu2+=CuS↓+2H+。
1.原理:当沉淀溶解平衡体系中的离子发生反应时,其浓度会降低,沉淀溶解平衡就会向溶解的方向移动,从而使沉淀溶解。
①酸溶解法:如CaCO3溶于盐酸,离子方程式为CaCO3+2H+=Ca2++H2O+CO2↑。
②盐溶液溶解法:如Mg(OH)2溶于NH4Cl溶液,离子方程式为Mg(OH)2+2NH4+=Mg2++2NH3·H2O。
③氧化还原溶解法:如不溶于盐酸的硫化物Ag2S溶于稀HNO3。
④配位溶解法:如AgCl溶于氨水,离子方程式为AgCl+2NH3·H2O=[Ag(NH3)2]++Cl-+2H2O。
1.实质:沉淀溶解平衡的移动(沉淀的溶解度差别越大,越容易转化,易溶的转化为难溶的)。
1)难溶的物质转化为更难溶的物质较易实现。
3)Ksp相差很大时,Ksp小的物质不能转化为Ksp大的物质。
【易错提醒】(1)沉淀溶解平衡移动过程是固体溶解和析出的相互转化过程,属于物理变化,但遵循勒夏特列原理。
(2)沉淀溶解达到平衡时,再加入该难溶物对平衡无影响。
(3)用沉淀法除杂不可能将杂质离子全部通过沉淀除去。一般认为残留在溶液中的离子浓度小于1×10-5 ml·L-1时,沉淀已经完全。
(4)对于化学式中阴、阳离子个数比不同的难溶物,不能直接根据Ksp的大小来确定其溶解能力的大小,需通过计算转化为溶解度。
4.分步沉淀:若一种沉淀剂可使溶液中多种离子产生沉淀时,则可控制反应条件,使这些离子先后分别沉淀。
(1)对同一类型的沉淀,Ksp越小越先沉淀,且Ksp相差越大分步沉淀效果越好。如在Cl-、Br-、I-的混合溶液中,由于AgCl、AgBr、AgI的Ksp相差较大,逐滴加入Ag+可按Cl-、Br-、I-的顺序先后沉淀,即Ksp最小的首先沉淀出来。
(2)对不同类型的沉淀,其沉淀先后顺序要利用Ksp计算溶液中离子的浓度,根据离子浓度的大小来判断沉淀的先后顺序,如AgCl和Ag2CrO4的分步沉淀,可通过控制Ag+浓度来完成。
考向1 考查沉淀的生成与溶解
考向2 考查沉淀的转化
知识点1 溶度积及其应用
2.对“Ksp”的理解
(1)Ksp只与温度有关,与浓度无关,升高温度,大多数固体难溶电解质的Ksp增大,但Ca(OH)2却相反。
(2)对于Ksp表达式类型相同的物质,如Mg(OH)2和Zn(OH)2,Ksp的大小反映了难溶电解质在溶液中的溶解能力的大小,一般Ksp越小,溶解度越小。
(3)对于阴、阳离子的个数比不同的难溶电解质,它们的溶解度不能直接用Ksp的大小来比较,如AgCl(Ksp=1.8×10-10)、Ag2CrO4(Ksp=1.0×10-12),Ag2CrO4溶液中的c(Ag+)大于AgCl溶液中的c(Ag+)。
①Ksp只与难溶电解质的性质和温度有关,而与沉淀的量和溶液中离子浓度无关。
③不同类型的物质,Ksp差距不大时不能直接作为比较依据。如(25 ℃):
②同温条件时,对于同类型物质,Ksp数值越大,难溶电解质在水中的溶解能力越强。如由Ksp数值可知,溶解能力:AgCl>AgBr>AgI,Cu(OH)2<Mg(OH)2。
(2)沉淀开始和沉淀完全时溶液pH的计算方法:
[以Cu(OH)2为例]室温下,向2 ml·L-1 CuSO4溶液中逐滴加入NaOH溶液调节溶液的pH至多少时开始沉淀?调节溶液pH至多少时Cu2+沉淀完全?(已知:室温下Ksp[Cu(OH)2]=2.0×10-20,离子浓度小于10-5 ml·L-1时视为Cu2+沉淀完全)
①沉淀开始时pH的求算。
②沉淀完全时pH的求算。
1.内因:难溶物质本身的性质,这是主要决定因素。
知识点2 溶度积的影响因素
①浓度:加水稀释,平衡向溶解方向移动,但Ksp不变。
②温度:绝大多数难溶盐的溶解是吸热过程,升高温度,平衡向溶解方向移动,Ksp增大。
③其他:向平衡体系中加入可与体系中某些离子反应生成更难溶物质或更难电离物质或气体的离子时,平衡向溶解方向移动,但Ksp不变。
【易错提醒】(1)Ksp只与难溶电解质的性质和温度有关,与沉淀的量无关。
(2)溶液中离子浓度的变化只能使溶解平衡移动,并不能改变溶度积。
(3)沉淀的生成和溶解相互转化的条件是离子浓度的大小,改变反应所需的离子浓度,可使反应向着所需的方向转化。
(4)Ksp小的难溶电解质也能向Ksp大的难溶电解质转化,需看溶液中生成沉淀的离子浓度的大小。
考向1 考查溶度积及其计算
考向2 考查溶度积的影响因素
1.沉淀滴定曲线是沉淀滴定过程中构成难溶电解质的离子浓度与滴定剂加入量之间的关系曲线,以向10 mL 0.1 ml·L-1 CuSO4溶液中滴加0.1 ml·L-1的K2S溶液溶液为例,滴加过程中溶液中-lgc(Cu2+)与K2S溶液体积(V)的关系曲线如图:
①曲线上任一点都代表平衡点,c(Cu2+)·c(S2-)=Ksp。
知识点1 沉淀滴定曲线图像
②滴定终点时(b点)为饱和CuS溶液,c(Cu2+)=c(S2-)。
③滴定终点以前线上点(如a点),代表c(Cu2+)>c(S2-);
滴定终点以后线上点(如c点),代表c(Cu2+)<c(S2-)。
2.解答有关沉淀滴定图像的步骤
(1)明确图像中横、纵坐标的含义,横坐标通常是加入滴定剂的体积,纵坐标通常是离子浓度或其对数值。
(2)找到滴定终点,即为饱和溶液,求算Ksp。
(3)理解图像中线上点、线外点的含义。
1.溶度积曲线是难溶电解质饱和溶液中离子浓度之间的关系曲线,以AgCl悬浊液为例,溶度积曲线如图:
知识点2 沉淀溶解平衡图像
①曲线上任一点都代表沉淀溶解平衡状态,即Qc=Ksp。
③曲线下方区域均为不饱和溶液,即Qc<Ksp。
②曲线上方区域均为过饱和溶液,即Qc>Ksp。
④升高温度,曲线向右上方平移。
2.沉淀溶解平衡对数曲线是难溶电解质饱和溶液中离子浓度对数值之间的关系曲线,以CdCO3饱和溶液为例,溶度积曲线如图:
①直线上任一点都代表沉淀溶解平衡状态,即Qc=Ksp。
③曲线下方区域均为过饱和溶液,即Qc>Ksp。
②曲线上方区域均为不饱和溶液,即Qc<Ksp。
④升高温度,直线向左下方平移。
3.分析沉淀溶解平衡图像的三步骤
(1)明确图像中纵、横坐标的含义
(2)理解图像中线上的点、线外点的含义
(3)抓住Ksp的特点,结合选项分析判断
考向1 考查沉淀滴定曲线图像分析
考向2 考查沉淀溶解平衡图像分析
相关课件
这是一份2024届高三化学高考备考一轮复习专题:难溶电解质的溶解平衡课件,共30页。PPT课件主要包含了沉淀溶解平衡,沉淀和溶解,溶解平衡的应用,1沉淀的生成,+3N,2沉淀的溶解,3沉淀的转化,答案×,答案①⑥,答案Cu2+等内容,欢迎下载使用。
这是一份新高考化学一轮复习课件 第8章 第52讲 难溶电解质的溶解平衡,共60页。PPT课件主要包含了高考化学一轮复习策略,难溶电解质的溶解平衡,沉淀溶解平衡及应用,归纳整合,专项突破,溶度积常数及其应用,真题演练明确考向,课时精练等内容,欢迎下载使用。
这是一份人教版高考化学一轮复习8.4难溶电解质的溶解平衡课件








