

所属成套资源:新高考化学二轮复习精选练习专题 (含解析)
新高考化学二轮复习精选练习专题09 化学反应速率与化学平衡 (含解析)
展开
这是一份新高考化学二轮复习精选练习专题09 化学反应速率与化学平衡 (含解析),共15页。
专题09 化学反应速率与化学平衡
1.将4份等量的铝片分别加到足量的下列溶液中充分反应后,产生氢气量最快的是
A.溶液 B.溶液
C.溶液 D.溶液
【答案】C
【解析】铝和稀硝酸反应生成NO,不会放出氢气,铝和醋酸、硫酸、盐酸反应实质是和氢离子反应,氢离子浓度越大放出氢气越快,硫酸是二元强酸,盐酸是一元强酸,醋酸是一元弱酸,相同浓度的三种酸开始时氢离子浓度由大到小的顺序为:硫酸>盐酸>醋酸,所以铝和相同浓度的醋酸、硫酸、盐酸,放出氢气最快的是硫酸,答案选C。
2.下列生产中,不涉及勒夏特列原理的是
A.合成氨 B.饱和氨盐水中通制碳酸氢钠
C.和制 D.侯氏制碱法处理母液
【答案】C
【解析】合成氨反应为可逆反应,生产中一定涉及勒夏特列原理,故A不符合题意;饱和氨盐水中存在着氨水的电离平衡,则饱和氨盐水中通二氧化碳制碳酸氢钠一定涉及勒夏特列原理,故B不符合题意;氢气与氯气制氯化氢的反应不是可逆反应,氯化氢的生产中不一定涉及勒夏特列原理,故C符合题意;侯氏制碱法的母液中存在铵根离子和碳酸氢根离子的水解平衡,向母液中加碱溶液,碳酸氢根离子和铵根离子均能与氢氧根离子反应,则侯氏制碱法处理母液时一定涉及勒夏特列原理,故D不符合题意;故选C。
3.反应A(g)+3B(g)2C(g) 达到平衡后,将反应体系的温度降低,下列叙述中正确的是
A.正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B.正反应速率减小,逆反应速率增大,平衡向逆反应方向移动
C.正反应速率和逆反应速率都减小,平衡向正反应方向移动
D.正反应速率和逆反应速率都减小,平衡向逆反应方向移动
【答案】C
【解析】反应A(g)+3B(g)2C(g)的焓变,即该反应正向放热,反应达到平衡后,降低温度,正逆反应速率都将减小,降低温度,平衡将向放热反应移动,即平衡向正反应方向移动,故答案为C。
4.以、和为原料,制备和氯化亚砜()的原理为: 。下列说法正确的是
A.反应平衡常数
B.键断裂的同时有键形成,说明反应到达该条件下的平衡状态
C.使用催化剂可以同时降低正反应和逆反应的活化能
D.上述反应中消耗的,转移电子数为
【答案】C
【解析】反应中为固体,由化学方程式可知,反应平衡常数,A错误;1mol键断裂的同时有键形成,描述的都是正反应,不能说明反应到达该条件下的平衡状态,B错误;催化剂改变反应历程,加快反应速率;使用催化剂可以同时降低正反应和逆反应的活化能,C正确;没有标况,不能计算转移的电子数,D错误;故选C。
5.对某一可逆反应来说,升高温度的作用是
A.提高反应物的平衡转化率 B.改变平衡混合物的组成
C.降低反应物和生成物的键能 D.加快正反应速率,减慢逆反应速率
【答案】B
【解析】升高温度,平衡不一定正向移动,若为吸热反应,升温平衡逆向移动,反应物的平衡转化率减小,故A错误;化学反应一定伴随能量的变化,可能为放热反应,也可能为吸热反应,升温平衡可能正向移动,也可能逆向移动,故升高温度能改变平衡混合物的组成,故B正确;反应物和生成物的键能不随温度的改变而改变,故C错误;升高温度,正、逆反应速率均增大,故D错误;故选B。
6.氯气、氯盐、次氯盐[]、二氧化氯在生产生活中具有广泛应用。Deacon曾提出在催化剂作用下,通过氧气直接氧化氯化氢成功制备氯气。该反应具有一定的可逆性,热化学方程式可表示: ;二氧化氯(ClO2)为新型绿色消毒剂,沸点为9.9℃,可溶于水,有毒,浓度较高时易发生爆炸。用浓盐酸和NaClO3反应可制得ClO2.关于Deacon提出的制Cl2的反应,下列有关说法正确的是
A.该反应的
B.每生成22.4LCl2(已折算成标准状况),放出58kJ的热量
C.升高温度,核反应v (逆)增大,v (正)减小,平衡向逆反应方向移动
D.断裂4molH—Cl键的同时,有4molH—O键生成,说明该反应达到平衡状态
【答案】B
【解析】反应为气体分子数减小的反应,为熵减反应,A错误;由热化学方程式可知,每生成22.4LCl2(已折算成标准状况,为1mol),放出116kJ÷2=58kJ的热量,B正确;升高温度,正逆反应速率均会变大,C错误;断裂4molH—Cl键的同时,有4molH—O键生成,描述的都是正反应,不能说明该反应达到平衡状态,D错误;故选B。
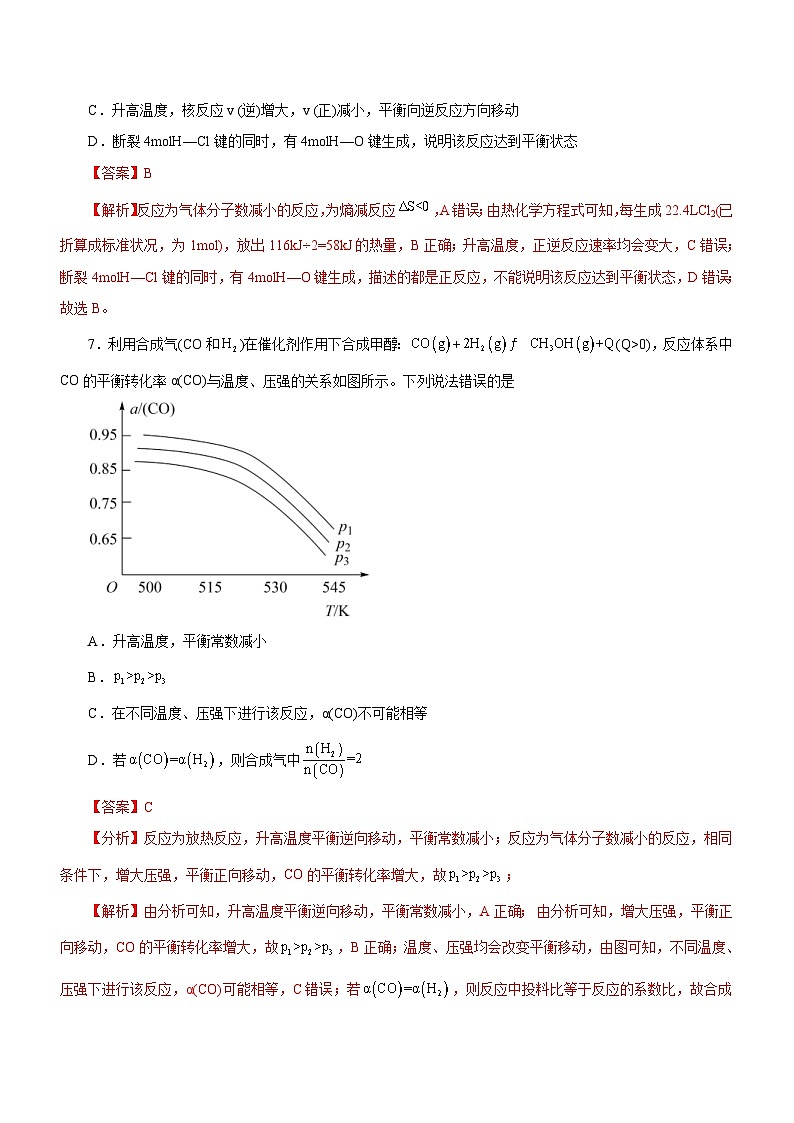
7.利用合成气(CO和)在催化剂作用下合成甲醇:(Q>0),反应体系中CO的平衡转化率α(CO)与温度、压强的关系如图所示。下列说法错误的是
A.升高温度,平衡常数减小
B.
C.在不同温度、压强下进行该反应,α(CO)不可能相等
D.若,则合成气中
【答案】C
【分析】反应为放热反应,升高温度平衡逆向移动,平衡常数减小;反应为气体分子数减小的反应,相同条件下,增大压强,平衡正向移动,CO的平衡转化率增大,故;
【解析】由分析可知,升高温度平衡逆向移动,平衡常数减小,A正确; 由分析可知,增大压强,平衡正向移动,CO的平衡转化率增大,故,B正确;温度、压强均会改变平衡移动,由图可知,不同温度、压强下进行该反应,α(CO)可能相等,C错误;若,则反应中投料比等于反应的系数比,故合成气中,D正确;故选C。
9.甲烷水蒸气催化重整是制备高纯氢的方法之一,反应为CH4(g)+H2O(g)⇌CO(g)+3H2(g)。在不同温度下,向a、b两个恒温恒容的密闭容器中均通入1.1mol CH4(g)和1.1mol H2O(g),测得容器a中CO物质的量、容器b中H2物质的量随时间的变化曲线如图所示(已知容器a、b的体积为2L)。下列说法正确的是 ( )
A.该反应为放热反应
B.两容器达到平衡时,b容器中CO的体积分数大于a容器
C.a容器前4min用CH4表示的平均反应速率为0.125mol/(L∙min)
D.a容器达到平衡后,再充入1.1mol CH4(g)和1molCO(g),此时v正<v逆
【答案】C
【解析】已知在a、b两个恒温、恒容的密闭容器中,充入相同量的甲烷和水,生成氢气的计量数是CO的3倍,结合图像可知,b为H2(g)的图像,其转化为CO(g)时,物质的量为0.6mol;a为CO(g)的图像,a达到平衡所用的时间比b段,则a的温度高于b,升高温度,CO的物质的量增大,即平衡正向移动,故正反应为吸热反应。分析可知,该反应为吸热反应,A说法错误;分析可知,b表示H2(g)的图像,其转化为CO(g)时,达到平衡时,物质的量为0.6mol,a容器中两容器达到平衡时,b容器中CO的体积分数小于a容器,B说法错误;根据图像,a容器前4min CO的物质的量为1.0mol,用CH4表示的平均反应速率为=0.125mol/(L∙min),C说法正确;a容器达到平衡时,
再充入1.1mol CH4(g)和1molCO(g),K=>Qc=,平衡正向移动,v正>v逆,D说法错误;答案为C。
10.利用现代传感技术探究压强对 2NO2(g) N2O4(g)平衡移动的影响。在恒定温度和标准压强条件下,往针筒中充入一定体积的 NO2 气体后密封并保持活塞位置不变。分别在 t1、t2 时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如图所示。下列分析中不正确的是( )
A.t1 时移动活塞,使容器体积增大
B.在 B、E 两点,对应的正反应速率:v(B)>v(E)
C.图中除 A、C、F 点外,其他点均为平衡状态
D.在 E,F,H 三点中,H 点的气体平均相对分子质量最大
【答案】C
【解析】由图可知,t1 时移动活塞,针筒内气体压强迅速减小,说明针筒的体积增大,故A正确;针筒内气体压强越强越大,化学反应速率越大,由图可知,B点压强大于E点,则对应的正反应速率:v(B)>v(E),故B正确;由图可知,除 A、C、F 点外,G点也没有达到平衡,故C错误;由质量守恒定律可知,E,F,H 三点中气体的质量相同,由图可知,t2 时移动活塞,针筒内气体压强迅速增大,说明针筒的体积减小,增大压强,平衡向正反应方向移动,混合气体的物质的量减小,则E,F,H 三点中,H 点的气体物质的量最小,平均相对分子质量最大,故D正确;故选C。
11.在恒容密闭容器中充入气体和,发生反应 ,所得实验数据如表所示。下列说法正确的是 ( )
实验编号
温度/℃
起始
起始
平衡
①
300
②
500
③
500
A.上述反应的
B.时测得①中,则内
C.500℃时,该反应的平衡常数
D.实验③中反应达到平衡时,的转化率小于20%
【答案】D
【解析】由实验①和实验②中数据可知,升高温度,平衡时C的物质的量减少,说明平衡逆向移动,则正反应为放热反应,,选项A错误;D是固体,故不能用D的浓度变化来表示反应速率,选项B错误;
500℃时,由实验②可知反应达到平衡状态时,c(C)==0.04mol/L,c(A)==0.16mol/L,c(B)==0.01mol/L,K=,选项C错误;实验②与实验③的温度相同,容器的容积相同,而实验③反应物的用量恰好是实验②的一半,即相当于减压,减压使平衡向气体分子数增大的方向移动,所以实验③中反应达到平衡后,反应物的转化率小于实验②(实验②中的平衡转化率为20%),选项D正确。答案选D。
12.温度为T1时,在容积为10 L的恒容密闭容器充入一定量的M (g)和N (g),发生反应。反应过程中的部分数据如表所示,下列说法正确的是( )
t/min
0
5
10
n(M)/ mol
6.0
4.0
n(N)/ mol
3.0
1.0
A.T2时该反应的化学平衡常数为0.64,则T1>T2
B.0-5 min内,用M表示的平均反应速率为0.4 mol∙L-1∙min-1
C.该反应在第8 min时v逆>v正
D.当M、N的转化率之比保持不变时,可判断该反应达到平衡状态
【答案】A
【解析】根据表格信息,可列三段式:,再结合10min时的数据可知温度为T1时,反应在5min时已达到平衡,在该温度下的平衡常数为:,由此解答。该反应为吸热反应,升高温度,平衡正向进行,平衡常数增大,已知T1时该反应的化学平衡常数为0.8,T2时该反应的化学平衡常数为0.64,故T1>T2,A正确;根据三段式可知,0-5 min内,用M表示的平均反应速率为,B错误;根据分析可知,反应在5min时达到平衡状态,故在第8 min时v逆=v正,C错误;根据反应方程式M、N的化学计量数之比可知,二者的转化率之比始终保持不变,是个定值,故D错误;答案选A。
13.工业上,用天然气处理废气中的发生反应为 △H。某小组在刚性密闭容器充入lmol (g)和2mol (g)在不同温度下仅发生上述反应,测得的浓度()变化如下表所示。
时间温度
0
5min
10min
15min
20min
25min
℃
1.00
0.70
0.65
0.60
0.60
0.60
℃
1.00
0.80
0.70
0.65
0.50
0.50
下列叙述错误的是
A.上述反应温度T:
B.℃下,若开始加入催化剂,则平衡所用时间小于15min
C.℃下,20min时充入少量,则平衡转化率增大
D.℃下,上述反应的平衡常数
【答案】D
【解析】观察表格数据,其他条件相同,℃下,浓度变化较快,速率较大,即温度较高;观察平衡时浓度知,℃→℃时降低,平衡时浓度减小,说明平衡向正反应方向移动,即正反应是放热反应,降温时平衡常数增大,A项正确;加入催化剂,反应加快,缩短达到平衡的时间,B项正确;达到平衡时充入,则平衡向正反应方向移动,的平衡转化率增大,C项正确;℃下平衡时,,,,代入数据可计算,D项错误;故选D。
14.T℃时在2 L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积分数与时间的关系如图2所示。则下列结论正确的是
A.反应进行的前3 min内,用X表示的反应速率v(X)=0.3 mol/(L·min)
B.容器中发生的反应可表示为3X(g)+Y(g)2Z(g)
C.保持其他条件不变,升高温度,反应的化学平衡常数K减小
D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
【答案】B
【解析】根据图1所示可知反应进行的前3 min内,X的浓度减小了△c(X)=2.0 mol/L-1.4 mol/L=0.6 mol/L,则用X表示的化学反应速率v(X)=,A错误;根据图示可知:在反应过程中X、Y浓度减小,Z浓度增加,反应进行到3 min时三种物质都存在,且它们的浓度不再发生变化,说明该反应是可逆反应,其中X、Y是反应物,Z是生成物,在前3 min内X、Y、Z三种物质的浓度变化分别是0.6 mol/L、0.2 mol/L、0.4 mol/L,三种物质的变化变化的比为3:1:2,故反应方程式可表示为3X(g)+Y(g)2Z(g),B正确;在其它条件不变时,温度升高,化学反应速率加快,达到平衡所需时间缩短。根据图2可知温度:T2>T1。升高温度,Y的体积分数减少,说明升高温度,化学平衡正向移动,导致反应的化学平衡常数K增大,C错误;若改变反应条件,使反应进程如图3所示,反应达到平衡所需时间缩短,但各种物质的含量不变,说明化学平衡不移动。由于反应3X(g)+Y(g)2Z(g)是反应前后气体体积改变的反应,则改变的条件应该是使用了催化剂,而不可能是增大体系的压强,D错误;故合理选项是B。
15.体积为1L的恒温恒容密闭容器中发生反应:,A、B浓度随时间变化关系如下图所示。下列说法不正确的是
A.曲线X表示A的浓度随时间的变化
B.25~30min内用A表示的平均化学反应速率是
C.气体总压不随时间变化可以说明该反应达到平衡状态
D.反应进行至25min时,曲线发生变化的原因是增加A的浓度
【答案】B
【分析】10min内X变化量为0.6-0.2=0.4mol/L,Y的变化量为0.6-0.4=0.2mol/L,根据反应方程式可知X为A,Y为B;
【解析】根据分析可知曲线X表示A的浓度随时间的变化,故A正确;25~30min内,,A表示的平均化学反应速率是,故B错误;该反应是前后气体分子数变化的反应,当压强不变了可以说明该反应达到平衡状态,故C正确;反应进行至25min时,曲线A瞬间增大,B是连续的点,所以发生变化的原因是增加A的浓度,故D正确; 故答案为B。
16.向密闭容器中充入S2Cl2、Cl2和SCl2,发生反应,S2Cl2与SCl2的初始消耗速率(v)与温度(T)的关系如图所示(图中A、B点处于平衡状态),下列说法不正确的是
A.a为v(SCl2)随温度的变化曲线
B.该反应的ΔH
相关试卷
这是一份新高考化学二轮复习检测卷专题09 化学反应速率与化学平衡(含解析),共15页。试卷主要包含了25倍,5和pH = 8等内容,欢迎下载使用。
这是一份新高考化学二轮复习精品讲义专题09 化学反应速率与化学平衡(含解析),共14页。
这是一份(通用版)高考化学二轮复习专题测试六化学反应速率与化学平衡(含解析),共13页。试卷主要包含了4 kJ·ml-1,2 kJ/ml,0 kJ/ml,0 kJ·ml-1等内容,欢迎下载使用。








