






还剩33页未读,
继续阅读
成套系列资料,整套一键下载
- 新教材2023_2024学年高中化学第1章认识化学科学微专题1阿伏加德罗常数及计算课件鲁科版必修第一册 课件 0 次下载
- 新教材2023_2024学年高中化学第1章认识化学科学微项目探秘膨松剂__体会研究物质性质的方法和程序的实用价值课件鲁科版必修第一册 课件 0 次下载
- 新教材2023_2024学年高中化学第1章认识化学科学第2节第2课时研究物质性质的基本程序课件鲁科版必修第一册 课件 0 次下载
- 新教材2023_2024学年高中化学第1章认识化学科学第3节第1课时物质的量及其单位摩尔质量课件鲁科版必修第一册 课件 0 次下载
- 新教材2023_2024学年高中化学第1章认识化学科学第3节第2课时气体摩尔体积课件鲁科版必修第一册 课件 0 次下载
新教材2023_2024学年高中化学第1章认识化学科学第2节第1课时研究物质性质的基本方法课件鲁科版必修第一册
展开
这是一份新教材2023_2024学年高中化学第1章认识化学科学第2节第1课时研究物质性质的基本方法课件鲁科版必修第一册,共41页。
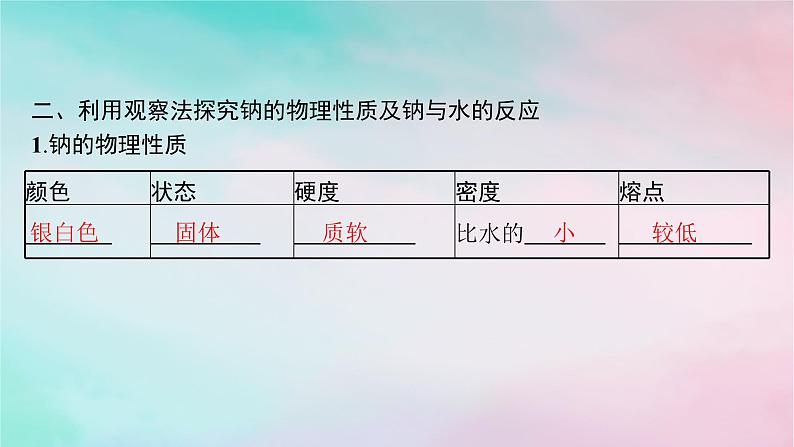
第1章 认识化学科学第2节 第1课时 研究物质性质的基本方法素 养 目 标1.通过对金属钠的性质探究等一系列科学探究活动,认识钠是一种非常活泼的金属单质,了解金属钠的物理性质、主要化学性质,形成科学探究与创新意识的化学核心素养。2.通过观察、分析实验现象,体会如何科学、合理地运用观察方法。在归纳金属钠的性质的过程中,体验分类、比较等方法在研究和学习物质性质过程中的重要应用,培养宏观辨识与微观探析的化学核心素养。3.激发学习化学的兴趣,同时树立安全意识和环保意识,形成科学态度与社会责任的化学核心素养。基础落实·必备知识全过关重难探究·能力素养全提升目 录 索 引 学以致用·随堂检测全达标基础落实·必备知识全过关一、研究物质性质的四种基本方法1.研究物质的性质,通常有 、实验、 、比较等方法。 2.观察法(1)定义:有计划、有目的地运用 考察研究对象的方法。 (2)方式:用肉眼看、用鼻子闻、借助仪器观察等。3.运用分类的方法,总结各类物质的 ,并根据物质所属的类别对物质及其变化进行 。 4.运用比较的方法,认识各种物质性质之间的 ,以及各种物质性质之间的内在 。 观察 分类 感官 一般性质 预测 异同 联系 二、利用观察法探究钠的物理性质及钠与水的反应1.钠的物理性质银白色 固体 质软 小 较低 2.钠与水的反应观察并记录结果,分析得出结论:小 低 放热 红 碱 2Na+2H2O══2NaOH+H2↑ 【微思考1】将绿豆粒大小的一块钠加入硫酸铜溶液中能生成铜单质吗? 【微思考2】可以用手直接拿取或接触钠块吗?为什么? 提示 不能。因为钠首先与水反应生成NaOH,NaOH与硫酸铜发生复分解反应生成蓝色的氢氧化铜沉淀和硫酸钠。提示 不能。手上含有少量水,钠与水反应放出的热会灼烧皮肤,且生成的NaOH会腐蚀皮肤。3.钠与氧气的反应实验探究银白色 变暗 银白色 小 低 4Na+O2══2Na2O 闪亮 黄 淡黄色 4.Na2O和Na2O2的比较(1)物理性质。氧化钠是一种 固体,过氧化钠是一种 固体。 (2)化学性质。Na2O、Na2O2与H2O反应的化学方程式分别为 ; 。 Na2O、Na2O2分别与CO2反应的化学方程式为Na2O+CO2══Na2CO3, 。 (3)用途。Na2O2可用于 和 中氧气的来源。 白色 淡黄色 Na2O+H2O══2NaOH 2Na2O2+2H2O══4NaOH+O2↑ 2Na2O2+2CO2══2Na2CO3+O2 呼吸面具 潜水艇 5.钠的保存及用途(1)保存。金属钠通常保存在煤油中或石蜡油中。(2)用途。【微思考3】从试剂瓶中取出的药品、试剂是否都不能放回原试剂瓶? 提示 一般的试剂在取出后不能放回原试剂瓶,但是取出后未用完的金属钠要放回原试剂瓶中,不能随便丢弃。提示 ①4Na+O2══2Na2O;②Na2O+H2O══2NaOH;③2NaOH+CO2+9H2O══Na2CO3·10H2O;④Na2CO3·10H2O══Na2CO3+10H2O。判断下列说法是否正确,正确的画“√”,错误的画“×”。1.通过观察物质的颜色、气味、状态可了解其物理性质,通过实验可了解其化学性质。( )2.金属钠着火可用水扑灭。( )3.Na2O2与Na2O固体中阳离子与阴离子的个数比均为2∶1。( )4.钠与CuSO4溶液反应可置换出铜。( )5.把钠投入稀硫酸中,钠先和水发生反应,再与H2SO4发生反应。( )√×√××6.Na与足量O2反应生成Na2O,随着温度的升高,生成Na2O的速率逐渐加快。( )7.Na2O2可使酚酞溶液变红。( )8.Na2O2在潮湿的空气中放置一段时间,变成白色黏稠物的原因是2Na2O2+2CO2══2Na2CO3+O2。( )×××重难探究·能力素养全提升探究1 钠与溶液的反应人们常说,水能灭火,水火不相容。有一个非常有趣的实验:将一小块金属钠放在酒精灯的灯芯处,用玻璃棒蘸取少许水点在灯芯上,酒精灯竟然被点燃了。(1)这一小块银白色的物质是金属钠,少许水点在上面的时候,发生了什么反应?提示 钠与水发生反应,生成氢氧化钠和氢气。 (2)该反应为什么能将酒精灯点燃? 提示 钠与水反应放出大量的热,使酒精灯被点燃。 (3)金属钠在储存的时候应注意什么问题? 提示 金属钠在储存的时候一定要密封保存,少量的金属钠应置于煤油或石蜡油中保存。钠与水反应的延伸应用 1.将绿豆粒大小的钠块放入如图所示的烧杯中,可能出现的现象是( )A.钠块只在煤油层中游动,并放出气体B.钠块只在水层中游动,钠块熔化,水层变红C.钠块在煤油和水两种液体界面处反应,熔化成小球并上下跳动,水层变红D.钠块在四氯化碳和水两种液体界面处反应,熔化成小球并上下跳动,水层变红C解析 由题图可知,三种液体的密度:四氯化碳>水>煤油,而钠的密度为0.97 g·cm-3,介于水和煤油的密度之间,故将绿豆粒大小的钠块投入烧杯中,钠块在煤油和水两种液体界面处反应,钠的下部与水接触并反应,产生H2推动钠向上游动,进入煤油层后,反应停止,由于钠受到的重力大于浮力,随后钠块下沉,又回落到煤油和水的界面上,重复上述过程,故钠块在水层与煤油层界面处游动并上下跳动,因钠与H2O反应生成NaOH,则滴有少量酚酞的水变红。2.[2023安徽淮北高一期中]按如图所示进行相应实验,下列有关它们反应现象的分析错误的是( )A.均有可燃性气体生成B.钠均浮在液面上反应,并四处游动C.丙中钠能置换出单质铜D.反应剧烈程度:乙>甲C解析 钠与水反应生成氢氧化钠和氢气,钠与盐酸反应生成氯化钠和氢气,钠与硫酸铜溶液反应生成硫酸钠、氢氧化铜、氢气,反应均有可燃性气体生成,A正确;钠的密度比水小,反应放出气体,所以钠均浮在液面上反应,并四处游动,B正确;钠放入硫酸铜溶液中,钠先和水反应生成氢氧化钠和氢气,氢氧化钠再和硫酸铜反应生成氢氧化铜沉淀和硫酸钠,丙中钠不能置换出单质铜,C错误;乙中氢离子浓度大于甲,故反应剧烈程度:乙>甲,D正确。探究2 Na2O2的性质水能灭火,但是水也可以用来生火。有一个非常神奇的滴水取火的实验:取一团脱脂棉,在里面放少许淡黄色的Na2O2粉末,小心地将两滴水滴进去,脱脂棉竟然燃烧起来了。(1)描述滴水后淡黄色粉末发生的反应并写出相应的化学方程式。 (2)结合物质燃烧需要的条件,分析发生上述实验现象的原因。 提示 过氧化钠与水反应生成氢氧化钠并放出氧气,2Na2O2+2H2O══4NaOH+O2↑。提示 Na2O2与水反应放热并产生O2,使脱脂棉的温度升高而被点燃。 1.Na2O2与Na2O性质的比较 2.Na2O2与CO2、H2O反应的规律(1)从质量的角度分析。2Na2O2+2H2O══4NaOH+O2↑①2Na2O2+2CO2══2Na2CO3+O2②对于反应①,反应后Na2O2固体增加的质量实际相当于水中H元素的质量,该过程可以认为是Na2O2 2NaOH+O;对于反应②,反应后Na2O2固体增加的质量实际上相当于CO2中碳元素和一半氧元素的质量,该过程可以认为是Na2O2 Na2CO3+O。进一步分析还可得出关系式Na2O2+H2══2NaOH,Na2O2+CO══Na2CO3。实际上这两个反应均不能发生,只是从质量的角度可看作Na2O2只吸收了H2和CO,Na2O2增加的质量等于H2和CO的质量。这样在分析H2和CO在氧气中燃烧的产物被Na2O2完全吸收后固体质量的变化时会变得很方便。凡分子组成符合(CO)m·(H2)n的物质,W g该物质在O2中完全燃烧后的产物(CO2和水蒸气)与足量的Na2O2固体反应后,固体增加的质量为W g。或是由C、H、O三种元素组成的物质,只要该物质中C、O原子个数比为1∶1,也可满足该变化。(2)先后顺序关系。当CO2、H2O(g)与足量的Na2O2同时接触时,由于Na2O2与H2O反应生成的NaOH能与CO2反应生成Na2CO3,所以可以视为Na2O2先与CO2反应,待CO2反应完全后,Na2O2再与H2O(g)反应。1.过氧化钠可在呼吸面具和潜水艇中作为供氧剂,实验室可用如下装置进行验证(A是实验室中制取CO2的装置,C中盛放的是过氧化钠)。下列说法不正确的是( )A.装置A中发生反应的离子方程式为CaCO3+2H+══Ca2++CO2↑+H2OB.装置B中盛放饱和NaHCO3溶液,目的是除去CO2中的HCl气体C.装置C中消耗7.8 g Na2O2时,反应生成1.6 g O2D.装置D是安全瓶,防止E中水倒流进入C中D解析 实验室利用CaCO3与稀盐酸反应制取CO2,该反应的离子方程式为CaCO3+2H+══Ca2++CO2↑+H2O,A正确;装置A中制得的CO2中混有挥发出的HCl,用饱和NaHCO3溶液可除去CO2中的HCl气体,B正确;根据反应2Na2O2+2CO2══2Na2CO3+O2可知,消耗156 g Na2O2时生成32 g O2,则消耗7.8 g Na2O2时反应生成1.6 g O2,C正确;装置E用于收集反应生成的O2,装置D中可盛放NaOH溶液,用于吸收C中未反应的CO2,D错误。【变式设问】根据装置F中收集O2的质量计算消耗Na2O2的质量,若缺少装置D,对计算结果有什么影响?为什么?提示 计算结果偏大;缺少装置D时,会有未反应的CO2进入装置F。 2.下列说法正确的是( )①在空气中加热金属钠产物呈淡黄色②过氧化钠能与酸反应生成盐和水,所以过氧化钠是一种碱③过氧化钠能与水反应,所以过氧化钠可以作为气体的干燥剂④过氧化钠中阴阳离子个数比为1∶1⑤钠可以从锆、铌等金属的卤化物的水溶液中置换出相应的金属单质⑥Na2O2分别与水及CO2反应产生相同量的O2时,需要水和CO2的质量相等⑦可用水来检验某Na2O粉末中是否含有Na2O2⑧将足量的Na2O2、Na2O分别加到含酚酞的溶液中,最终溶液均为红色A.①②⑤⑦ B.①⑦C.①②⑤⑧ D.①⑧B解析 在空气中加热金属钠时生成淡黄色的Na2O2,①正确;过氧化钠是一种氧化物,②错误;Na2O2与水反应生成O2,可能引入新杂质,③错误;Na2O2中含有Na+和 ,所以过氧化钠中阴阳离子个数比为1∶2,④错误;钠能够与水反应,故钠不能从锆、铌等金属的卤化物的水溶液中置换出金属单质,⑤错误;根据反应2Na2O2+2CO2══2Na2CO3+O2、2Na2O2+2H2O══4NaOH+O2↑可知,Na2O2分别与CO2和水反应产生相同量的O2时,需要CO2和水的质量不相等,⑥错误;Na2O与水反应生成NaOH, Na2O2与水反应生成NaOH和O2,故可用水来检验某Na2O粉末中是否含有Na2O2,⑦正确;将足量的Na2O2、Na2O分别加到含酚酞的溶液中,二者都生成NaOH,因为Na2O2具有漂白性而能使有色物质褪色,所以最终加Na2O的酚酞溶液为红色,而加Na2O2的酚酞溶液为无色,⑧错误。学以致用·随堂检测全达标12341.下列关于金属钠的叙述正确的是( )A.金属钠可以保存在煤油中B.金属钠着火时,可用水来灭火C.钠与硫酸铜溶液反应可置换出铜D.实验时用剩的钠块不能放回原试剂瓶A解析 金属钠的密度比煤油大且不与煤油反应,故钠可以保存在煤油中,A正确;金属钠着火时生成过氧化钠,用水灭火时,过氧化钠与水反应生成的氧气可以助燃,同时钠与水反应生成易燃、易爆的氢气,B不正确;将钠投入硫酸铜溶液后,钠先与水反应生成氢气和氢氧化钠,然后氢氧化钠与硫酸铜反应,不会置换出铜,C不正确;实验时用剩的钠块,应该放回原试剂瓶,D不正确。12342.[2023广东深圳实验学校高一阶段考]过氧化物常用作潜水器、航天器的供氧剂,下列有关Na2O和Na2O2两种钠的氧化物说法正确的是( )A.钠与氧气反应时的产物主要取决于氧气的用量及纯度B.等质量的两种氧化物中含有的离子总数相同C.6.2 g Na2O和7.8 g Na2O2分别溶于等量水中,所得溶液中溶质的质量分数不同D.Na2O是白色的固体,Na2O2是淡黄色的固体粉末D1234解析 钠与氧气反应时的产物主要取决于反应条件,常温下反应生成Na2O,加热反应生成Na2O2,A错误;Na2O和Na2O2均由2个钠离子和1个阴离子构成,等质量时,含有的离子总数不相同,B错误;6.2 g Na2O和7.8 g Na2O2溶于等量水中发生反应,所得溶质均为8.0 g NaOH,且溶液质量相等,则所得溶液中溶质的质量分数相等,C错误;Na2O是白色固体,Na2O2是淡黄色固体粉末,D正确。12343.已知用金属钠制取氧化钠的方法有许多,下列方法最好且解释合理的是( )C1234解析 钠与纯氧气反应生成氧化钠,虽然产物唯一,但无法确定反应是否完全,故不选A;钠与二氧化碳在加热条件下反应生成氧化钠和碳,氧化钠又能与二氧化碳反应生成碳酸钠,故不选B;C项中反应是工业制取氧化钠最常见的方法,产生的氮气和固体易分离,目标产物中无杂质,而且亚硝酸钠属于工业常用盐,价格低,它提供一部分的钠元素,从而减少较贵重的金属钠的用量,且生成的N2可保护Na2O不被进一步转化为Na2O2,故选C;钠放置在空气中不仅与氧气反应还与水蒸气反应,所以产物不纯,故不选D。12344.向过氧化钠与水反应后的溶液中滴加酚酞溶液,溶液先变红后褪色。某小组欲探究其原因,进行以下实验:①取反应后的溶液并加入二氧化锰后迅速产生大量气体,试管口带火星的木条复燃;②和③实验结束后溶液的红色均不褪去。下列分析错误的是( )A.过氧化钠与水反应产生的气体为O2B.过氧化钠与水反应需要MnO2做催化剂C.实验②和③证明使溶液褪色的不是氢氧化钠和氧气D.过氧化钠与水反应可能生成了具有漂白性的H2O2B1234解析 过氧化钠与水反应产生的气体为O2,A正确;过氧化钠与水反应不需要催化剂,过氧化氢分解需要MnO2做催化剂,B错误;实验②和③作为对照实验,能证明使溶液褪色的不是氢氧化钠和氧气,C正确;根据向反应后的溶液加入二氧化锰后迅速产生大量气体及该气体能使带火星的木条复燃可知,过氧化钠与水反应可能生成了具有漂白性的H2O2,D正确。
第1章 认识化学科学第2节 第1课时 研究物质性质的基本方法素 养 目 标1.通过对金属钠的性质探究等一系列科学探究活动,认识钠是一种非常活泼的金属单质,了解金属钠的物理性质、主要化学性质,形成科学探究与创新意识的化学核心素养。2.通过观察、分析实验现象,体会如何科学、合理地运用观察方法。在归纳金属钠的性质的过程中,体验分类、比较等方法在研究和学习物质性质过程中的重要应用,培养宏观辨识与微观探析的化学核心素养。3.激发学习化学的兴趣,同时树立安全意识和环保意识,形成科学态度与社会责任的化学核心素养。基础落实·必备知识全过关重难探究·能力素养全提升目 录 索 引 学以致用·随堂检测全达标基础落实·必备知识全过关一、研究物质性质的四种基本方法1.研究物质的性质,通常有 、实验、 、比较等方法。 2.观察法(1)定义:有计划、有目的地运用 考察研究对象的方法。 (2)方式:用肉眼看、用鼻子闻、借助仪器观察等。3.运用分类的方法,总结各类物质的 ,并根据物质所属的类别对物质及其变化进行 。 4.运用比较的方法,认识各种物质性质之间的 ,以及各种物质性质之间的内在 。 观察 分类 感官 一般性质 预测 异同 联系 二、利用观察法探究钠的物理性质及钠与水的反应1.钠的物理性质银白色 固体 质软 小 较低 2.钠与水的反应观察并记录结果,分析得出结论:小 低 放热 红 碱 2Na+2H2O══2NaOH+H2↑ 【微思考1】将绿豆粒大小的一块钠加入硫酸铜溶液中能生成铜单质吗? 【微思考2】可以用手直接拿取或接触钠块吗?为什么? 提示 不能。因为钠首先与水反应生成NaOH,NaOH与硫酸铜发生复分解反应生成蓝色的氢氧化铜沉淀和硫酸钠。提示 不能。手上含有少量水,钠与水反应放出的热会灼烧皮肤,且生成的NaOH会腐蚀皮肤。3.钠与氧气的反应实验探究银白色 变暗 银白色 小 低 4Na+O2══2Na2O 闪亮 黄 淡黄色 4.Na2O和Na2O2的比较(1)物理性质。氧化钠是一种 固体,过氧化钠是一种 固体。 (2)化学性质。Na2O、Na2O2与H2O反应的化学方程式分别为 ; 。 Na2O、Na2O2分别与CO2反应的化学方程式为Na2O+CO2══Na2CO3, 。 (3)用途。Na2O2可用于 和 中氧气的来源。 白色 淡黄色 Na2O+H2O══2NaOH 2Na2O2+2H2O══4NaOH+O2↑ 2Na2O2+2CO2══2Na2CO3+O2 呼吸面具 潜水艇 5.钠的保存及用途(1)保存。金属钠通常保存在煤油中或石蜡油中。(2)用途。【微思考3】从试剂瓶中取出的药品、试剂是否都不能放回原试剂瓶? 提示 一般的试剂在取出后不能放回原试剂瓶,但是取出后未用完的金属钠要放回原试剂瓶中,不能随便丢弃。提示 ①4Na+O2══2Na2O;②Na2O+H2O══2NaOH;③2NaOH+CO2+9H2O══Na2CO3·10H2O;④Na2CO3·10H2O══Na2CO3+10H2O。判断下列说法是否正确,正确的画“√”,错误的画“×”。1.通过观察物质的颜色、气味、状态可了解其物理性质,通过实验可了解其化学性质。( )2.金属钠着火可用水扑灭。( )3.Na2O2与Na2O固体中阳离子与阴离子的个数比均为2∶1。( )4.钠与CuSO4溶液反应可置换出铜。( )5.把钠投入稀硫酸中,钠先和水发生反应,再与H2SO4发生反应。( )√×√××6.Na与足量O2反应生成Na2O,随着温度的升高,生成Na2O的速率逐渐加快。( )7.Na2O2可使酚酞溶液变红。( )8.Na2O2在潮湿的空气中放置一段时间,变成白色黏稠物的原因是2Na2O2+2CO2══2Na2CO3+O2。( )×××重难探究·能力素养全提升探究1 钠与溶液的反应人们常说,水能灭火,水火不相容。有一个非常有趣的实验:将一小块金属钠放在酒精灯的灯芯处,用玻璃棒蘸取少许水点在灯芯上,酒精灯竟然被点燃了。(1)这一小块银白色的物质是金属钠,少许水点在上面的时候,发生了什么反应?提示 钠与水发生反应,生成氢氧化钠和氢气。 (2)该反应为什么能将酒精灯点燃? 提示 钠与水反应放出大量的热,使酒精灯被点燃。 (3)金属钠在储存的时候应注意什么问题? 提示 金属钠在储存的时候一定要密封保存,少量的金属钠应置于煤油或石蜡油中保存。钠与水反应的延伸应用 1.将绿豆粒大小的钠块放入如图所示的烧杯中,可能出现的现象是( )A.钠块只在煤油层中游动,并放出气体B.钠块只在水层中游动,钠块熔化,水层变红C.钠块在煤油和水两种液体界面处反应,熔化成小球并上下跳动,水层变红D.钠块在四氯化碳和水两种液体界面处反应,熔化成小球并上下跳动,水层变红C解析 由题图可知,三种液体的密度:四氯化碳>水>煤油,而钠的密度为0.97 g·cm-3,介于水和煤油的密度之间,故将绿豆粒大小的钠块投入烧杯中,钠块在煤油和水两种液体界面处反应,钠的下部与水接触并反应,产生H2推动钠向上游动,进入煤油层后,反应停止,由于钠受到的重力大于浮力,随后钠块下沉,又回落到煤油和水的界面上,重复上述过程,故钠块在水层与煤油层界面处游动并上下跳动,因钠与H2O反应生成NaOH,则滴有少量酚酞的水变红。2.[2023安徽淮北高一期中]按如图所示进行相应实验,下列有关它们反应现象的分析错误的是( )A.均有可燃性气体生成B.钠均浮在液面上反应,并四处游动C.丙中钠能置换出单质铜D.反应剧烈程度:乙>甲C解析 钠与水反应生成氢氧化钠和氢气,钠与盐酸反应生成氯化钠和氢气,钠与硫酸铜溶液反应生成硫酸钠、氢氧化铜、氢气,反应均有可燃性气体生成,A正确;钠的密度比水小,反应放出气体,所以钠均浮在液面上反应,并四处游动,B正确;钠放入硫酸铜溶液中,钠先和水反应生成氢氧化钠和氢气,氢氧化钠再和硫酸铜反应生成氢氧化铜沉淀和硫酸钠,丙中钠不能置换出单质铜,C错误;乙中氢离子浓度大于甲,故反应剧烈程度:乙>甲,D正确。探究2 Na2O2的性质水能灭火,但是水也可以用来生火。有一个非常神奇的滴水取火的实验:取一团脱脂棉,在里面放少许淡黄色的Na2O2粉末,小心地将两滴水滴进去,脱脂棉竟然燃烧起来了。(1)描述滴水后淡黄色粉末发生的反应并写出相应的化学方程式。 (2)结合物质燃烧需要的条件,分析发生上述实验现象的原因。 提示 过氧化钠与水反应生成氢氧化钠并放出氧气,2Na2O2+2H2O══4NaOH+O2↑。提示 Na2O2与水反应放热并产生O2,使脱脂棉的温度升高而被点燃。 1.Na2O2与Na2O性质的比较 2.Na2O2与CO2、H2O反应的规律(1)从质量的角度分析。2Na2O2+2H2O══4NaOH+O2↑①2Na2O2+2CO2══2Na2CO3+O2②对于反应①,反应后Na2O2固体增加的质量实际相当于水中H元素的质量,该过程可以认为是Na2O2 2NaOH+O;对于反应②,反应后Na2O2固体增加的质量实际上相当于CO2中碳元素和一半氧元素的质量,该过程可以认为是Na2O2 Na2CO3+O。进一步分析还可得出关系式Na2O2+H2══2NaOH,Na2O2+CO══Na2CO3。实际上这两个反应均不能发生,只是从质量的角度可看作Na2O2只吸收了H2和CO,Na2O2增加的质量等于H2和CO的质量。这样在分析H2和CO在氧气中燃烧的产物被Na2O2完全吸收后固体质量的变化时会变得很方便。凡分子组成符合(CO)m·(H2)n的物质,W g该物质在O2中完全燃烧后的产物(CO2和水蒸气)与足量的Na2O2固体反应后,固体增加的质量为W g。或是由C、H、O三种元素组成的物质,只要该物质中C、O原子个数比为1∶1,也可满足该变化。(2)先后顺序关系。当CO2、H2O(g)与足量的Na2O2同时接触时,由于Na2O2与H2O反应生成的NaOH能与CO2反应生成Na2CO3,所以可以视为Na2O2先与CO2反应,待CO2反应完全后,Na2O2再与H2O(g)反应。1.过氧化钠可在呼吸面具和潜水艇中作为供氧剂,实验室可用如下装置进行验证(A是实验室中制取CO2的装置,C中盛放的是过氧化钠)。下列说法不正确的是( )A.装置A中发生反应的离子方程式为CaCO3+2H+══Ca2++CO2↑+H2OB.装置B中盛放饱和NaHCO3溶液,目的是除去CO2中的HCl气体C.装置C中消耗7.8 g Na2O2时,反应生成1.6 g O2D.装置D是安全瓶,防止E中水倒流进入C中D解析 实验室利用CaCO3与稀盐酸反应制取CO2,该反应的离子方程式为CaCO3+2H+══Ca2++CO2↑+H2O,A正确;装置A中制得的CO2中混有挥发出的HCl,用饱和NaHCO3溶液可除去CO2中的HCl气体,B正确;根据反应2Na2O2+2CO2══2Na2CO3+O2可知,消耗156 g Na2O2时生成32 g O2,则消耗7.8 g Na2O2时反应生成1.6 g O2,C正确;装置E用于收集反应生成的O2,装置D中可盛放NaOH溶液,用于吸收C中未反应的CO2,D错误。【变式设问】根据装置F中收集O2的质量计算消耗Na2O2的质量,若缺少装置D,对计算结果有什么影响?为什么?提示 计算结果偏大;缺少装置D时,会有未反应的CO2进入装置F。 2.下列说法正确的是( )①在空气中加热金属钠产物呈淡黄色②过氧化钠能与酸反应生成盐和水,所以过氧化钠是一种碱③过氧化钠能与水反应,所以过氧化钠可以作为气体的干燥剂④过氧化钠中阴阳离子个数比为1∶1⑤钠可以从锆、铌等金属的卤化物的水溶液中置换出相应的金属单质⑥Na2O2分别与水及CO2反应产生相同量的O2时,需要水和CO2的质量相等⑦可用水来检验某Na2O粉末中是否含有Na2O2⑧将足量的Na2O2、Na2O分别加到含酚酞的溶液中,最终溶液均为红色A.①②⑤⑦ B.①⑦C.①②⑤⑧ D.①⑧B解析 在空气中加热金属钠时生成淡黄色的Na2O2,①正确;过氧化钠是一种氧化物,②错误;Na2O2与水反应生成O2,可能引入新杂质,③错误;Na2O2中含有Na+和 ,所以过氧化钠中阴阳离子个数比为1∶2,④错误;钠能够与水反应,故钠不能从锆、铌等金属的卤化物的水溶液中置换出金属单质,⑤错误;根据反应2Na2O2+2CO2══2Na2CO3+O2、2Na2O2+2H2O══4NaOH+O2↑可知,Na2O2分别与CO2和水反应产生相同量的O2时,需要CO2和水的质量不相等,⑥错误;Na2O与水反应生成NaOH, Na2O2与水反应生成NaOH和O2,故可用水来检验某Na2O粉末中是否含有Na2O2,⑦正确;将足量的Na2O2、Na2O分别加到含酚酞的溶液中,二者都生成NaOH,因为Na2O2具有漂白性而能使有色物质褪色,所以最终加Na2O的酚酞溶液为红色,而加Na2O2的酚酞溶液为无色,⑧错误。学以致用·随堂检测全达标12341.下列关于金属钠的叙述正确的是( )A.金属钠可以保存在煤油中B.金属钠着火时,可用水来灭火C.钠与硫酸铜溶液反应可置换出铜D.实验时用剩的钠块不能放回原试剂瓶A解析 金属钠的密度比煤油大且不与煤油反应,故钠可以保存在煤油中,A正确;金属钠着火时生成过氧化钠,用水灭火时,过氧化钠与水反应生成的氧气可以助燃,同时钠与水反应生成易燃、易爆的氢气,B不正确;将钠投入硫酸铜溶液后,钠先与水反应生成氢气和氢氧化钠,然后氢氧化钠与硫酸铜反应,不会置换出铜,C不正确;实验时用剩的钠块,应该放回原试剂瓶,D不正确。12342.[2023广东深圳实验学校高一阶段考]过氧化物常用作潜水器、航天器的供氧剂,下列有关Na2O和Na2O2两种钠的氧化物说法正确的是( )A.钠与氧气反应时的产物主要取决于氧气的用量及纯度B.等质量的两种氧化物中含有的离子总数相同C.6.2 g Na2O和7.8 g Na2O2分别溶于等量水中,所得溶液中溶质的质量分数不同D.Na2O是白色的固体,Na2O2是淡黄色的固体粉末D1234解析 钠与氧气反应时的产物主要取决于反应条件,常温下反应生成Na2O,加热反应生成Na2O2,A错误;Na2O和Na2O2均由2个钠离子和1个阴离子构成,等质量时,含有的离子总数不相同,B错误;6.2 g Na2O和7.8 g Na2O2溶于等量水中发生反应,所得溶质均为8.0 g NaOH,且溶液质量相等,则所得溶液中溶质的质量分数相等,C错误;Na2O是白色固体,Na2O2是淡黄色固体粉末,D正确。12343.已知用金属钠制取氧化钠的方法有许多,下列方法最好且解释合理的是( )C1234解析 钠与纯氧气反应生成氧化钠,虽然产物唯一,但无法确定反应是否完全,故不选A;钠与二氧化碳在加热条件下反应生成氧化钠和碳,氧化钠又能与二氧化碳反应生成碳酸钠,故不选B;C项中反应是工业制取氧化钠最常见的方法,产生的氮气和固体易分离,目标产物中无杂质,而且亚硝酸钠属于工业常用盐,价格低,它提供一部分的钠元素,从而减少较贵重的金属钠的用量,且生成的N2可保护Na2O不被进一步转化为Na2O2,故选C;钠放置在空气中不仅与氧气反应还与水蒸气反应,所以产物不纯,故不选D。12344.向过氧化钠与水反应后的溶液中滴加酚酞溶液,溶液先变红后褪色。某小组欲探究其原因,进行以下实验:①取反应后的溶液并加入二氧化锰后迅速产生大量气体,试管口带火星的木条复燃;②和③实验结束后溶液的红色均不褪去。下列分析错误的是( )A.过氧化钠与水反应产生的气体为O2B.过氧化钠与水反应需要MnO2做催化剂C.实验②和③证明使溶液褪色的不是氢氧化钠和氧气D.过氧化钠与水反应可能生成了具有漂白性的H2O2B1234解析 过氧化钠与水反应产生的气体为O2,A正确;过氧化钠与水反应不需要催化剂,过氧化氢分解需要MnO2做催化剂,B错误;实验②和③作为对照实验,能证明使溶液褪色的不是氢氧化钠和氧气,C正确;根据向反应后的溶液加入二氧化锰后迅速产生大量气体及该气体能使带火星的木条复燃可知,过氧化钠与水反应可能生成了具有漂白性的H2O2,D正确。
相关资料
更多









