
新高考化学一轮复习精品课件 第7章 第38讲 反应热 热化学方程式 (含解析)
展开考点一 反应热 焓变
考点二 热化学方程式 燃烧热、能源
真题演练 明确考向
1.反应热和焓变(1)反应热:在等温条件下,化学反应体系向环境释放或从环境 的热量。(2)焓变①焓(H):与内能有关的物理量。②焓变(ΔH):生成物的焓与反应物的焓之差。③焓变与反应热的关系等压条件下的反应热等于反应的焓变,常用 表示反应热,常用单位: 。
2.常见的吸热反应和放热反应
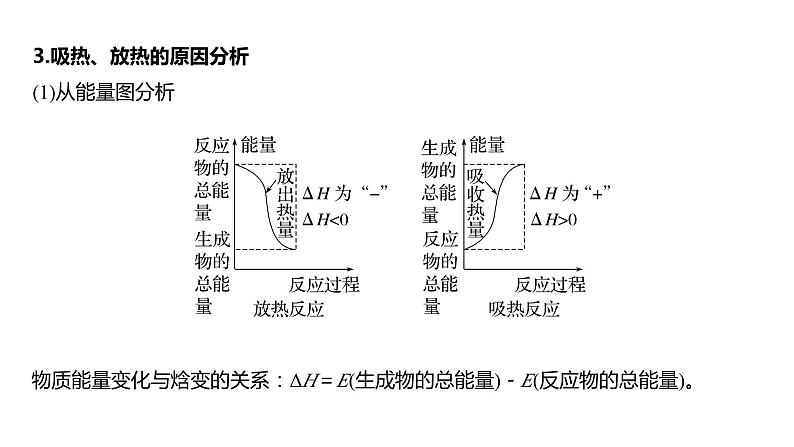
3.吸热、放热的原因分析(1)从能量图分析
物质能量变化与焓变的关系:ΔH=E(生成物的总能量)-E(反应物的总能量)。
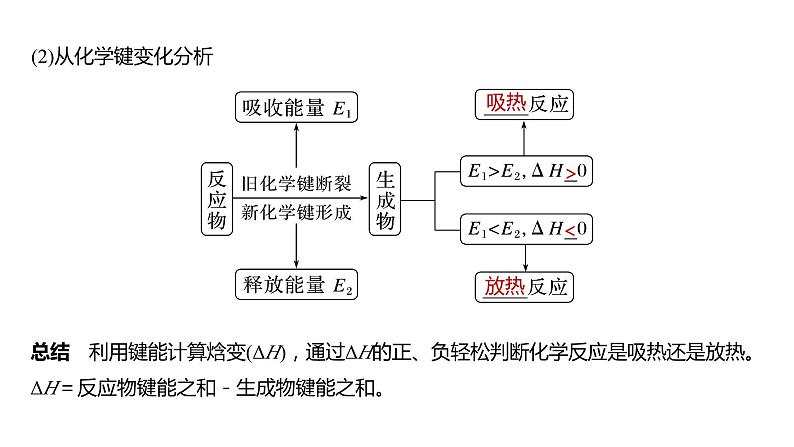
(2)从化学键变化分析
总结 利用键能计算焓变(ΔH),通过ΔH的正、负轻松判断化学反应是吸热还是放热。ΔH=反应物键能之和-生成物键能之和。
1.放热反应不需要加热就能发生,吸热反应不加热就不能发生( )2.可逆反应的ΔH表示完全反应时的热量变化,与反应是否可逆无关( )3.吸热反应中,反应物化学键断裂吸收的总能量高于生成物形成化学键放出的总能量( )4.活化能越大,表明化学反应吸收的能量越多( )
一、对反应过程能量图的理解1.科学家用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如图。
回答下列问题:(1)从状态Ⅰ到状态Ⅲ为 (填“吸热”或“放热”)反应。
(2)从状态Ⅰ到状态Ⅱ需要 (填“吸收”或“释放”)能量,CO分子 (填“是”或“否”)需要断键形成C和O。(3)从状态Ⅱ到状态Ⅲ形成的化学键是 。(4)将相同物质的量的CO转化为CO2,CO与O比CO与O2反应放出的热量 (填“多”或“少”),可能的原因是 。(5)由该反应过程可知,在化学反应中,旧化学键 (填“一定”或“不一定”)完全断裂,但一定有新化学键的 。
碳氧双键(或C==O)
CO与O2反应生成CO2需要先吸收能量断裂O2分子中的共价键
2.臭氧层中O3分解过程如图所示,回答下列问题。
(1)ΔH (填“>”或“<”)0。(2)催化反应①是 (填“吸热”或“放热”,下同)反应,催化反应②是 反应。(3)总反应的活化能是 ,催化反应①的活化能是 ,催化反应②对应的逆反应的活化能是 ,总反应对应的逆反应活化能为 。
3.铋基催化剂对CO2电化学还原制取HCOOH具有高效的选择性。其反应历程与能量变化如图所示,其中吸附在催化剂表面上的物种用*标注。
(1)使用Bi、Bi2O3两种催化剂,哪个更有利于CO2的吸附? 。简述判断依据: 。(2)CO2电化学还原制取HCOOH反应的ΔH (填“>”或“<”)0。(3)使用Bi催化剂时,最大能垒是 ,使用Bi2O3催化剂时,最大能垒是 。
由图可知,使用Bi2O3催化剂时,相对能量减小得多,趋于更稳定状态
二、根据键能计算焓变4.CH3—CH3(g)―→CH2==CH2(g)+H2(g) ΔH,有关化学键的键能如下表:
+125 kJ·ml-1
则该反应的反应热为 。
ΔH=E(C—C)+6E(C—H)-E(C==C)-4E(C—H)-E(H—H)=(347+6×414-615-4×414-435) kJ·ml-1=+125 kJ·ml-1。
5.已知几种化学键的键能数据如下表所示(亚硝酰氯的结构式为Cl—N==O):
则反应2NO(g)+Cl2(g) 2ClNO(g)的ΔH= kJ·ml-1(用含a的代数式表示)。
根据ΔH=反应物总键能-生成物总键能知,ΔH=2×630 kJ·ml-1+243 kJ·ml-1-2×(a kJ·ml-1+607 kJ·ml-1)=(289-2a) kJ·ml-1。
熟记常见1 ml下列物质中化学键的数目:
热化学方程式 燃烧热、能源
1.热化学方程式的概念和意义(1)概念:表明反应所释放或吸收的热量的化学方程式。(2)意义:既表明了化学反应中的 变化,也表明了化学反应中的 变化。如2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·ml-1表示在25 ℃、101 kPa条件下, 。
2 ml H2(g)与1 ml O2(g)反应生成2 ml液态水时放出的热量为571.6 kJ
2.书写热化学方程式的注意事项(1)热化学方程式中必须标明反应物和生成物的 ,固体( )、液体( )、气体( )、水溶液( ),若为同素异形体,还要注明名称。(2)热化学方程式要注明反应时的温度和压强。如不注明,即表示在25 ℃和101 kPa下测定。(3)热化学方程式中的化学计量数为 。故化学计量数可以是 ,也可以是 。当化学计量数改变时,其ΔH也 的改变。(4)要注明ΔH的符号:“+”代表 、“-”代表 ,以及单位: 。
3.燃烧热(1)燃烧热的概念及意义
(2)对完全燃烧的理解
概念:在101 kPa时, ml纯物质 生成指定产物时所放出的热量意义:衡量燃料燃烧时放出热量的多少
4.燃料的选择 能源(1)燃料的选择原则
1.开发利用各种新能源,减少对化石燃料的依赖,可以降低空气中PM2.5的含量( )2.CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ( )3.根据2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·ml-1可知,氢气的燃烧热为571.6 kJ·ml-1( )
一、能源 燃烧热概念的理解1.据某网报道,欧洲一集团公司拟在太空建立巨大的集光装置,把太阳光变成激光用于分解海水制氢,其反应可表示为2H2O 2H2↑+O2↑。有下列几种说法:①水分解反应是放热反应;②若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可改善生存条件;③使用氢气作燃料有助于控制温室效应;④氢气是一级能源。其中叙述正确的是A.①② B.③④C.②③ D.①②③④
①水分解反应是吸热反应;②若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可以减少二氧化碳的量,同时得到新能源甲醇,可改善生存条件;③氢气燃烧只生成水,不生成CO2,有助于控制温室效应;④氢气是二级能源。
2.油酸甘油酯(相对分子质量为884)在体内代谢时可发生如下反应:C57H104O6(s)+80O2(g)===57CO2(g)+52H2O(l)已知燃烧1 kg该化合物释放出3.8×104 kJ热量,油酸甘油酯的燃烧热为A.3.8×104 kJ·ml-1B.-3.8×104 kJ·ml-1C.3.4×104 kJ·ml-1D.-3.4×104 kJ·ml-1
二、热化学方程式的书写3.依据事实,写出下列反应的热化学方程式。(1)已知2.0 g燃料肼(N2H4)气体完全燃烧生成N2和水蒸气时,放出33.4 kJ的热量,则表示肼燃烧的热化学方程式为 。(2)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25 ℃、101 kPa下,已知该反应每消耗1 ml CuCl(s)放热44.4 kJ,该反应的热化学方程式是_______________________________________________________________。
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534.4 kJ·ml-1
4CuCl(s)+O2(g)===
2CuCl2(s)+2CuO(s) ΔH=-177.6 kJ·ml-1
4.分析图像书写热化学方程式。
(1)图甲表示的是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: 。
NO2(g)+CO(g)===NO(g)+CO2(g) ΔH=-234 kJ·ml-1
根据图甲可知,此反应是放热反应,热化学方程式为NO2(g)+CO(g)===CO2(g)+NO(g) ΔH=(134-368) kJ·ml-1=-234 kJ·ml-1。
(2)图乙表示氧族元素中的氧、硫、硒、碲在生成1 ml气态氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表哪种元素,试写出硒化氢在热力学标准状态下,发生分解反应的热化学方程式: 。
H2Se(g)===Se(s)+H2(g) ΔH=-81 kJ·ml-1
同主族元素从上到下非金属性逐渐减弱,其气态氢化物的稳定性逐渐降低,能量逐渐增大,则可确定a、b、c、d分别代表碲、硒、硫、氧元素。b代表硒元素,生成1 ml H2Se(g)的ΔH=+81 kJ·ml-1,则其分解反应的热化学方程式为H2Se(g)===Se(s)+H2(g) ΔH=-81 kJ·ml-1。
(3)图丙表示一定条件下,在水溶液中1 ml Cl-、 (x=1,2,3,4)的能量相对大小,①D是 (填离子符号)。②反应B―→A+C的热化学方程式为_______________________________________________________________(用离子符号表示)。
ΔH=-117 kJ·ml-1
1.(2020·天津,10)理论研究表明,在101 kPa和298 K下,HCN(g) HNC(g)异构化反应过程的能量变化如图所示。下列说法错误的是A.HCN比HNC稳定B.该异构化反应的ΔH=+59.3 kJ·ml-1C.正反应的活化能大于逆反应的活化能D.使用催化剂,可以改变反应的反应热
A对,能量越低越稳定;B对,根据题图可知反应为吸热反应,ΔH=+59.3 kJ·ml-1;C对,正反应的活化能为186.5 kJ·ml-1,逆反应的活化能为186.5 kJ·ml-1-59.3 kJ·ml-1=127.2 kJ·ml-1;D错,催化剂只能改变反应速率,不影响反应热。
2.(2022·浙江6月选考,18)标准状态下,下列物质气态时的相对能量如下表:
可根据HO(g)+HO(g)===H2O2(g)计算出H2O2中氧氧单键的键能为214 kJ·ml-1。下列说法不正确的是A.H2的键能为436 kJ·ml-1B.O2的键能大于H2O2中氧氧单键的键能的两倍C.解离氧氧单键所需能量:HOO
由表格中的数据可知HOO===HO+O,解离其中氧氧单键需要的能量为249 kJ·ml-1+39 kJ·ml-1-10 kJ·ml-1=278 kJ·ml-1,H2O2中氧氧单键的键能为214 kJ·ml-1,C错误;由表中的数据可知H2O(g)+O(g)===H2O2(g)的ΔH=-136 kJ·ml-1-(-242 kJ·ml-1)-249 kJ·ml-1=-143 kJ·ml-1,D正确。
3.[2020·全国卷Ⅱ,28(1)①]乙烷在一定条件可发生如下反应:C2H6(g)===C2H4(g)+H2(g) ΔH1,相关物质的燃烧热数据如下表所示:
先写出三种气体的燃烧热的热化学方程式,然后根据盖斯定律,ΔH1=-1 560 kJ·ml-1-(-1 411 kJ·ml-1)-(-286 kJ·ml-1)=+137 kJ·ml-1。
则ΔH1= kJ·ml-1。
4.按要求书写热化学方程式。(1)[2022·河北,16(1)]298 K时,1 g H2燃烧生成H2O(g)放热121 kJ,1 ml H2O(l)蒸发吸热44 kJ,表示H2燃烧热的热化学方程式为 。
(2)[2021·海南,16(1)]已知25 ℃,100 kPa时:1 ml葡萄糖[C6H12O6(s)]完全燃烧生成CO2(g)和H2O(l),放出2 804 kJ热量。则25 ℃时,CO2(g)与H2O(l)经光合作用生成葡萄糖[C6H12O6(s)]和O2(g)的热化学方程式为__________________________________________________________。
6CO2(g)+6H2O(l)===C6H12O6(s)+6O2(g)
ΔH=+2 804 kJ·ml-1
(3)[2021·天津,13(3)]合成氨反应常使用铁触媒提高反应速率。如图为有、无铁触媒时,反应的能量变化示意图。写出该反应的热化学方程式:__________________________________________。从能量角度分析,铁触媒的作用是___________________。
ΔH=-(a-b) kJ·ml-1
1.(2022·济南高三月考)下列说法正确的是A.焓的大小受体系的温度、压强等因素的影响B.化学反应的反应热等于反应前后焓的变化C.浓硫酸溶于水是放热反应D.煤的液化有利于实现碳达峰、碳中和
等压条件下,化学反应的反应热等于反应的焓变,B错误;浓硫酸溶于水是物理变化,C错误;煤的液化能提高煤的能量利用率,但CO2气体的排放量不变,D错误。
2.“太阳能燃料”国际会议于2019年10月在我国武汉举行,旨在交流和探讨太阳能光催化分解水制氢、太阳能光催化二氧化碳转化为燃料等问题。下列说法错误的是A.太阳能燃料属于一次能源B.直接电催化CO2制取燃料时,燃料是阴极产物C.光催化分解水产生的H2是理想的绿色能源D.研发和利用太阳能燃料,有利于经济的可持续发展
太阳能燃料属于二次能源,故A错误;直接电催化CO2制取燃料时,C元素化合价降低,在阴极反应,故B正确;光催化分解水产生H2,H2燃烧放出的热量多,产物为H2O,无污染,故C正确;太阳能燃料可重复利用,避免对环境造成污染,故D正确。
3.已知化学反应A2(g)+B2(g)===2AB(g) ΔH=+100 kJ·ml-1的能量变化如图所示,判断下列叙述正确的是A.加入催化剂,该反应的反应热ΔH变小B.每形成2 ml A—B,吸收b kJ能量C.每生成2分子AB吸收(a-b) kJ热量D.该反应正反应的活化能大于100 kJ·ml-1
催化剂不影响反应热的大小,A错误;形成化学键,释放能量,B错误;每生成2 ml AB(g)吸收(a-b)kJ热量,C错误。
4.已知:①2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·ml-1;②H2(g)+S(g)===H2S(g) ΔH=-20.1 kJ·ml-1,下列判断正确的是A.若反应②中改用固态硫,则消耗1 ml S(s)反应放出的热量小于20.1 kJB.从焓变数值知,单质硫与氧气相比,更容易与氢气化合C.由反应①②知,水的热稳定性弱于硫化氢D.氢气的燃烧热ΔH=-241.8 kJ·ml-1
固体变为气体,吸收热量,A项正确;由热化学方程式可知,1 ml氢气与氧气反应放出的热量比1 ml氢气与硫反应放出的热量多221.7 kJ,说明氧气与单质硫相比更容易与氢气化合,B项错误;由反应①②无法直接比较水和硫化氢的热稳定性,C项错误;反应①生成的是气态水而不是液态水,D项错误。
5.(2022·北京模拟)丙烷与溴原子能发生以下两种反应:①CH3CH2CH3(g)+Br·(g)―→CH3CH2CH2·(g)+HBr(g)
反应过程的能量变化如图所示。下列说法不正确的是A.反应①与②均为吸热反应B.反应②使用了催化剂
催化剂能改变反应途径,降低反应的活化能,加快化学反应速率。反应②的活化能低,反应速率快,但反应①与②同时发生,不能确定反应②是否使用催化剂,B说法错误。
6.(2021·浙江1月选考,20)已知共价键的键能与热化学方程式信息如下表:
则2O(g)===O2(g)的ΔH为A.428 kJ·ml-1 B.-428 kJ·ml-1C.498 kJ·ml-1 D.-498 kJ·ml-1
设O==O的键能为x,则(2×436 kJ·ml-1+x)-2×2×463 kJ·ml-1=-482 kJ·ml-1,x=498 kJ·ml-1,所以2O(g)===O2(g)的ΔH=-498 kJ·ml-1,D正确。
7.(2022·济南模拟)C2H6在Ni的活化下可放出CH4,其反应历程如图所示:下列关于活化历程的说法正确的是A.该转化过程ΔH>0B.在此反应过程中Ni的成键数目未发 生变化C.该反应过程中,最大能垒(活化能) 为204.32 kJ·ml-1D.整个过程中,Ni是该反应的催化剂
据反应物和生成物所具有的能量可以判断出,该反应为放热反应,故A错误;根据图示,过渡态1中Ni的成键数目为2,过渡态2中Ni的成键数目为3,反应过程中Ni的成键数目发生了变化,故B错误;根据图示,中间体2到过渡态2的能垒(活化能)最大,为204.32 kJ·ml-1,故C正确;根据图示,Ni是反应物不是催化剂,故D错误。
8.(2022·重庆育才中学模拟)甲烷分子结构具有高度对称性,且断开1 ml C—H需要吸收440 kJ能量。无催化剂作用下,甲烷在温度达到1 200 ℃以上才可裂解。在催化剂及一定条件下,CH4可在较低温度下发生裂解反应,甲烷在镍基催化剂上转化过程中的能量变化如图所示。下列说法正确的是A.1 ml甲烷催化裂解成C和H2的ΔH= +1 760 kJ·ml-1B.步骤②③反应均为吸热反应C.催化剂使用一段时间后失活的原因可 能是碳在催化剂表面沉积D.使用该催化剂,反应的焓变减小
CH4存在4个C—H,断开4 ml C—H需要吸收的能量为440 kJ×4=1 760 kJ,但不是甲烷催化裂解成C和H2需要吸收的能量,A错误;由题中图示可知,步骤②③反应物总能量都大于生成物总能量,B错误;
由题中图示可知,C可吸附在催化剂的表面,则催化剂使用一段时间后失活的原因可能是碳在催化剂表面沉积,C正确;加入催化剂,反应的路径改变,但反应的焓变不变,D错误。
9.燃料的热值是指单位质量某种燃料完全燃烧放出的热量,其常用单位为kJ·kg-1。已知下列物质的燃烧热(25 ℃、101 kPa):
据上表数据回答下列问题:(1)试写出表示辛烷燃烧热的热化学方程式:___________________________________________________________。
ΔH=-5 518 kJ·ml-1
(2)CH4的热值约为 (保留3位有效数字)。
5.56×104 kJ·kg-1
(3)上表所列燃料的热值最大的是 (填化学式)。
所述反应未完全燃烧,生成的氢气燃烧还要放出热量,则a<726.5。
当有1 ml Cl2参与反应时释放出145.0 kJ热量,该反应的热化学方程式:2Cl2(g)+2H2O(g)+C(s)===4HCl(g)+CO2(g) ΔH=-145.0 kJ·ml-1×2=-290.0 kJ·ml-1。
(2)将Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 ml Cl2参与反应时释放出145.0 kJ热量,写出该反应的热化学方程式:_______________________________________________________________。
2Cl2(g)+2H2O(g)+C(s)===4HCl(g)+
CO2(g) ΔH=-290.0 kJ·ml-1
(3)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料:4Al(s)+3TiO2(s)+3C(s)===2Al2O3(s)+3TiC(s) ΔH=-1 176.0 kJ·ml-1,则反应过程中,每转移1 ml电子放出的热量为 。
(4)CO2与H2在某催化剂的作用下反应如图所示:
写出该反应的热化学方程式: 。
CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH=-46 kJ·ml-1
由反应图示可知图形与化学键对应关系为
ΔH=反应物总键能-生成物总键能=2×803 kJ·ml-1+3×436 kJ·ml-1-3×414 kJ·ml-1-326 kJ·ml-1-3×464 kJ·ml-1=-46 kJ·ml-1。
(5)CO2催化加氢制CH3OH的一种反应历程如图所示(吸附在催化剂表面的物质用*标注,如 表示CO2吸附在催化剂表面)。
该反应历程中决速步反应的化学方程式为_____________________________________________________________________________________________________。
CO2(g)+2H*+2H2(g)===COOH*+H*+2H2(g)[或CO2(g)+2H*===COOH*+H*或CO2(g)+H*===COOH*]
新高考化学一轮复习精品课件 第7章 第39讲 反应热的测定与计算 (含解析): 这是一份新高考化学一轮复习精品课件 第7章 第39讲 反应热的测定与计算 (含解析),共60页。PPT课件主要包含了中和反应反应热的测定,必备知识,关键能力,盖斯定律及其应用,反应热大小的比较,真题演练明确考向,课时精练等内容,欢迎下载使用。
新高考化学一轮复习精品课件 第1章 第2讲 离子反应 离子方程式 (含解析): 这是一份新高考化学一轮复习精品课件 第1章 第2讲 离子反应 离子方程式 (含解析),共60页。PPT课件主要包含了电解质及电离,必备知识,应用举例,关键能力,真题演练明确考向,课时精练等内容,欢迎下载使用。
第37讲 反应热 热化学方程式-2024年高考化学一轮复习高频考点精讲(新教材新高考)课件PPT: 这是一份第37讲 反应热 热化学方程式-2024年高考化学一轮复习高频考点精讲(新教材新高考)课件PPT,共48页。PPT课件主要包含了复习目标,反应热焓变,考点一,必备知识,易错辨析,专项突破,考点二,真题演练等内容,欢迎下载使用。