




所属成套资源:新高考化学一轮复习精品课件 (含解析)
新高考化学一轮复习精品课件 第9章 第51讲 弱电解质的电离平衡 (含解析)
展开
这是一份新高考化学一轮复习精品课件 第9章 第51讲 弱电解质的电离平衡 (含解析),共60页。PPT课件主要包含了电离平衡常数及应用,真题演练明确考向,课时精练等内容,欢迎下载使用。
考点一 弱电解质的电离平衡及影响因素
考点二 电离平衡常数及应用
真题演练 明确考向
弱电解质的电离平衡及影响因素
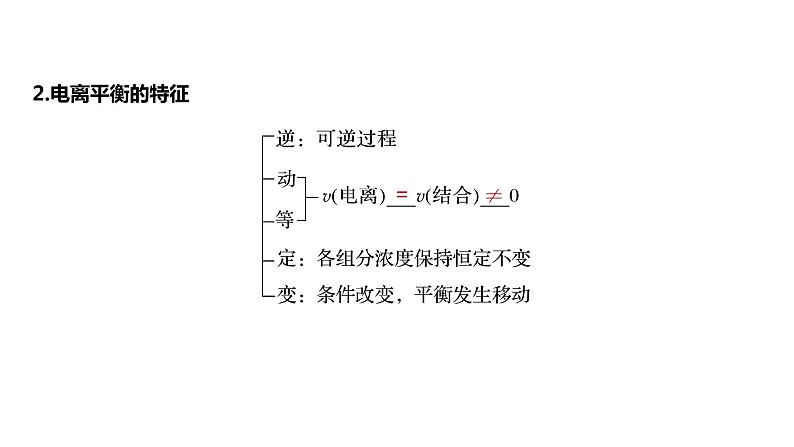
1.电离平衡的建立在一定条件下(如温度、压强等),当弱电解质电离产生离子的速率和离子结合成分子的速率相等时,电离过程达到了平衡。平衡建立过程如图所示:
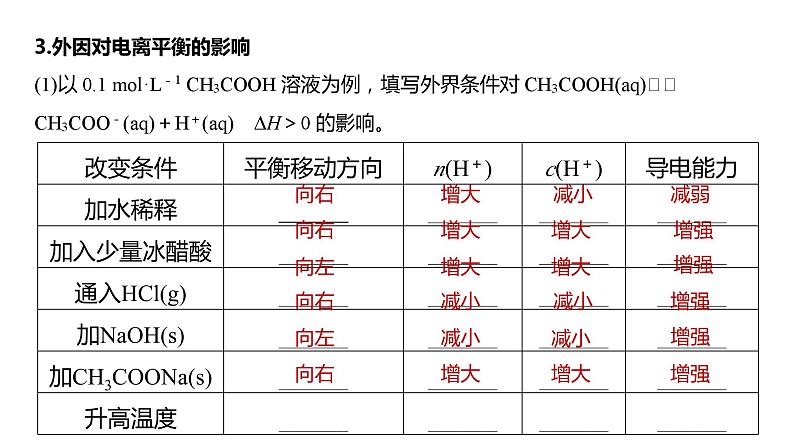
3.外因对电离平衡的影响
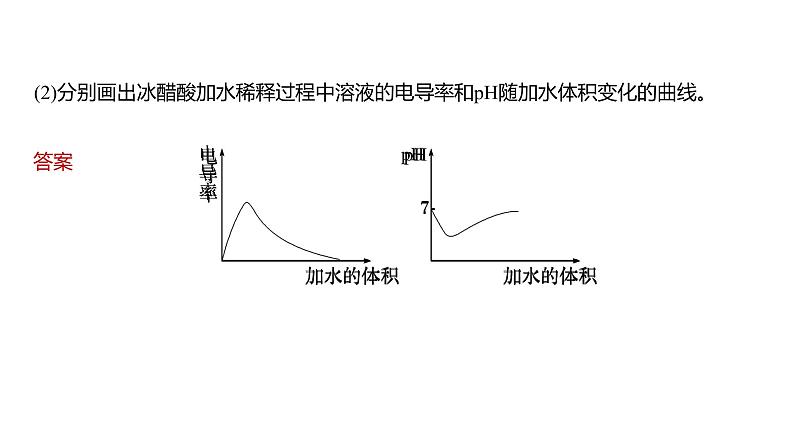
(2)分别画出冰醋酸加水稀释过程中溶液的电导率和pH随加水体积变化的曲线。
1.弱电解质溶液中至少存在两种共价化合物分子( )2.氨气溶于水,当NH3·H2O电离出的c(OH-)=c( )时,表明NH3·H2O电离处于平衡状态( )3.一元弱碱BOH的电离方程式为BOH===B++OH- ( )
1.能证明蚁酸(HCOOH)是弱酸的实验事实是A.HCOOH溶液与Zn反应放出H2B.0.1 ml·L-1 HCOOH溶液可使紫色石蕊溶液变红C.HCOOH溶液与Na2CO3反应生成CO2D.常温时0.1 ml·L-1 HCOOH溶液的pH=2.3
A、B项,只能证明蚁酸具有酸性,不能证明其酸性强弱,错误;C项,只能证明蚁酸的酸性比碳酸强,错误;D项,溶液的pH=2.3,说明HCOOH未完全电离,正确。
A.加水,平衡向右移动,溶液中氢离子浓度增大B.通入过量SO2气体,平衡向左移动,溶液pH增大C.滴加新制氯水,平衡向左移动,溶液pH减小D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
加水促进电离,但氢离子浓度减小,A项错误;通入过量SO2气体发生反应:2H2S+SO2===3S↓+2H2O,当SO2过量时溶液显酸性,而且酸性比H2S强,pH减小,B项错误;滴加新制氯水,发生反应:Cl2+H2S===2HCl+S↓,平衡向左移动,溶液pH减小,C项正确;加入少量硫酸铜固体,发生反应:H2S+Cu2+===CuS↓+2H+,H+浓度增大,D项错误。
3.常温下,①100 mL 0.01 ml·L-1的CH3COOH溶液,②10 mL 0.1 ml·L-1的CH3COOH溶液。用“>”“=”或“<”填写下列问题。(1)c(CH3COO-):①_____②。(2)电离程度:①_____②。(3)在上述两种溶液中加入足量锌片。开始时的反应速率:①_____②,反应结束生成相同状况下H2的体积:①_____②。(4)与同浓度的NaOH溶液完全反应消耗NaOH溶液的体积:①____②。
1.概念在一定条件下,弱电解质达到电离平衡时,溶液中电离所生成的各种离子浓度(幂次方)的乘积与溶液中未电离的分子浓度的比值是一个常数,这个常数叫做电离平衡常数,简称电离常数,用K(弱酸用Ka,弱碱用Kb)表示。
3.特点(1)电离平衡常数与温度有关,与浓度无关,升高温度,K增大。(2)电离平衡常数反映弱电解质的相对强弱,K越大,表示弱电解质越易电离,酸性或碱性越强。(3)多元弱酸的各步电离常数的大小关系是Ka1>Ka2>Ka3……,当Ka1≫Ka2时,计算多元弱酸中的c(H+)或比较多元弱酸酸性的相对强弱时,通常只考虑第一步电离。
4.电离度(1)概念在一定条件下的弱电解质达到电离平衡时,已经电离的电解质分子数占原电解质分子总数的百分比。(2)表示方法
(3)影响因素①相同温度下,同一弱电解质,浓度越大,其电离度(α)越____。②相同浓度下,同一弱电解质,温度越高,其电离度(α)越_____。
1.同一弱电解质,浓度不同其电离常数一定不同( )2.弱电解质的电离平衡右移,电离常数一定增大( )3.某一弱电解质,电离度越大,电离常数就越大( )4.常温下,依据Ka1(H2CO3)>Ka2(H3PO3),可知碳酸的酸性比磷酸强( )
一、利用电离常数判断弱电解质(酸碱性)的相对强弱1.部分弱酸的电离平衡常数如下表:
按要求回答下列问题:(1)HCOOH、H2S、H2CO3、HClO的酸性由强到弱的顺序为______________________________。
HCOOH>H2CO3>H2S
(3)运用上述电离常数及物质的特性判断下列化学方程式不正确的是________(填序号)。
二、判断微粒浓度比值的大小2.常温下,将0.1 ml·L-1的CH3COOH溶液加水稀释,请填写下列表达式中的数据变化情况(填“变大”“变小”或“不变”)。
判断溶液中微粒浓度比值的三种方法
(1)将浓度之比转化为物质的量之比进行比较,这样分析起来可以忽略溶液体积的变化,只需分析微粒数目的变化即可。(2)“假设法”,如上述问题(3),假设无限稀释,c(CH3COO-)趋近于0,c(H+)趋于10-7ml·L-1,故比值变小。(3)“凑常数”,解题时将某些粒子的浓度比值乘以或除以某种粒子的浓度,转化为一个常数与某种粒子浓度的乘积或相除的关系。
1.(2020·北京,11)室温下,对于1 L 0.1 ml·L-1醋酸溶液。下列判断正确的是A.该溶液中CH3COO-的粒子数为6.02×1022B.加入少量CH3COONa固体后,溶液的pH降低C.滴加NaOH溶液过程中,n(CH3COO-)与n(CH3COOH)之和始终为0.1 ml
醋酸属于弱电解质,则0.1 ml醋酸中CH3COO-的粒子数小于6.02×1022,A错误;加入少量CH3COONa固体,抑制醋酸的电离,溶液的pH升高,故B错误;根据元素质量守恒,n(CH3COO-)+n(CH3COOH)=0.1 ml,故C正确;醋酸的酸性强于碳酸,则根据强酸制取弱酸,醋酸与Na2CO3溶液反应生成醋酸钠、二氧化碳和水,醋酸是弱电解质,离子反应中不能拆写,故D错误。
2.(2022·全国乙卷,13)常温下,一元酸HA的Ka(HA)=1.0×10-3。在某体系中,H+与A-不能穿过隔膜,未电离的HA可自由穿过该膜(如图所示)。设溶液中c总(HA)=c(HA)+c(A-),当达到平衡时,下列叙述正确的是A.溶液Ⅰ中c(H+)=c(OH-)+c(A-)
C.溶液Ⅰ和Ⅱ中的c(HA)不相等D.溶液Ⅰ和Ⅱ中的c总(HA)之比为10-4
常温下,溶液Ⅰ的pH=7.0,则溶液Ⅰ中c(H+)=c(OH-)=1×10-7 ml·L-1,c(H+)<c(OH-)+c(A-),A错误;
根据题意,未电离的HA可自由穿过隔膜,故溶液Ⅰ和Ⅱ中的c(HA)相等,C错误;
1024·Ka1·Ka2
1.下列说法正确的有①不溶于水的盐都是弱电解质 ②可溶于水的盐都是强电解质 ③0.5 ml·L-1一元酸溶液中H+浓度一定为0.5 ml·L-1 ④强酸溶液中的c(H+)不一定大于弱酸溶液中的c(H+) ⑤电解质溶液导电的原因是溶液中有自由移动的阴、阳离子 ⑥熔融的电解质都能导电A.1个 B.2个 C.3个 D.4个
①溶解性与电解质强弱无关,错误;②醋酸铅是弱电解质,可溶于水,可溶于水的盐不一定都是强电解质,错误;③0.5 ml·L-1一元弱酸溶液中H+浓度小于0.5 ml·L-1,错误;⑥HCl是电解质,熔融HCl不导电,熔融的电解质不一定能导电,错误。
C.相同条件下,浓度均为0.1 ml·L-1的NaOH溶液和氨水,氨水的导电能力弱D.0.1 ml·L-1的氨水能使无色酚酞溶液变红
2.室温下,下列事实不能说明NH3·H2O为弱电解质的是A.0.1 ml·L-1的氨水中c(OH-)









