





2024届高考化学一轮复习 第三章 金属及其化合物 第5讲 无机化学工艺流程解题策略课件PPT
展开
这是一份2024届高考化学一轮复习 第三章 金属及其化合物 第5讲 无机化学工艺流程解题策略课件PPT,共60页。PPT课件主要包含了试题呈现形式,准确识图析图,常见考查角度,常用的提纯方法等内容,欢迎下载使用。
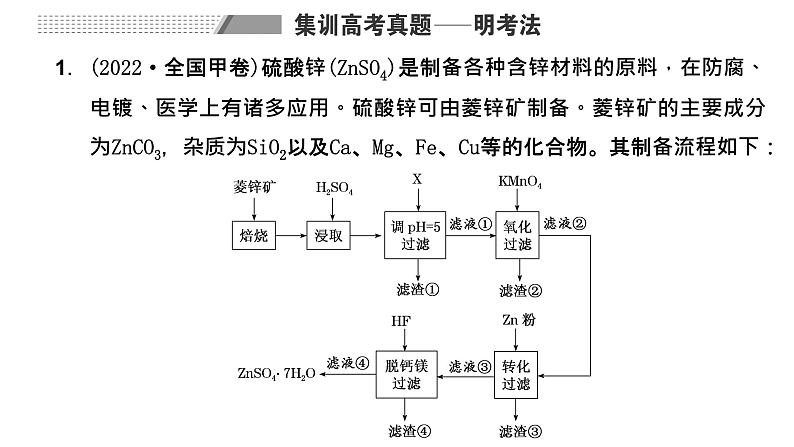
1.(2022·全国甲卷)硫酸锌(ZnSO4)是制备各种含锌材料的原料,在防腐、电镀、医学上有诸多应用。硫酸锌可由菱锌矿制备。菱锌矿的主要成分为ZnCO3,杂质为SiO2以及Ca、Mg、Fe、Cu等的化合物。其制备流程如下:
本题中所涉及离子的氢氧化物溶度积常数如下表:
(3)加入物质X调溶液pH=5,最适宜使用的X是________(填标号)。A.NH3·H2O B.Ca(OH)2 C.NaOH滤渣①的主要成分是__________、__________、__________。(4)向80~90 ℃的滤液①中分批加入适量KMnO4溶液充分反应后过滤,滤渣②中有MnO2,该步反应的离子方程式为___________________________________________________________________________________________。(5)滤液②中加入锌粉的目的是______________________________________________________________________________________________。(6)滤渣④与浓H2SO4反应可以释放HF并循环利用,同时得到的副产物是__________、__________。
(3)NH3·H2O易分解产生NH3污染空气,且经济成本较高,故A不适宜;Ca(OH)2不会引入新的杂质,且成本较低,故B适宜;NaOH会引入杂质Na+,且成本较高,C不适宜;当沉淀完全时(离子浓度小于10-5ml·L-1),结合表格Ksp计算各离子完全沉淀时pH<5的只有Fe3+,故滤渣①中有Fe(OH)3,又CaSO4是微溶物,SiO2不溶于酸,故滤渣①的主要成分是Fe(OH)3、CaSO4、SiO2;(4)向80~90 ℃滤液①中加入KMnO4溶液,可氧化Fe2+,得到Fe(OH)3和MnO2的滤渣②,反应的离子方程式为3Fe2++MnO+7H2O===3Fe(OH)3↓+MnO2↓+5H+;
(5)滤液②中加入锌粉,发生反应Zn+Cu2+===Zn2++Cu,故加入锌粉的目的为除去Cu2+;(6)由分析,滤渣④为CaF2、MgF2,与浓硫酸反应可得到HF,同时得到的副产物为CaSO4、MgSO4。
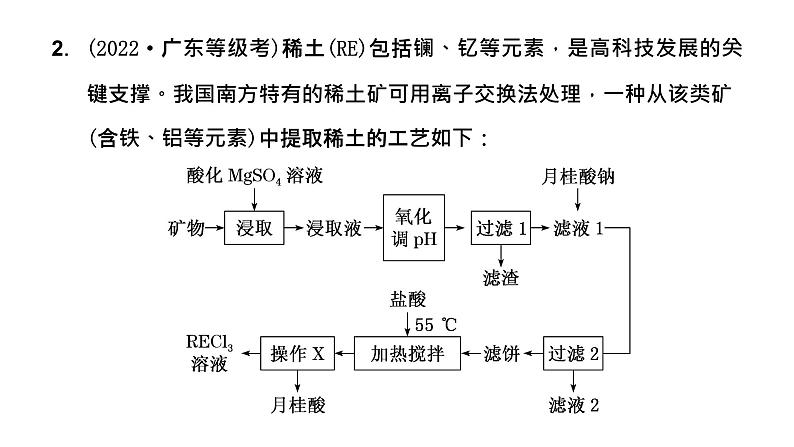
2.(2022·广东等级考)稀土(RE)包括镧、钇等元素,是高科技发展的关键支撑。我国南方特有的稀土矿可用离子交换法处理,一种从该类矿(含铁、铝等元素)中提取稀土的工艺如下:
已知:月桂酸(C11H23COOH)熔点为44 ℃;月桂酸和(C11H23COO)3RE均难溶于水。该工艺条件下,稀土离子保持+3价不变;(C11H23COO)2Mg的Ksp=1.8×10-8,Al(OH)3开始溶解时的pH为8.8;有关金属离子沉淀的相关pH见下表。
(1)“氧化调pH”中,化合价有变化的金属离子是________。(2)“过滤1”前,用NaOH溶液调pH至________的范围内,该过程中Al3+发生反应的离子方程式为__________________________________________。(3)“过滤2”后,滤饼中检测不到Mg元素,滤液2中Mg2+浓度为2.7 g·L-1。为尽可能多地提取RE3+,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中c(C11H23COO-)低于______ ml·L-1(保留两位有效数字)。(4)①“加热搅拌”有利于加快RE3+溶出、提高产率,其原因是______________________________________________________________。②“操作X”的过程为:先________,再固液分离。
(5)该工艺中,可再生循环利用的物质有________(写化学式)。(6)稀土元素钇(Y)可用于制备高活性的合金类催化剂Pt3Y。①还原YCl3和PtCl4熔融盐制备Pt3Y时,生成1 ml Pt3Y转移________ ml电子。②Pt3Y/C用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化O2的还原,发生的电极反应为__________________________________________。
(4)①“加热搅拌”有利于加快RE3+溶出、提高产率,其原因是加热搅拌可加快反应速率;② “操作X”的结果是分离出月桂酸,由信息可知,月桂酸(C11H23COOH)熔点为44 ℃,故“操作X”的过程为:先冷却结晶,再固液分离;(5)由分析可知,该工艺中,可再生循环利用的物质有MgSO4;(6)①YCl3中Y为+3价,PtCl4中Pt为+4价,而Pt3Y中金属均为0价,所以还原YCl3和PtCl4熔融盐制备Pt3Y时,生成1 ml Pt3Y转移15 ml电子;②碱性溶液中,氢氧燃料电池正极发生还原反应,发生的电极反应为O2+4e-+2H2O===4OH-。
答案:(1)Fe2+(2)4.7≤pH(H)>Bi>Cu;③相关金属离子形成氢氧化物的pH范围如下:
回答下列问题:(1)为提高焙烧效率,可采取的措施为__________。a.进一步粉碎矿石b.鼓入适当过量的空气c.降低焙烧温度(2)Bi2S3在空气中单独焙烧生成Bi2O3,反应的化学方程式为______________________________________________________。
(3)“酸浸”中过量浓盐酸的作用为:①充分浸出Bi3+和Mn2+;②______________。(4)滤渣的主要成分为__________(填化学式)。(5)生成气体A的离子方程式为_________________________________。(6)加入金属Bi的目的是________________。[解析] 联合焙烧:由已知信息①和第(2)问题干可知,发生转化:Bi2S3―→Bi2O3+SO2、FeS2―→Fe2O3+SO2、MnO2―→Mn2O3+MnSO4,故联合焙烧后得到Bi2O3、Fe2O3、Mn2O3、MnSO4和SiO2;水浸:MnSO4进入滤液,滤渣为Bi2O3、Fe2O3、Mn2O3和SiO2;
酸浸:加入过量浓盐酸后,Bi2O3和Fe2O3发生转化:Bi2O3―→Bi3+、Fe2O3―→Fe3+,因Mn2O3有氧化性,会与浓盐酸发生氧化还原反应:Mn2O3+6H++2Cl-===2Mn2++Cl2↑+3H2O,气体A为Cl2,滤渣主要为不溶于浓盐酸的SiO2,滤液中金属离子为Bi3+、Fe3+、Mn2+;第(4)(5)问转化:由已知信息②知,Fe的金属活动性强于Bi,且调pH=2.6时Mn2+和Fe2+进入滤液,可知加入金属Bi的目的是将Fe3+还原为Fe2+。(1)联合焙烧时,进一步粉碎矿石,可以增大矿石与空气的接触面积,能够提高焙烧效率,a符合题意;鼓入适当过量的空气有利于矿石充分反应,b符合题意;降低焙烧温度,反应速率减慢,不利于提高焙烧效率,c不符合题意;
[对点训练](2023·扬州模拟)工业以炼钢污泥(主要成分为铁的氧化物,还含有CaO、SiO2、C等杂质)为原料制备脱硫剂活性Fe2O3·H2O,并用该脱硫剂处理沼气中H2S的流程如图:
(2)“除杂”:若使还原后的滤液中Ca2+完全沉淀(离子浓度小于10-6ml·L-1),则滤液中c(F-)需大于__________;若溶液的pH偏低,将会导致CaF2沉淀不完全,其原因是___________________________________[Ksp(CaF2)=1.44×10-10,Ka(HF)=3.53×10-4]。(3)“沉铁”:生成FeCO3沉淀的离子方程式为___________________________________________________________________________________。
(4)“脱硫、再生”:活性Fe2O3·H2O是一种固体脱硫剂(无水Fe2O3无脱硫作用),其原理是将废气中的含硫化合物化学吸附到脱硫剂的孔隙中,发生反应改变其化学组成。当脱硫剂达到饱和后,即不再具有脱硫能力,需要对其进行再生。利用活性Fe2O3·H2O脱除沼气中的H2S可转化成Fe2S3·H2O,其脱除及常温下再生的原理如图所示。
①“脱硫”反应的化学方程式为_______________________________________________________________________________________________。②工业上要求脱除及再生整个过程温度不能超过90 ℃,原因是_____________________________________________________________;多次“再生”后,脱硫剂的活性不断下降,脱硫效果明显变差的原因可能是____________________________________________________________。
(4)①根据反应原理可知在“脱硫”反应中,Fe2O3·H2O和H2S反应产生Fe2S3·H2O和H2O;②工业上要求脱除及再生整个过程温度不能超过90 ℃,这是由于温度超过90 ℃,Fe2O3·H2O和Fe2S3·H2O均会发生分解,失去结晶水,失去脱硫作用;多次“再生”后,脱硫剂的活性不断下降,脱硫效果明显变差的原因可能是由于多次“再生”后,脱硫剂表面的大部分孔隙被S或其他物质覆盖,使得脱硫剂的活性下降。
题型(二) 以物质分离提纯为主体的化工流程1.常用的分离方法
[注意] 物质分离提纯的原则①不增:不引入新的杂质。②不减:不减少被提纯的物质。③易分离:被提纯物质与杂质易于分离。④易复原:被提纯的物质易恢复原来的组成、状态。
[典例] (2022·全国乙卷)废旧铅蓄电池的铅膏中主要含有PbSO4、PbO2、PbO和Pb。还有少量Ba、Fe、Al的盐或氧化物等。为了保护环境、充分利用铅资源,通过如图流程实现铅的回收。
一些难溶电解质的溶度积常数如下表:
一定条件下,一些金属氢氧化物沉淀时的pH如下表:
回答下列问题:(1)在“脱硫”中PbSO4转化反应的离子方程式为__________________,用沉淀溶解平衡原理解释选择Na2CO3的原因______________________________________________________。(2)在“脱硫”中,加入Na2CO3不能使铅膏中BaSO4完全转化,原因是_________________________________________。
(3)在“酸浸”中,除加入醋酸(HAc),还要加入H2O2。(ⅰ)能被H2O2氧化的离子是____________;(ⅱ)H2O2促进了金属Pb在醋酸中转化为Pb(Ac)2,其化学方程式为_______________________________________________________;(ⅲ)H2O2也能使PbO2转化为Pb(Ac)2,H2O2的作用是_________________。(4)“酸浸”后溶液的pH约为4.9,滤渣的主要成分是__________________。(5)“沉铅”的滤液中,金属离子有______________。
[解析] (1)PbCO3的Ksp远小于PbSO4的Ksp,易发生生成PbCO3的沉淀转化,且进行较为彻底。(2)BaCO3的Ksp大于BaSO4的Ksp,不易发生生成BaCO3的沉淀转化,即使发生程度也很小。(3)(ⅰ)过氧化氢有氧化性,亚铁离子有还原性,会被过氧化氢氧化为铁离子。(ⅱ)过氧化氢与Pb、HAc发生氧化还原反应生成Pb(Ac)2和H2O,反应的化学方程式为Pb+H2O2+2HAc===Pb(Ac)2+2H2O。(ⅲ)过氧化氢也能使PbO2转化为Pb(Ac)2,铅元素化合价由+4价降低到了+2价,PbO2是氧化剂,则过氧化氢是还原剂。
(4)酸浸后溶液的pH约为4.9,依据金属氢氧化物沉淀时的pH可知,滤渣主要成分为氢氧化铝、氢氧化铁。(5)依据分析可知,加入碳酸钠不能使铅膏中的BaSO4完全转化,铁离子、铝离子转化成了氢氧化铁、氢氧化铝沉淀,铅转化成了氢氧化铅,最终变成了氧化铅,因此沉铅的滤液中,金属离子有Ba2+和加入碳酸钠、氢氧化钠时引入的Na+。
[对点训练](2023·济南模拟)铈可用作优良的环保材料,现以氟碳铈矿(CeFCO3,含Fe2O3、FeO等杂质)为原料制备铈,其工艺流程如图所示:
回答下列问题:(1)粉碎后“焙烧”时,氧化数据如表所示:
(2)用盐酸和H3BO3提取Ce元素时,体现盐酸的性质有______________,“滤渣Ⅰ”用饱和KCl溶液溶解时发生复分解反应,则“滤渣Ⅱ”主要成分为_________________________________________________(填化学式)。 (3)“滤液Ⅰ”中c(Ce3+)=0.1 ml·L-1,用氨水调pH的范围是__________,“滤液Ⅱ”中加入NH4HCO3反应的离子方程式为________________________________________,若Ce2(CO3)3经充分焙烧质量减少5.8 t,则获得CeO2的质量为__________t。(4)用过量铝粉还原CeO2即可得Ce,反应的化学方程式为________________________,铝粉必须过量的原因是_____________________________________________。
解析:氟碳铈矿在空气中焙烧,Ce(Ⅲ)在空气中被氧化为Ce(Ⅳ),Fe(Ⅱ)被氧化为Fe(Ⅲ),用盐酸和H3BO3的混合液浸取,Ce(Ⅳ)被还原,过滤得到滤渣Ⅰ,主要成分是难溶于水的Ce(BF4)3,Fe3+进入滤液Ⅰ;滤渣Ⅰ用饱和KCl溶液溶解时发生复分解反应,生成KBF4和CeCl3溶液,滤渣Ⅱ是KBF4;向滤液Ⅱ(含Ce3+的溶液)中再加入碳酸氢铵使Ce3+沉淀为Ce2(CO3)3,最后焙烧生成CeO2,再经还原得到Ce。
相关课件
这是一份第60讲 无机化工流程题的解题策略-2024高考化学一轮复习高频考点精讲(新教材新高考)课件PPT,共37页。PPT课件主要包含了复习目标,必备知识,温度高苯,专项突破,FeOH3沉淀,抑制Cu2+的水解,FeOH3,除去Cu2+,-108,流程分析等内容,欢迎下载使用。
这是一份新高考化学一轮复习课件 第8章 第55讲 无机化工流程题的解题策略,共60页。PPT课件主要包含了高考化学一轮复习策略,复习目标,归纳整合,工业流程题的结构,专项突破,真题演练明确考向,课时精练等内容,欢迎下载使用。
这是一份2023届高三化学二轮复习 工艺流程解题策略 课件,共15页。PPT课件主要包含了化工流程题,化工流程基本结构,工业流程题的呈现模式,原料处理,分离提纯,获得产品,工业流程题的解题思路,读题干,思考寻找生产目的,分析工艺流程等内容,欢迎下载使用。









