




2024届高考化学一轮复习 第一章 物质及其变化 第4讲 氧化还原反应课件PPT
展开这是一份2024届高考化学一轮复习 第一章 物质及其变化 第4讲 氧化还原反应课件PPT,共57页。PPT课件主要包含了浓硫酸,mol,答案C,答案D,物质得到电子,物质失去电子,氧化性,还原性,答案B,答案A等内容,欢迎下载使用。
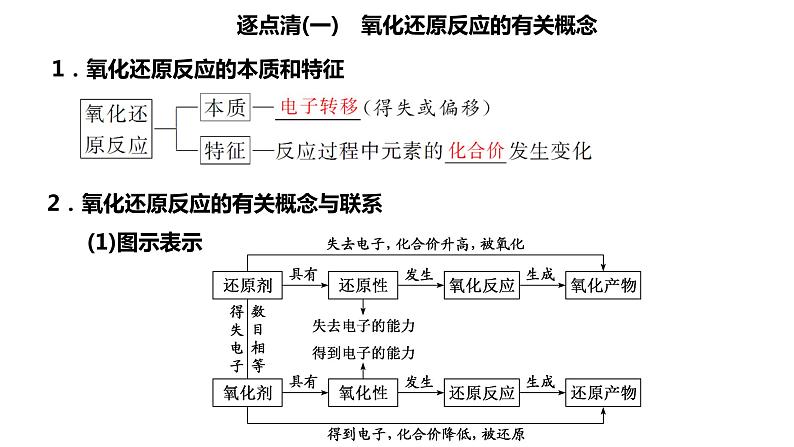
逐点清(一) 氧化还原反应的有关概念1.氧化还原反应的本质和特征
2.氧化还原反应的有关概念与联系(1)图示表示
①氧化剂是________,发生______反应,被还原,生成______产物SO2。②还原剂是C,发生______反应,被氧化,生成______产物CO2。③C和浓硫酸在反应中分别表现______性和______性。④反应生成1 ml CO2,浓硫酸得_________电子,C失去______电子,反应转移_______电子。
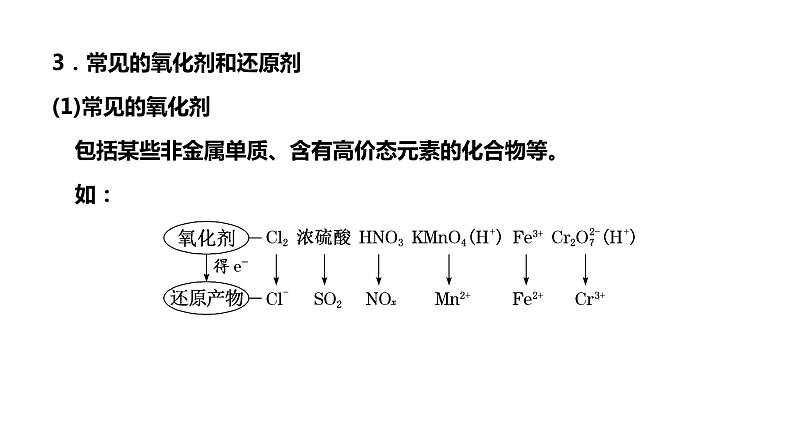
3.常见的氧化剂和还原剂(1)常见的氧化剂包括某些非金属单质、含有高价态元素的化合物等。如:
(2)常见的还原剂包括活泼的金属单质、非金属阴离子及含低价态元素的化合物、低价金属阳离子、某些非金属单质及其氢化物等。如:
[注意] 同一种氧化剂(或还原剂)所对应的还原产物(或氧化产物)不是一成不变的,而是决定于还原剂(或氧化剂)的性质、反应条件、反应物的浓度、反应介质的酸碱性等多种因素。如KMnO4在酸性溶液中的还原产物一般是Mn2+;在中性或碱性溶液中的还原产物一般是锰的较高价态的化合物,如MnO2、K2MnO4等。
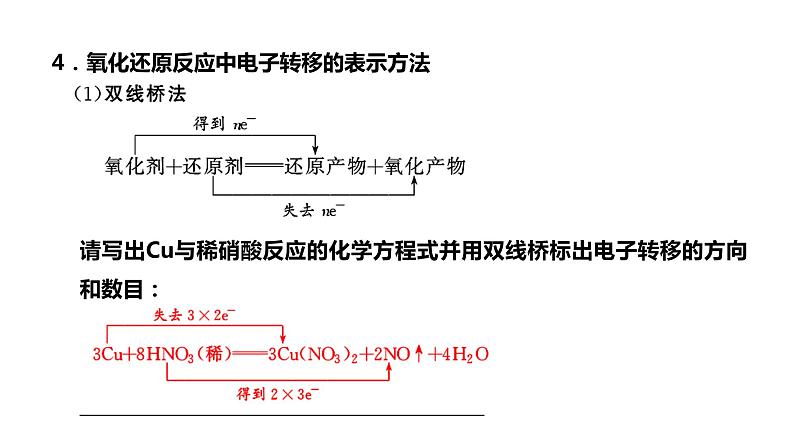
4.氧化还原反应中电子转移的表示方法
请写出Cu与稀硝酸反应的化学方程式并用双线桥标出电子转移的方向和数目:__________________________________________
________________________________________________
[注意] ①双线桥法一定注明“得到”和“失去”并且电子数相等。②单线桥法一定注意箭头指向氧化剂且注明电子总数目,不能注明“得”或“失”。
微点小练1.判断正误(正确的打“√”,错误的打“×”)。(1)O2与O3之间的转化是氧化还原反应 ( )(2)氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原 ( )(3)Cl2+H2O HCl+HClO反应中H2O作还原剂,Cl2作氧化剂 ( )(4)NaH与H2O反应中H2O被氧化发生氧化反应 ( )(5)金属阳离子只具有氧化性,非金属阴离子只具有还原性 ( )(6)置换反应都是氧化还原反应,化合反应可能是氧化还原反应 ( )
2.对于反应3Cu+8HNO3===3Cu(NO3)2+2NO↑+4H2O中,氧化剂为____________,氧化产物为____________;Cu发生____________反应,表现____________性;3 ml铜完全反应,转移____________ ml e-,还原____________ ml HNO3。答案:HNO3 Cu(NO3)2 氧化 还原 6 2
[题点考法·全面练通]题点(一) 氧化还原反应的概念及其本质1.(2023·福州月考)实验室利用以下反应制取少量氮气:NaNO2+NH4Cl===NaCl+N2↑+2H2O,关于该反应的下列说法正确的是 ( )A.NaNO2发生氧化反应B.NH4Cl中的氮元素被还原C.N2既是氧化产物,又是还原产物D.每生成1 ml N2转移电子的物质的量为6 ml
解析:NaNO2中N元素的化合价由+3价→0价,化合价降低,被还原,发生还原反应,故A错误;NH4Cl中N元素的化合价由-3价→0价,化合价升高,被氧化,发生氧化反应,故B错误;根据选项A和B的分析,N2既是氧化产物又是还原产物,故C正确;每生成1 ml N2,同时消耗1 ml NaNO2或1 ml NH4Cl,转移电子物质的量为3 ml,故D错误。
2.二氧化氯(ClO2)是国际上公认的安全无毒的绿色消毒剂。它的一种制备原理为2NaClO3+H2O2+H2SO4===Na2SO4+2ClO2↑+O2↑+2H2O,下列说法正确的是 ( )A.该反应中NaClO3发生了氧化反应B.该反应中H2O2既是氧化剂又是还原剂C.氧化产物与还原产物的物质的量之比为2∶1D.每生成标准状况下2.24 L O2时转移0.2 ml电子解析:A项,NaClO3发生还原反应,错误;B项,H2O2只作还原剂,错误;C项,氧化产物(O2)与还原产物(ClO2)的物质的量之比为1∶2,错误。
题点(二) 电子转移的表示和计算3.下列化学反应中电子转移方向、数目表示正确的是 ( )
解析:A项Cl2―→NaCl应为得e-,Cl2―→NaClO应为失e-;B项中氧化产物与还原产物均为Cl2,且转移电子数目为5e-;C项中用单线桥表示电子转移时不标“得失”。
解析:由方程式可知,CO是还原产物;SiH4发生氧化反应;氧化剂与还原剂分别为CO2和SiH4,反应中物质的量之比为4∶1;每生成1 ml SiO2,转移8 ml电子。答案:D
解析:A为置换反应,B为复分解反应,D为分解反应,而C项铁元素和碳元素有化合价的变化,属于氧化还原反应且不属于四种基本反应类型。
[归纳拓展]氧化还原反应与四种基本反应类型的关系
逐点清(二) 物质的氧化性、还原性及其强弱的比较 (一)氧化性、还原性的概念1.氧化性是指______________的性质(或能力);还原性是指_______________的性质(或能力)。2.元素价态与氧化性、还原性的关系
(二)氧化性、还原性强弱的比较方法1.依据反应原理
氧化性:氧化剂____氧化产物;还原性:还原剂____还原产物。
微点小练1.判断正误(正确的打“√”,错误的打“×”)。(1)得(失)电子数目越多,氧化(还原)性越强 ( )(2)难失电子的物质一定易得电子 ( )(3)同一元素的化合价越高,其氧化性越强 ( )(4)稀硝酸与Cu反应生成NO,而浓硝酸与Cu反应生成NO2,稀硝酸得电子更多,故稀硝酸的氧化性大于浓硝酸 ( )(5)金属性:Fe>Cu,则氧化性:Fe3+
[题点考法·全面练通]1.根据反应①→④,可以判断下列4种物质的氧化性由强到弱的正确顺序是( )①Cl2+2KI===2KCl+I2②2FeCl2+Cl2===2FeCl3③2FeCl3+2HI===2FeCl2+2HCl+I2④H2S+I2===S+2HIA.S>I2>Fe3+>Cl2B.Cl2>Fe3+>I2>SC.Fe3+>Cl2>S>I2D.Cl2>I2>Fe3+>S
解析:根据同一反应中氧化剂的氧化性强于氧化产物的氧化性,判断各物质的氧化性强弱。①中氧化剂是Cl2,氧化产物是I2,Cl2的氧化性强于I2的氧化性;②中氧化剂是Cl2,氧化产物是FeCl3,Cl2的氧化性强于FeCl3的氧化性;③中氧化剂是FeCl3,氧化产物是I2,FeCl3的氧化性强于I2的氧化性;④中氧化剂是I2,氧化产物是S,I2的氧化性强于S的氧化性。各物质的氧化性由强到弱的顺序为Cl2>Fe3+>I2>S。
2.(2023·日照模拟)已知C2O3在酸性溶液中易被还原成C2+,且还原性:I->Fe2+>Cl->C2+。下列反应在水溶液中不可能发生的是 ( )A.3Cl2+6FeI2===2FeCl3+4FeI3B.Cl2+FeI2===FeCl2+I2C.C2O3+6HCl===2CCl2+Cl2↑+3H2OD.2Fe3++2I-===2Fe2++I2解析:根据氧化性:Cl2>FeCl3>I2,因此氯气可以氧化Fe2+,也可以氧化I-,但是碘离子还原性强于亚铁离子,碘离子会先被氯气氧化,正确的离子方程式是Cl2不足时,Cl2+2I-===2Cl-+I2(Fe2+不反应),Cl2过量时,3Cl2+2Fe2++4I-===6Cl-+2I2+2Fe3+,所以A不可能发生;B.根据反应,得出氧化性是Cl2>I2,反应可能发生;C.根据反应,得出氧化性是C2O3>Cl2,反应可能发生;D.根据反应,得出氧化性是FeCl3>I2,反应可能发生。
A.要除去含有A2+、Z-和B-混合溶液中的A2+,而不氧化Z-和B-,应加入Z2B.还原性强弱顺序为A2+>B->Z->X2+
4.某同学设计完成了以下两个实验:①向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色(生成了HIO3)。②向盛有KBr溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成红棕色。继续向试管中滴加氯水,振荡,CCl4层的颜色没有变化。下列说法不正确的是 ( )A.实验①生成HIO3时发生的反应为 I2+5Cl2+6H2O===2HIO3+10HClB.实验②中当CCl4层变成红棕色时可通过分液的方法获得Br2的CCl4溶液C.由上述实验得出Cl2、Br2、I2的氧化性由强到弱的顺序是Cl2>Br2>I2D.由上述实验得出Cl2、HIO3、HBrO3的氧化性由强到弱的顺序是 HBrO3> Cl2 >HIO3
逐点清(三) 氧化还原反应的三大规律及应用 (一)守恒律1.质量守恒 反应前后元素的种类和质量不变。2.电子守恒即氧化剂得电子的总数等于还原剂失电子的总数,这是配平氧化还原反应方程式的依据,也是有关氧化还原反应计算的依据。3.电荷守恒离子方程式中,反应物中各离子的电荷总数与产物中各离子的电荷总数相等。如Fe3++Cu===Fe2++Cu2+(错误),2Fe3++Cu===2Fe2++Cu2+(正确)。
3.H3PO2是一元中强酸,H3PO2及NaH2PO2均可将溶液中Ag+还原为银,从而可用于化学镀银。(1)H3PO2中,P元素的化合价为________。(2)利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4∶1,则氧化产物为________(填化学式)。解析:4×(1-0)=1×(n-1),n=5,故氧化产物为H3PO4。答案:(1)+1 (2)H3PO4
(二)价态律1.价态归中规律含有不同价态的同种元素物质间发生氧化还原反应时,该元素的价态变化一定遵循“高价+低价―→中间价”,即“价态相邻能共存,价态相间能归中,归中价态不交叉,价升价降只靠拢。”如:KClO3+6HCl(浓)===3Cl2↑+KCl+3H2O 反应中盐酸起还原剂和酸性的作用,KCl中氯的化合价并未发生变化,氯气既是氧化产物又是还原产物。又如图所示。
不会出现⑤中H2S和H2SO4反应,H2S转化为SO2而H2SO4转化为S的情况。
2.歧化反应规律同一元素发生氧化还原反应生成不同价态的物质时,该元素的价态变化一定遵循“中间价态→高价态+低价态”,不会出现“一边倒”的现象,即生成物中该元素的价态不能都比反应物中该元素价态高,或都比反应物中该元素价态低。
[对点训练]4.已知在热的碱性溶液中,NaClO发生反应:3NaClO===2NaCl+NaClO3。在相同条件下NaClO2也能发生类似的反应,其最终产物是 ( )A.NaCl、NaClO B.NaCl、NaClO3C.NaClO、NaClO3 D.NaClO3、NaClO4答案:B
5.氯气跟氢氧化钾溶液在一定条件下发生反应:Cl2+KOH―→KX+KY(未配平),KX在一定条件下能自身反应:KX―→KY+KZ(未配平,KY与KZ关系比为1∶3),以上KX、KY、KZ均是一元酸的钾盐,由以上条件推知在KX中氯的化合价是 ( )A.+1 B.+3 C.+5 D.+7解析:反应:Cl2+KOH―→KX+KY是Cl2的歧化反应,KX、KY中的氯元素分别显正价和-1价;由于KX也发生歧化反应:KX―→KY+KZ,可断定KY为KCl,化合价高低:Z中Cl>X中Cl(均为正价)。假设KX中Cl为+a价,KZ中Cl的化合价为+b价,依据化合价守恒原理及KX―→KY+3KZ,有a+1=3(b-a),把a=1、a=3、a=5代入上式讨论,可知a=5时,b=7符合题意。则KX中Cl的化合价为+5。
7.向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示。有关说法不正确的是 ( )A.线段BC代表Fe3+物质的量的变化情况B.原混合溶液中c(FeBr2)=6 ml·L-1C.当通入Cl2 2 ml时,溶液中已发生的离子 反应可表示为2Fe2++2I-+ 2Cl2===2Fe3++I2+4Cl-D.原溶液中n(Fe2+)∶n(I-)∶n(Br-)=2∶1∶3
解析:根据还原性Br-
相关课件
这是一份2024届高考化学一轮复习 第一章 物质及其变化 第5讲 氧化还原反应的相关计算及化学方程式的书写课件PPT,共52页。PPT课件主要包含了答案B,答案D,Na2SO3,K2Cr2O7,Na2SO4,答案C,配平流程,对点训练,补项原则,组合方式等内容,欢迎下载使用。
这是一份2024版新教材高考化学全程一轮总复习第一章物质及其变化第4讲氧化还原反应课件,共60页。PPT课件主要包含了化合价,有关概念及联系,浓硫酸,mol,SO2,Mn2+,Cr3+,Fe3+,H2O,答案C等内容,欢迎下载使用。
这是一份2024届高考化学一轮复习课件 第一章 物质及其变化 第3讲 氧化还原反应,文件包含第3讲氧化还原反应pptx、第3讲氧化还原反应docx、第3讲氧化还原反应课后作业docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。












