




2024届高考化学一轮复习 第七章 化学反应速率与化学平衡 第6讲 工业生产中的化学平衡图像分析课件PPT
展开
这是一份2024届高考化学一轮复习 第七章 化学反应速率与化学平衡 第6讲 工业生产中的化学平衡图像分析课件PPT,共60页。PPT课件主要包含了灵活运用解题技巧,答案B等内容,欢迎下载使用。
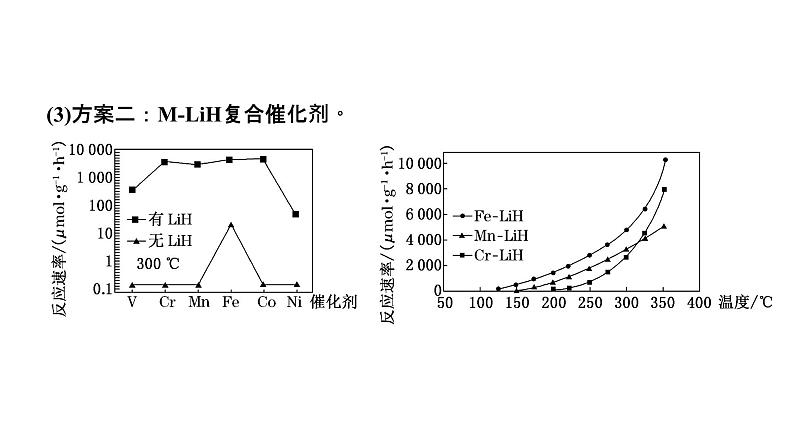
(3)方案二:MLiH复合催化剂。
下列说法正确的是______。a.300 ℃时,复合催化剂比单一催化剂效率更高b.同温同压下,复合催化剂有利于提高氨的平衡产率c.温度越高,复合催化剂活性一定越高
解析:(1)对于合成氨反应,常温下,ΔG=ΔH-TΔS=-92.4 kJ·ml-1-298 K×(-0.2 kJ·K-1·ml-1)=-32.8 kJ·ml-1Kd (3)T3~T4区间,化学反应已达到平衡,由于正反应是放热反应,温度升高平衡向逆反应方向移动,不利于CO2的捕获
三、化工生产中的复杂图像分析(一)关注4类常考图像关注点1 曲线上的每个点是否都达到平衡往往需要通过曲线的升降趋势或斜率变化来判断,如果还未达到平衡则不能使用平衡移动原理,只有达到平衡以后的点才能应用平衡移动原理。
关注点2 催化剂的活性是否受温度的影响不同的催化剂因选择性不同受温度的影响也会不同。一般来说,催化剂的活性在一定温度下最高,低于或高于这个温度都会下降。
如以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。则根据两条曲线可以判断涉及影响反应速率的两个因素:催化剂和温度,250~300 ℃时,温度升高而乙酸的生成速率降低的原因是温度超过250 ℃时,催化剂的催化效率降低。
关注点3 不同的投料比对产率也会造成影响可以根据定一议二的方法,根据相同投料比下温度或压强的改变对产率的影响或相同温度或压强下改变投料比时平衡移动的方向进行判断,确定反应的吸放热或系数和的大小。
当投料比一定时,温度越高,CO2的转化率越低,所以升温,平衡左移,正反应为放热反应。若温度不变,提高投料比[n(H2)/n(CO2)],则提高了二氧化碳的转化率。
关注点4 考虑副反应的干扰或影响试题往往会有一定的信息提示,尤其温度的改变影响较大。
(二)熟练运用两步解题流程第一步:通过读图识图获取有用信息
在依据化学反应原理中反应速率和平衡移动知识解读图像的基础上,还需要进行如下思考:
第二步:对获取的图像信息进行加工处理(对图像信息加工处理的角度如图所示)
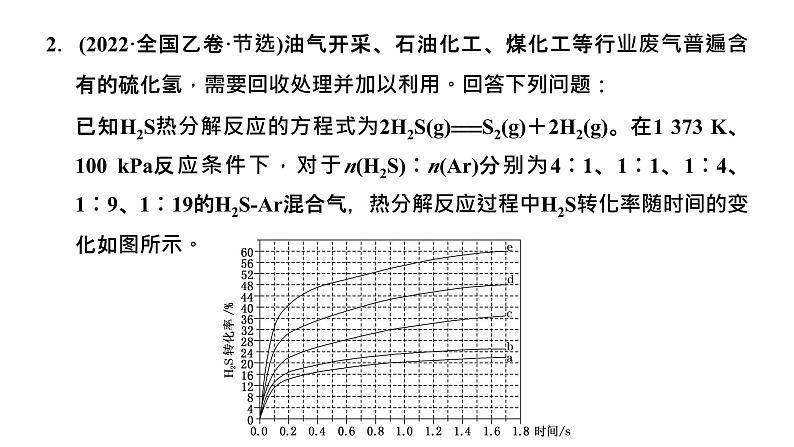
(2)对于反应Ⅰ,总压恒定为100 kPa,在密闭容器中通入C3H8和N2的混合气体(N2不参与反应),从平衡移动的角度判断,达到平衡后“通入N2”的作用是________________________________。在温度为T1时,C3H8的平衡转化率与通入气体中C3H8的物质的量分数的关系如图a所示,计算T1时反应Ⅰ的平衡常数Kp=________kPa(以分压表示,分压=总压×物质的量分数,保留一位小数)。
(3)在温度为T2时,通入气体分压比为p(C3H8)∶p(O2)∶p(N2)=10∶5∶85的混合气体,各组分气体的分压随时间的变化关系如图b所示。0~1.2 s生成C3H6的平均速率为______kPa·s-1;在反应一段时间后,C3H8和O2的消耗速率比小于2∶1的原因为_______________________。
[解题流程] 第一步:通过读图识图获取有用信息(1)图a中横坐标为通入气体中C3H8的物质的量分数的变化(外界条件变化),纵坐标为C3H8的平衡转化率(反应体系变化),其C3H8的平衡转化率随通入气体中C3H8的物质的量分数增大而降低,图中所给的关键点为(0.4,50)。(2)图b中,由横纵坐标可知此图像为时间分压图像,由图可知C3H6时间与分压关系的关键点为(1.2,2.4)。
[答案] (1)271 (2)减小气体浓度,使平衡右移,提高C3H8(g)转化率 16.7 (3)2 H2和C3H6都消耗O2
(1)将n(CO2)∶n(H2)=1∶4的混合气体充入密闭容器中发生上述反应Ⅰ、Ⅱ,在不同温度和压强时,CO2的平衡转化率如图。0.1 MPa时,CO2的转化率在600 ℃之后,随温度升高而增大的主要原因是_______________________________________________。
①起始时容器内气体的总压强为1.2p kPa,若5 min时反应到达c点,v(H2)=___________ml·L-1·min-1。②b点时反应的平衡常数Kp=__________(kPa)-1(以分压表示)。③c点时,再加入CO2(g)和H2O(g),使二者分压均增大0.05p kPa,则H2的转化率__________(填“增大”“不变”或“减小”)。
解析:(1)反应Ⅰ的ΔH1 0,600 ℃之后,温度升高,反应Ⅱ向右移动,二氧化碳减少的量比反应Ⅰ向左移动二氧化碳增加的量多,所以二氧化碳的转化率增大。
相关课件
这是一份2024届高考化学一轮复习 第七章 化学反应速率与化学平衡 第3讲 化学平衡状态 化学平衡常数课件PPT,共46页。PPT课件主要包含了同一条件,反应物,生成物,3特征,答案B,K1·K2,3意义及影响因素,答案D等内容,欢迎下载使用。
这是一份2024届高考化学一轮复习 第七章 化学反应速率与化学平衡 第2讲 催化剂的反应机理与能垒图像课件PPT,共54页。PPT课件主要包含了答案D,答案B,CH3OH,CH3COOH,答案C,答案A等内容,欢迎下载使用。
这是一份第50讲 化学反应速率和化学平衡图像的分析-2024年高考化学一轮复习高频考点精讲(新教材新高考)课件PPT,共48页。PPT课件主要包含了复习目标,速率-时间图像,类型一,必备知识,专项突破,反应进程折线图,类型二,恒压或恒温线,类型三,类型四等内容,欢迎下载使用。









