





高中化学沪科技版(2020)选择性必修1第2章 化学反应的方向、限度和速率2.3化学反应的速率影响化学反应速率的因素示范课课件ppt
展开一、化学反应速率的影响因素
不同的化学反应,具有不同的反应速率,这说明化学反应速率的大小主要取决于 。
反应物的组成、结构和性质
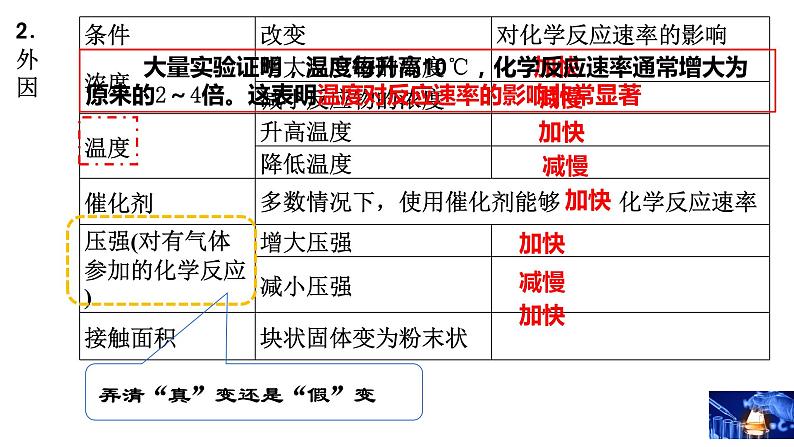
大量实验证明,温度每升高10℃,化学反应速率通常增大为原来的2~4倍。这表明温度对反应速率的影响非常显著
弄清“真”变还是“假”变
学以致用 提升关键能力
A.减小压强能增大反应速率B.使用适当催化剂能增大反应速率C.升高温度不能增大反应速率D.增大压强对该反应速率无影响
①定性描述——通过实验现象判断可通过观察产生气泡的快慢,判断反应速率的大小。
②定量描述——通过实验测量判断可根据产生相同体积的氢气所需要的时间长短或相同时间内收集氢气的体积大小,判断反应速率的大小。
二、实验探究——定性与定量研究研究影响化学反应速率的因素
【实验探究Ⅰ】定性研究影响化学反应速率的因素
选择实验用品,设计实验探究影响化学反应速率的因素【实验仪器】烧杯、试管、量筒、试管架、胶头滴管、温度计、秒表【实验药品】0.1 ml/L Na2S2O3溶液、0.1 ml/L H2SO4溶液、0.5 ml/L H2SO4溶液、5% H2O2溶液、1ml/L FeCl3溶液、蒸馏水、热水【实验原理】Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O
【问题提出】浓度、温度、催化剂等因素如何影响化学反应速率?如何测定化学反应速率?
1.选择化学反应。2.确定待研究的影响因素。3.设计改变影响因素的操作。4.确定观测反应快慢的指标。
(1)探究浓度对反应速率快慢的影响
【实验药品】0.1 ml/L Na2S2O3溶液、0.1 ml/L H2SO4溶液、0.5 ml/L H2SO4溶液、5% H2O2溶液、1ml/L FeCl3溶液、蒸馏水、热水
(一)实验探究——定性研究影响化学反应速率的因素
【实验药品】0.1 ml/L Na2S2O3溶液、0.1 ml/L H2SO4溶液、 0.5 ml/L H2SO4溶液、
【实验步骤】相同条件下,分别在两只试管中加入 5mL0.1 ml/L Na2S2O3溶液,在一只试管滴加 5mL 0.1 ml/L H2SO4溶液,另一只试管中滴加5mL 0.1 ml/L H2SO4溶液,观察实验现象。
Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O
(1)探究浓度对反应速率的影响
【实验现象】两支试管中的溶液 ,滴加 0.5 ml·L-1 H2SO4溶液的试管_________。
【实验结论】其他条件相同时,增大反应物浓度,化学反应速率增大
(二)探究温度对反应速率快慢的影响
(2)探究温度对反应速率快慢的影响
【实验药品】0.1 ml/L Na2S2O3溶液、0.1 ml/L H2SO4溶液、蒸馏水、热水
【实验步骤】相同条件下,分别在两只试管中取 5mL0.1 ml/L Na2S2O3溶液和5mL 0.1 ml/L H2SO4溶液,将其中一支试管放入装热水的烧杯中,另一只试管放入装冷水的烧杯中,观察实验现象。
烧杯中装热水 烧杯中装冷水
【实验结论】其他条件相同时,升高温度,化学反应速率增大。
烧杯中装热水 烧杯中装冷水
【实验现象】两支试管中的溶液均变浑浊,烧杯中装热水的试管先变浑浊。
(3)探究催化剂对反应速率快慢的影响
【实验药品】5% H2O2溶液、1ml/L FeCl3溶液、蒸馏水、
【实验步骤】在相同条件下,分别在个锥形瓶中取10mL5%H2O2溶液,在一个锥形瓶中加入5滴1ml/L FeCl3溶液,另一个锥形瓶中加入5滴蒸馏水,观察实验现象
【实验结论】催化剂可以_改变__化学反应速率。
【实验现象】 加蒸馏水的锥形瓶中余烬没有复燃; 加1ml/L FeCl3溶液的锥形瓶中余烬复燃。
(二)定量研究影响化学反应速率的因素
增大反应物浓度,化学反应速率增大
有同学认为上述实验设计不合理,不能得出相应的结论。请简述理由并提出改进措施。
二者的阴离子不同,对实验会造成干扰。
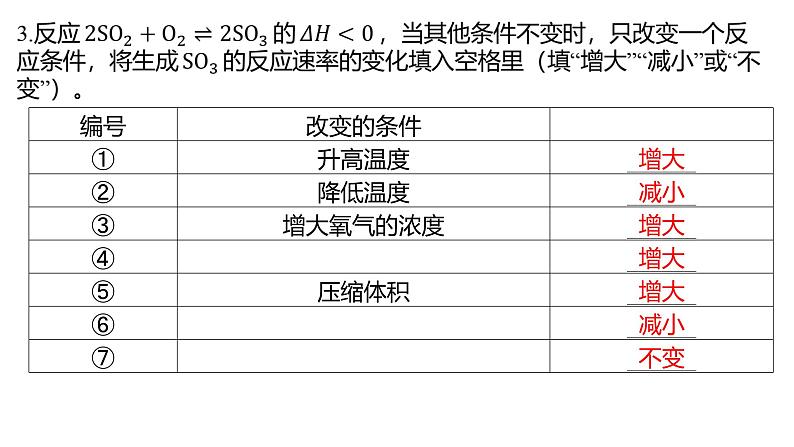
3.某化学兴趣小组为探究外界条件对化学反应速率的影响,设计以下四组实验。
人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第一节 化学反应速率课文课件ppt: 这是一份人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第一节 化学反应速率课文课件ppt,共18页。
高中化学苏教版 (2019)选择性必修1第一单元 化学反应速率完美版课件ppt: 这是一份高中化学苏教版 (2019)选择性必修1第一单元 化学反应速率完美版课件ppt,共29页。PPT课件主要包含了温故知新,常见外因,物质本身的性质,活化分子,活化能,①增大压强,→气体反应物浓度增大,②压强改变→,气体反应物浓度不变,→反应速率不变等内容,欢迎下载使用。
人教版 (2019)选择性必修1第一节 化学反应速率备课课件ppt: 这是一份人教版 (2019)选择性必修1第一节 化学反应速率备课课件ppt,文件包含212影响化学反应速率的因素分层作业解析版-上好课2022-2023学年高二化学同步备课系列人教版2019选择性必修1docx、212影响化学反应速率的因素分层作业原卷版-上好课2022-2023学年高二化学同步备课系列人教版2019选择性必修1docx、212影响化学反应速率的因素课件高二化学同步备课系列人教版2019选择性必修1pptx等3份课件配套教学资源,其中PPT共0页, 欢迎下载使用。













