

所属成套资源:新教材适用2023_2024学年高中化学新人教版选择性必修2课时作业(24份)
- 新教材适用2023_2024学年高中化学第2章分子结构与性质第3节分子结构与物质的性质第1课时共价键的极性课时作业新人教版选择性必修2 试卷 0 次下载
- 新教材适用2023_2024学年高中化学第2章分子结构与性质第3节分子结构与物质的性质第2课时分子间的作用力分子的手性课时作业新人教版选择性必修2 试卷 0 次下载
- 新教材适用2023_2024学年高中化学第3章晶体结构与性质学业质量标准检测新人教版选择性必修2 试卷 0 次下载
- 新教材适用2023_2024学年高中化学第3章晶体结构与性质第1节物质的聚集状态与晶体的常识课时作业新人教版选择性必修2 试卷 0 次下载
- 新教材适用2023_2024学年高中化学第3章晶体结构与性质第2节分子晶体与共价晶体第1课时分子晶体课时作业新人教版选择性必修2 试卷 0 次下载
新教材适用2023_2024学年高中化学第2章分子结构与性质阶段重点突破练新人教版选择性必修2
展开
这是一份新教材适用2023_2024学年高中化学第2章分子结构与性质阶段重点突破练新人教版选择性必修2,共8页。
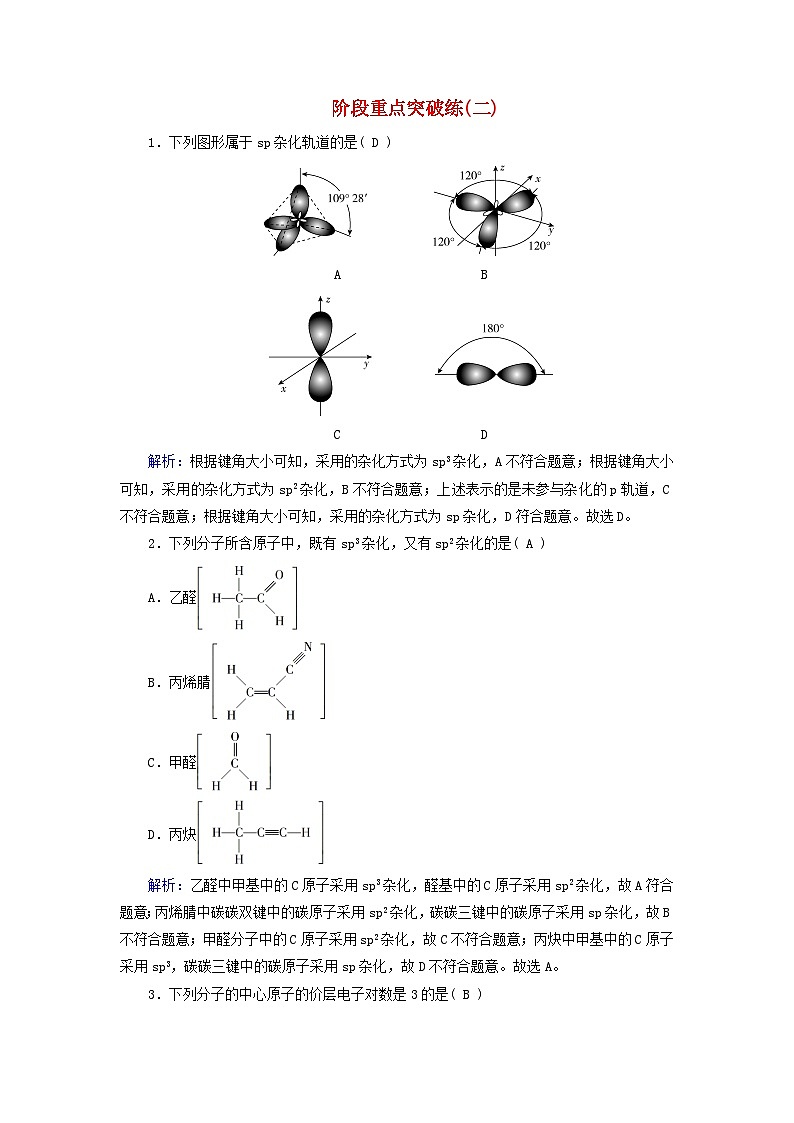
阶段重点突破练(二)1.下列图形属于sp杂化轨道的是( D ) A B C D解析:根据键角大小可知,采用的杂化方式为sp3杂化,A不符合题意;根据键角大小可知,采用的杂化方式为sp2杂化,B不符合题意;上述表示的是未参与杂化的p轨道,C不符合题意;根据键角大小可知,采用的杂化方式为sp杂化,D符合题意。故选D。2.下列分子所含原子中,既有sp3杂化,又有sp2杂化的是( A )A.乙醛B.丙烯腈C.甲醛D.丙炔解析:乙醛中甲基中的C原子采用sp3杂化,醛基中的C原子采用sp2杂化,故A符合题意;丙烯腈中碳碳双键中的碳原子采用sp2杂化,碳碳三键中的碳原子采用sp杂化,故B不符合题意;甲醛分子中的C原子采用sp2杂化,故C不符合题意;丙炔中甲基中的C原子采用sp3,碳碳三键中的碳原子采用sp杂化,故D不符合题意。故选A。3.下列分子的中心原子的价层电子对数是3的是( B )A.H2O B.BF3 C.CH4 D.NH3解析:水分子中氧原子、甲烷分子中碳原子和氨分子中氮原子的价层电子对数都为4,三氟化硼分子中硼原子的价层电子对数为3,故选B。4.下列描述中正确的是( D )A.CS2分子的立体构型为V形B.ClO的立体构型为平面三角形C.NH3、CO、CO2的中心原子都有孤电子对D.SiF4和SO的中心原子均采取sp3杂化解析:CS2中C原子孤电子对数==0、价电子对数=2+0=2,是直线形结构,A不正确;ClO中中心原子价层电子对数为3+=4,孤对电子对数是1,所以是三角锥形结构,B不正确;NH3中N原子孤电子对数==1、CO中C原子孤电子对数==1、CO2中C原子孤电子对数==0,C不正确;SiF4的中心原子孤电子对数==0、价层电子对数=4+0=4,故中心原子为sp3杂化;SO内中心原子孤电子对数==1、价层电子对数=3+1=4,故中心原子为sp3杂化,D正确。故选D。5.在N2F2分子中的所有原子均符合8电子稳定结构,对该分子的有关说法正确的是( B )A.两个σ键,两个π键B.三个σ键,一个π键C.分子中的四个原子在一条直线上D.分子中的N原子采取sp3杂化解析:在N2F2分子中,所有原子均符合8电子稳定结构,N原子形成三个共用电子对,F原子形成一个共用电子对,则N2F2分子的结构为,双键中含有一个σ键和一个π键,单键中含有一个σ键,因此1个N2F2分子中含有三个σ键,一个π键,根据双键的结构特点可知,四个原子处于同一平面,N原子的价层电子对数=2+=3,因此N原子采取sp2杂化,综上所述,说法正确的是B项,故选B。6.下列分子或离子的立体构型和中心原子的杂化方式均正确的是( C )A.AsH3 平面三角形 sp3杂化B.H3O+ 平面三角形 sp2杂化C.H2Se V形 sp3杂化D.CO 三角锥形 sp3杂化解析:AsH3中心原子的价层电子对数=3+×(5-3×1)=4,As的杂化方式为sp3,含有一对孤电子对,分子的立体构型为三角锥形,选项A错误;H3O+的中心原子的价层电子对数=3+×(6-1-3×1)=4,O的杂化方式为sp3,含有一对孤电子对,分子的立体构型为三角锥形,选项B错误;H2Se中心原子的价层电子对数=2+×(6-2×1)=4,Se的杂化方式为sp3,含有两对孤电子对,分子的立体构型为V形,选项C正确;CO中心原子的价层电子对数=3+×(4+2-3×2)=3,C的杂化方式为sp2,没有孤电子对,分子的立体构型为平面三角形,选项D错误。故选C。7.如图所示,在乙烯分子中有5个σ键、1个π键,下列表述正确的是( A )A.C原子的sp2杂化轨道与H原子的1s轨道形成的σ键B.C原子的sp2杂化轨道与H原子的1s轨道形成的π键C.C原子的2p轨道与C原子的2p轨道形成的σ键D.C原子的sp2杂化轨道与C原子的sp2杂化轨道形成的π键解析:C—H键是C原子的sp2杂化轨道与H原子的1s轨道形成的σ键,故A正确;C===C键中一个C原子的2p未杂化轨道与另一个C原子的2p未杂化轨道形成π键,故B错误;C===C键中C原子的sp2杂化轨道与C原子的sp2杂化轨道形成σ键,故C错误;C原子的sp2杂化轨道形成σ键,未杂化的2p轨道形成π键,故D错误。故选A。8.1,3-唑()是淡黄色液体,常作为荧光增白剂。下列说法错误的是( B )A.第一电离能:N>O>CB.基态氧原子核外电子有8种空间运动状态C.1 mol分子中含有8 mol σ键D.分子中C、N原子的杂化方式均为sp2解析:C、N、O为相邻的同周期元素,由于N的2p轨道半充满,所以其第一电离能比O大,从而得出第一电离能:N>O>C,A正确;基态氧原子核外电子排布式为1s22s22p4,有1s、2s、三个2p轨道,共有5种空间运动状态,B错误;1,3-唑分子中,含有3个C—H σ键、2个C—N σ键、1个C—C σ键、2个C—O σ键,则1 mol分子中含有8 mol σ键,C正确;1,3-唑分子中,C、N原子的价层电子对数都为3,所以均发生sp2杂化,D正确。故选B。9.X、Y、Z、Q、R是元素周期表前四周期元素,且原子序数依次增大:X原子核外有6种不同运动状态的电子;Y最外层电子数比次外层电子数多3个;Z基态原子的2p能级成对电子数与未成对电子数相等;Q电子总数是最外层电子的3倍;R是用量最大使用最广泛的金属。下列说法正确的是( C )A.R2+的价电子排布式为3d54s1B.第一电离能Z>Y>XC.XZ2的分子空间构型为直线形D.最简单氢化物分子键角:Y<Q解析:X原子核外有6种不同运动状态的电子,则X是6号元素,X为C,Y最外层电子数比次外层电子数多3个,则Y为N,Z基态原子的2p能级成对电子数与未成对电子数相等,则为2s22p4,则Z为O,Q电子总数是最外层电子的3倍,则Q为P,R是用量最大使用最广泛的金属,则R是Fe。Fe2+的价电子排布式为3d6,A错误;N的价层电子排布式为2s22p3,是半满的稳定结构,其第一电离能大于O的第一电离能,B错误;CO2中心原子C的价层电子对数为2,是sp杂化,其分子空间构型为直线形,C正确;最简单氢化物NH3和PH3中N的电负性较大,且N—H较短,相邻两个N—H间的斥力较大,键角较大,D错误。故选C。10.关于CH3OH,N2H4和(CH3)2NNH2的结构,下列说法错误的是( D )A.1 mol CH3OH中含5 mol σ键B.N2H4分子中所有原子不可能处于同一平面C.三者孤电子对数相同D.三者中C、O、N杂化方式不相同解析:CH3OH的结构式为,1 mol CH3OH中含5 mol σ键,A正确;任何条件下这六个原子都不可能共面,N2H4中两个N都是sp3杂化,周围的空间构型都是三角锥,整个分子就是两个三角锥连起来的,N2H4分子中所有原子不可能处于同一平面,B正确;CH3OH中羟基氧上有两对孤电子对,N2H4有两对孤电子对,2个N上分别有1对,(CH3)2NNH2中有两对孤电子对,2个N上分别有1对,C正确;三者中C、O、N杂化方式相同均为sp3杂化,D错误。故选D。11.下表中关于各微粒的描述完全正确的一项是( C )选项ABCD分子或离子的化学式H2F+PCl3NOBH中心原子的杂化轨道类型spsp3sp2sp3VSEPR模型名称直线形四面体形平面三角形正四面体形分子或离子的空间结构直线形正四面体形V形三角锥形解析:H2F+离子中氟原子的价层电子对数为4,则离子的VSEPR模型为四面体形,故A错误;三氯化磷分子中磷原子的价层电子对数为4,孤电子对数为1,则分子的VSEPR模型为四面体形、分子的空间构型为三角锥形,故B错误;亚硝酸根离子中氮原子的价层电子对数为3,孤电子对数为1,则原子的杂化方式为sp2杂化,离子的VSEPR模型为平面三角形、分子的空间构型为V形,故C正确;四氢合硼离子中硼原子的价层电子对数为4,孤电子对数为0,则离子的空间构型为正四面体形,故D错误。故选C。12.COCl2(光气)、SOCl2(亚硫酰氯)、CCl4均为8e-稳定结构的氯化试剂,可与TiO2反应制备TiCl4,下列说法错误的是( C )A.CCl4和TiCl4分子的空间构型相同B.上述三个制备反应均为非氧化还原反应C.COCl2、SOCl2中C原子和S原子的杂化方式相同D.与基态Ti原子同周期且未成对电子数相同的元素有3种解析:四氯化碳和四氯化钛分子中中心原子的配位数都为4,中心原子的杂化方式都为sp3杂化,分子的空间构型均为正四面体形,故A正确;光气与二氧化钛共热反应生成四氯化钛和二氧化碳、亚硫酰氯与二氧化钛共热反应生成四氯化钛和二氧化硫、四氯化碳与二氧化钛共热反应生成四氯化钛和二氧化碳,三个反应中都没有元素发生化合价变化,都为非氧化还原反应,故B正确;光气中碳原子的价层电子对数为3,原子的杂化方式为sp2杂化,亚硫酰氯中硫原子的价层电子对数为4,原子的杂化方式为sp3杂化,则碳原子和硫原子的杂化方式不同,故C错误;钛元素的原子序数为22,基态原子的价电子排布式为3d24s2,原子中有2个未成对电子,第四周期中未成对电子数为2的原子还有镍、锗、硒,共有3种,故D正确。故选C。13.sp2杂化轨道——BF3分子的形成过程如下,据图回答问题。 (1)sp2杂化轨道是由 一个ns 轨道和 两个np 轨道杂化而得。sp2杂化轨道间的夹角为 120° ,呈 平面三角 形(如BF3)。(2)sp2杂化后,未参与杂化的一个np轨道可以用于形成 π键 ,如乙烯分子中 碳碳双键 的形成。14.回答下列问题:(1)BCl3和NCl3中心原子的杂化类型分别为 sp2 杂化和 sp3 杂化。(2)在BF3分子中,F—B—F的键角是 120° ,BF3和过量NaF作用可生成NaBF4,BF的立体构型为 正四面体形 。(3)CS2、N2O等与CO2互为等电子体,则CS2的结构式为 S===C===S ,空间构型为 直线形 。(4)乙炔与氢氰酸(HCN)反应可得丙烯腈(CH2===CHCN)。丙烯腈分子中σ键和π键的个数之比为 21 ,分子中处于同一直线上的原子数目最多为 3 。解析:(1)BCl3的中心原子价层电子对个数是3,NCl3的σ键电子对数为3,孤电子对数为1,则NCl3的中心原子价层电子对个数是4,根据价层电子对互斥理论判断中心原子杂化类型,前者为sp2,后者为sp3。(2)BF3分子为平面正三角形结构,所以F—B—F键角为120°;BF中B原子价层电子对个数=4+=4,且不含孤电子对,根据价层电子对互斥理论判断该微粒立体构型为正四面体形。(3)等电子体结构相似,CO2的结构式为O===C===O,是直线形分子,则二硫化碳结构式为S===C===S,也为直线形。(4)共价单键为σ键,共价双键中含有一个σ键、一个π键,所以丙烯腈分子中σ键和π键的个数之比=63=21;C-C≡N位于同一条直线上,H2C===CH—中所有原子共平面,共价单键可以旋转,所以该分子中最多有3个原子共直线。15.价电子对互斥(简称VSEPR)理论可用于预测简单分子的空间结构。请回答下列问题:(1)利用价电子对互斥理论推断下列分子或离子的空间结构:①SeO3 平面三角形 ;②SCl2 V形 ;③NO 直线形 ;④NO V形 ;⑤HCHO 平面三角形 ;⑥HCN 直线形 。(2)利用价电子对互斥理论推断键角的大小:①甲醛分子中H—C—H的键角 < (填“>”“<”或“=”,下同)120°;②SnBr2分子中Br—Sn—Br的键角 < 120°;③PCl3分子中Cl—P—Cl的键角 < 109°28′。(3)有两种活性反应中间体微粒,它们的微粒中均含有1个碳原子和3个氢原子。请依据图所示的这两种微粒的球棍模型,写出相应的化学式:A: CH ;B: CH 。(4)按要求写出第二周期非金属元素组成的中性分子的化学式:平面形分子 BF3 ,三角锥形分子 NF3 ,四面体形分子 CF4 。解析:(1)SeO3中,Se的价电子对数为3+×(6-2×3)=3,孤电子对数为0,SeO3为平面三角形;SCl2中,S的价电子对数为2+×(6-1×2)=4,孤电子对数为2,SCl2为V形;NO中,N的价电子对数为2+×(5-1-2×2)=2,孤电子对数为0,NO为直线形;NO中,N的价电子对数为2+×(5+1-2×2)=3,孤电子对数为1,NO为V形;HCHO分子中有1个碳氧双键,看作1对成键电子,2个C—H单键为2对成键电子,C原子的价电子对数为3,且无孤电子对,所以HCHO分子的空间结构为平面三角形;HCN分子的结构式为H-C≡N,含有1个C≡N键,看作1对成键电子,1个C—H单键为1对成键电子,故C原子的价电子对数为2,且无孤电子对,所以HCN分子的空间结构为直线形。(2)①甲醛为平面形分子,由于C===O键与C—H键之间的排斥作用大于2个C—H键之间的排斥作用,所以甲醛分子中H—C—H的键角小于120°。②SnBr2分子中,Sn原子的价电子对数是2+×(4-1×2)=3,成键电子对数为2,孤电子对数为1,故SnBr2分子的空间结构为V形,Br—Sn—Br的键角<120°。③PCl3分子中,P的价电子对数为3+×(5-1×3)=4,含有1对孤电子对,由于孤电子对与P—Cl键的排斥作用大于P—Cl键间的排斥作用,所以Cl—P—Cl的键角小于109°28′。(3)AB3型微粒,中心原子上无孤电子对的呈平面三角形,有1对孤电子对的呈三角锥形,所以化学式分别是CH、CH。(4)第二周期的五种非金属元素B、C、N、O、F组成的中性分子中,平面形分子为BF3,三角锥形分子为NF3,四面体形分子为CF4。16.按要求回答下列问题。(1)根据价层电子对互斥模型,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是_H2S__。(2)H2O和SO的中心原子的杂化轨道类型分别为_sp3、sp3__,试判断H2O和SO的键角大小关系并说明原因:_H2O分子键角小于SO的键角,因为H2O中的O存在2对孤电子对、SO中的S不存在孤电子对,孤电子对对成键电子对的斥力大于成键电子对之间的斥力__。(3)成语“信口雌黄”中的雌黄分子式为As2S3,分子结构如图,As原子的杂化方式为_sp3__,雌黄和SnCl2在盐酸中反应转化为雄黄(As4S4)和SnCl4并放出H2S气体,SnCl4分子的空间结构为_正四面体形__。(4)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间结构为_平面三角形__,C原子的杂化方式为_sp2__。(5)某绿色农药结构简式如图,回答下列问题:分子中编号为①的碳原子和与其成键的另外几个原子构成的空间结构为_四面体形__;CSe2首次是由H2Se和CCl4反应制取的,试比较CSe2、H2Se、CCl4三种分子的键角_CSe2>CCl4>H2Se__(按由大到小顺序排列)。(6)S8与热的浓NaOH溶液反应的产物之一为Na2S3,S的空间结构为_V形__。(7)[H2F]+[SbF6]-(氟酸锑)是一种超强酸,则[H2F]+的空间结构为_V形__。(8)Na3AsO4中含有的化学键类型包括_离子键、共价键__;AsO的空间结构为_正四面体形__。解析:(6)S的电子式为[]2-,由于中心S原子含有两个孤电子对,所以该离子的空间结构为V形。(7)[H2F]+的中心原子为F,它的孤电子对数为×(7-1-1×2)=2,成键电子对数为2,价层电子对数为2+2=4,VSEPR模型为四面体形,由于有两个孤电子对,故分子的空间结构为V形。





