

所属成套资源:新教材适用2023_2024学年高中化学新人教版选择性必修2课时作业(24份)
- 新教材适用2023_2024学年高中化学第2章分子结构与性质第3节分子结构与物质的性质第2课时分子间的作用力分子的手性课时作业新人教版选择性必修2 试卷 0 次下载
- 新教材适用2023_2024学年高中化学第2章分子结构与性质阶段重点突破练新人教版选择性必修2 试卷 0 次下载
- 新教材适用2023_2024学年高中化学第3章晶体结构与性质第1节物质的聚集状态与晶体的常识课时作业新人教版选择性必修2 试卷 0 次下载
- 新教材适用2023_2024学年高中化学第3章晶体结构与性质第2节分子晶体与共价晶体第1课时分子晶体课时作业新人教版选择性必修2 试卷 0 次下载
- 新教材适用2023_2024学年高中化学第3章晶体结构与性质第2节分子晶体与共价晶体第2课时共价晶体课时作业新人教版选择性必修2 试卷 0 次下载
新教材适用2023_2024学年高中化学第3章晶体结构与性质学业质量标准检测新人教版选择性必修2
展开
这是一份新教材适用2023_2024学年高中化学第3章晶体结构与性质学业质量标准检测新人教版选择性必修2,共12页。
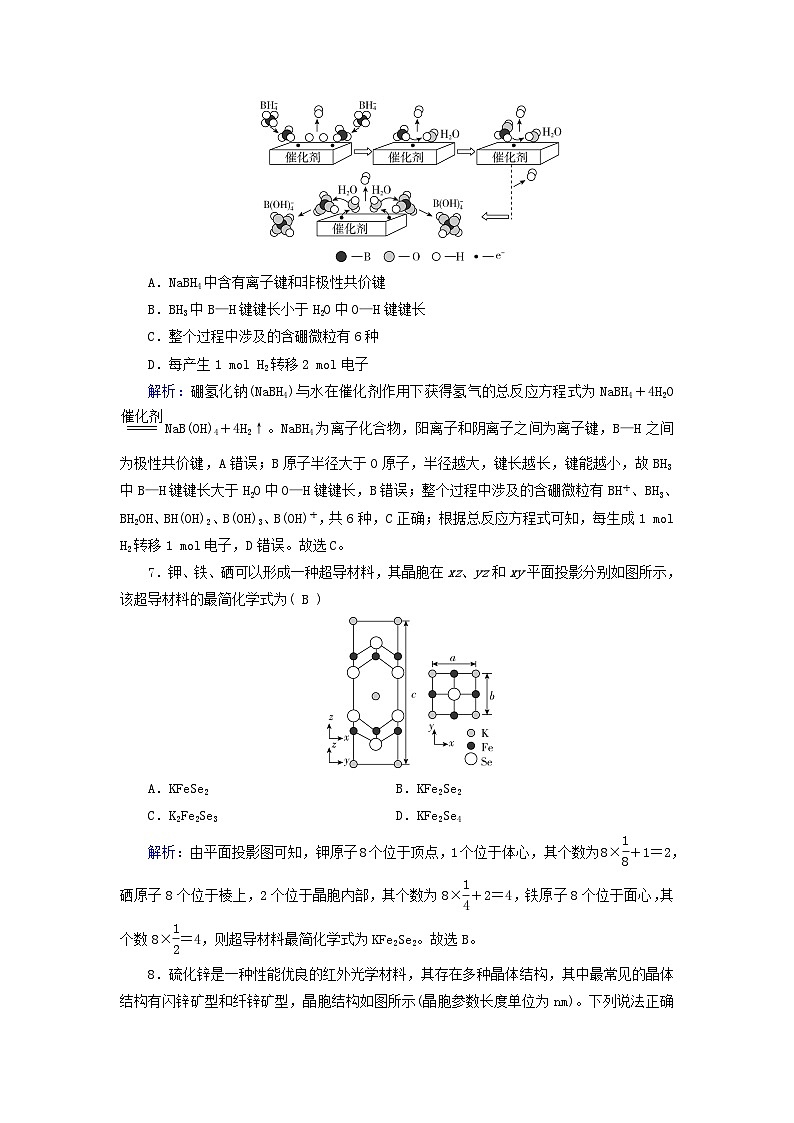
第三章 学业质量标准检测(时间:75分钟 满分:100分)一、选择题(本题共14小题,每题3分,共42分。每小题只有一个选项符合题目要求)1.下列关于物质特殊聚集状态结构的叙述中,错误的是( D )A.超分子是由两个或多个分子相互“组合”在一起形成具有特定结构和功能的聚集体,能表现出不同于单个分子的性质B.非晶体基本构成微粒的排列是长程无序和短程有序的C.液晶内部分子沿分子长轴方向有序排列,使液晶具有各向异性D.纳米材料包括纳米颗粒与颗粒间的界面两部分,两部分都是长程有序的解析:超分子能表现出不同于单个分子的性质,其原因是两个或多个分子相互“组合”在一起,形成具有特定结构和功能的聚集体,A正确;构成非晶体的微粒,在非晶体中的排列,遵循长程无序和短程有序的规则,B正确;液晶具有各向异性,其原因是液晶内部分子沿分子长轴方向进行有序排列,C正确;纳米材料实际上是三维空间尺寸至少有一维处于纳米级尺度的、具有特定功能的材料,纳米材料内部具有晶体结构,但界面处则为无序结构,D错误。故选D。2.下列性质可能符合分子晶体特点的是( B )①熔点1 070 ℃,易溶于水,水溶液能导电②熔点10.31 ℃,液态不导电,水溶液能导电③能溶于CS2,熔点112.8 ℃,沸点444.6 ℃④熔点97.81 ℃,质软,固态能导电,密度为0.97 g·cm-3A.①④ B.②③ C.①② D.②④解析:在分子晶体中,相邻分子靠分子间作用力相互吸引。分子晶体熔化时,只需克服分子间作用力,不破坏化学键,所以分子晶体一般具有较低的熔点。此外,分子晶体还具有硬度小、易升华、有较强的挥发性、一般不导电等特点。①熔点高,不是分子晶体的性质;②熔点低,不导电,可能是分子晶体的性质;③熔沸点不高,可能是分子晶体的性质;④固态能导电,不是分子晶体的性质。故选B。3.用NA表示阿伏加德罗常数的值,下列叙述正确的是( D )A.标准状况下,22.4 L HF中HF分子的个数为NAB.60 g二氧化硅中Si—O键个数为2NAC.1 mol白磷中含有的P—P键个数为4NAD.20 g D2O中含有的氧原子数为NA解析:标准状况下,HF是液体,无法用气体摩尔体积计算,A项错误;60 g二氧化硅的物质的量为1 mol,二氧化硅晶体中每个硅原子形成4个Si—O键,则含有4 mol Si—O键,即含有Si—O键个数为4NA,B项错误;白磷分子中含有6个P—P键,则1 mol白磷中含有的P—P键个数为6NA,C项错误;20 g D2O的物质的量为1 mol,则其中含有的氧原子数为NA,D项正确。故选D。4.关于晶体的下列说法正确的是( B )A.任何晶体中,若含有阳离子就一定有阴离子B.氯化钠溶于水时晶体中的离子键被破坏C.晶体中分子间作用力越大,分子越稳定D.离子晶体中只含有离子键,不含有共价键解析:晶体中如果含有阳离子,可能不含阴离子,如:金属晶体是由金属阳离子和自由电子构成的,故A错误;氯化钠溶于水电离为氯离子和钠离子,晶体中的离子键被破坏,故B正确;分子的稳定性取决于分子内原子间共价键的键能大小,与分子间作用力无关,故C错误;离子晶体可能含有共价键,如NaOH,故D错误。故选B。5.下列说法中正确的有( C )①含有离子的晶体一定是离子晶体;②离子键是阴、阳离子间的相互吸引作用;③金属晶体的导电性、导热性均与自由电子有关;④共价键的强弱决定分子晶体熔、沸点的高低;⑤共价晶体中一定含有共价键;⑥分子晶体的熔点一定比金属晶体低;⑦NaCl晶体中,阴离子周围紧邻的阳离子数为6;⑧硬度由大到小:金刚石>碳化硅>晶体硅。A.2个 B.3个 C.4个 D.5个解析:①金属晶体含有金属阳离子,故含有离子的晶体不一定是离子晶体,故错误;②离子键是阴、阳离子间的静电作用力,包括吸引力和排斥力,故错误;③金属晶体的导电性、导热性均与自由电子有关,故正确;④分子晶体熔、沸点的高低由分子间作用力决定,故错误;⑤共价晶体是原子通过共价键结合而成,所以共价晶体含有共价键,故正确;⑥分子晶体的熔点不一定比金属晶体低,如汞在常温下为液体,碘是分子晶体,常温下为固体,故错误;⑦NaCl晶体中,阴离子周围紧邻的阳离子数为6,故正确;⑧金刚石、碳化硅、晶体硅均为共价晶体,键能越大,硬度越大,原子半径:C>Si,键长:C—C>C—Si>Si—Si,键能:C—C>C—Si>Si—Si,故硬度由大到小:金刚石>碳化硅>晶体硅,故正确;综上所述,共4个正确。故选C。6.硼氢化钠(NaBH4)与水在催化剂作用下获得氢气的微观过程如下图所示。下列说法正确的是( C )A.NaBH4中含有离子键和非极性共价键B.BH3中B—H键键长小于H2O中O—H键键长C.整个过程中涉及的含硼微粒有6种D.每产生1 mol H2转移2 mol电子解析:硼氢化钠(NaBH4)与水在催化剂作用下获得氢气的总反应方程式为NaBH4+4H2ONaB(OH)4+4H2↑。NaBH4为离子化合物,阳离子和阴离子之间为离子键,B—H之间为极性共价键,A错误;B原子半径大于O原子,半径越大,键长越长,键能越小,故BH3中B—H键键长大于H2O中O—H键键长,B错误;整个过程中涉及的含硼微粒有BH、BH3、BH2OH、BH(OH)2、B(OH)3、B(OH),共6种,C正确;根据总反应方程式可知,每生成1 mol H2转移1 mol电子,D错误。故选C。7.钾、铁、硒可以形成一种超导材料,其晶胞在xz、yz和xy平面投影分别如图所示,该超导材料的最简化学式为( B )A.KFeSe2 B.KFe2Se2C.K2Fe2Se3 D.KFe2Se4解析:由平面投影图可知,钾原子8个位于顶点,1个位于体心,其个数为8×+1=2,硒原子8个位于棱上,2个位于晶胞内部,其个数为8×+2=4,铁原子8个位于面心,其个数8×=4,则超导材料最简化学式为KFe2Se2。故选B。8.硫化锌是一种性能优良的红外光学材料,其存在多种晶体结构,其中最常见的晶体结构有闪锌矿型和纤锌矿型,晶胞结构如图所示(晶胞参数长度单位为nm)。下列说法正确的是( C )A.两种类型晶体中硫离子的配位数均为6B.闪锌矿中若A原子的坐标参数为(0,1,0)则B为C为C.已知阿伏加德罗常数为NA,则纤锌矿型晶胞密度为ρ= g/cm3D.Zn2+的基态核外价电子排布式为[Ar]3d10解析:根据两种晶体的结构,Zn原子位于四个S原子形成的四面体的内部,S原子也位于四个Zn原子形成的四面体的内部,所以纤锌矿型晶体结构中S2-的配位数为4,闪锌矿型晶体结构中S2-的配位数也为4,A错误;根据原子A的坐标可知底面左上角S原子为原点,晶胞棱长为单位1,原子B位于面对角线,坐标为,C位于体对角线上,坐标为,B错误;纤锌矿型晶胞中硫原子在顶点、面心和内部,硫原子的个数为12×+2×+3=6,Zn原子在棱上和内部,锌原子的个数为6×+4=6,则化学式为ZnS,该晶胞底面为正六边形,则体积为a2c nm3,1 mol晶胞的质量为97×6,密度为ρ== g/cm3,C正确;Zn是第30号元素,原子价电子排布式为3d104s2,基态Zn2+是原子失去2个电子得到的,价电子排布式为3d10,D错误。故选C。9.近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为Fe、Sm、As、F、O组成的化合物。下列说法正确的是( B )A.元素As与N同族,可预测AsH3分子中As—H键间的键角大于NH3中N—H键间的键角B.NH3的水溶液中存在不同的氢键,其中根据氨水显碱性可以推测NH3和H2O间存在的主要氢键形式可能为(NH3)N…H—O(H2O)C.配合物Fe(CO)n可用作催化剂,Fe(CO)n内中心原子价电子数与配位体提供电子总数之和为18,则n=4D.每个H2O分子最多可与两个H2O分子形成两个氢键解析:As与N同主族,从上往下电负性减弱,电负性越强,成键电子对越靠近中心原子,成键电子对之间斥力越大,键角越大,故NH3键角大于AsH3键角,A错误;由于一水合氨电离产生铵根离子和氢氧根,故推测NH3和H2O间存在的主要氢键形式可能为(NH3)N…H—O(H2O),B正确;中心原子的价层电子排布为3d64s2,共8个价电子,每个配体CO可提供2个电子,故n=5,C错误;水分子中O原子有2个孤电子对,可与2个水分子形成氢键,2个氢原子也可形成2个氢键,故可与4个水分子形成4个氢键,D错误。故选B。10.下列说法正确的是( B )A.金刚石与石墨烯中的C—C—C夹角都为120°B.SiH4、SiCl4都是由极性键构成的非极性分子C.锗原子(32Ge)基态核外电子排布式为4s24p2D.ⅣA族元素单质的晶体类型相同解析:金刚石中的碳原子为正四面体结构,C—C—C夹角为109°28′,故A错误;SiH4的化学键为Si—H,为极性键,为正四面体,正负电荷中心重合,为非极性分子;SiCl4的化学键为Si—Cl,为极性键,为正四面体,正负电荷中心重合,为非极性分子,故B正确;锗原子(32Ge)基态核外电子排布式为[Ar]3d104s24p2,故C错误;ⅣA族元素中的碳元素形成的石墨为混合晶体,而硅形成的晶体硅为原子晶体,故D错误。故选B。11.(2023·辽宁卷,14)晶体结构的缺陷美与对称美同样受关注。某富锂超离子导体的晶胞是立方体(图1),进行镁离子取代及卤素共掺杂后,可获得高性能固体电解质材料(图2)。下列说法错误的是( C )A.图1晶体密度为 g·cm-3B.图1中O原子的配位数为6C.图2表示的化学式为LiMg2OClxBr1-xD.Mg2+取代产生的空位有利于Li+传导解析:根据均摊法,图1的晶胞中含Li:8×+1=3,O:2×=1,Cl:4×=1,1个晶胞的质量为g=g,晶胞的体积为(a×10-10cm)3=a3×10-30cm3,则晶体的密度为g÷(a3×10-30cm3)= g·cm-3,A项正确;图1晶胞中,O位于面心,与O等距离最近的Li有6个,O原子的配位数为6,B项正确;根据均摊法,图2中Li:1,Mg或空位:8×=2。O:2×=1,Cl或Br:4×=1,Mg的个数小于2,根据正负化合价的代数和为0,图2的化学式为LiMgOClxBr1-x,C项错误;进行镁离子取代及卤素共掺杂后,可获得高性能固体电解质材料,说明Mg2+取代产生的空位有利于Li+的传导,D项正确。故选C。12.在碱性溶液中,Cu2+可与缩二脲形成紫色配离子,其结构如图。下列说法错误的是( D )A.该配离子中非金属元素的电负性大小顺序为O>N>C>HB.该配离子中铜离子的配位数是4C.基态Cu原子的价电子排布式是3d104s1D.该配离子中能与水分子形成氢键的原子只有N和O解析:根据同周期主族元素的电负性由左到右逐渐增大,同主族元素的电负性由上到下逐渐减小,所以该配离子中的非金属元素的电负性大小顺序为O>N>C>H,A项正确;根据配离子的结构可知,铜离子形成4个共价键,B项正确;根据铜离子的电子排布式可知,基态铜原子的价电子排布式为3d104s1,C项正确;N原子和O原子可与水分子中的H原子形成氢键,水分子中的O原子也可与配离子中的H原子形成氢键,D项错误。故选D。13.已知:SiCl4发生水解反应的机理如图,下列叙述正确的是( B )A.SiCl4的键角与白磷(P4)的键角相同B.H4SiO4脱水后加热分解得到的晶体中每个Si可参与形成12个12元环C.SiO2和SiCl4均属于共价晶体(原子晶体)D.CCl4不能按照上述机理发生水解反应,原因是C的原子半径小解析:SiCl4是和甲烷相似的结构,正四面体中心与顶点夹角为109°28′,P4为中空的正四面体结构,键角为60°,故A错误;H4SiO4脱水后加热分解得到二氧化硅,一个Si被12个12元环共用,故B正确;SiCl4属于分子晶体,由分子构成,SiO2是共价晶体(原子晶体),故C错误;CCl4不能按照上述机理发生水解反应,是因为C原子只有两个电子层,没有d轨道,难以形成sp3d杂化,故D错误。故选B。14.Cu2-xSe是一种钠离子电池正极材料,充放电过程中正极材料立方晶胞(示意图)的组成变化如图所示,晶胞内未标出因放电产生的0价Cu原子。下列说法正确的是( D )A.每个Cu2-xSe晶胞中Cu2+个数为xB.每个Na2Se晶胞完全转化为Cu2-xSe晶胞,转移电子数为2C.每个NaCuSe晶胞中0价Cu原子个数为1-xD.当NayCu2-xSe转化为NaCuSe时,每转移(1-y)mol电子,产生(1-x)mol Cu原子[解析] 由晶胞结构可知,位于顶点和面心的硒离子个数为8×+6×=4,位于体内的铜离子和亚铜离子的个数之和为8,设晶胞中的铜离子和亚铜离子的个数分别为a和b,则a+b=8-4x,由化合价代数和为0可得2a+b=4×2,解得a=4x,A错误;由题意可知,Na2Se转化为Cu2-xSe的电极反应式为Na2Se-2e-+(2-x)Cu===Cu2-xSe+2Na+,由晶胞结构可知,位于顶点和面心的硒离子个数为8×+6×=4,则每个晶胞中含有4个Na2Se,转移电子数为8,B错误;由题意可知,Cu2-x-Se转化为NaCuSe的电极反应式为Cu2-xSe+ e-+Na+===NaCuSe+(1-x)Cu,由晶胞结构可知,位于顶点和面心的硒离子个数为8×+6×=4,则每个晶胞中含有4个NaCuSe,晶胞中0价铜的个数为(4-4x),C错误;由题意可知,NayCu2-xSe转化为NaCuSe的电极反应式为NayCu2-xSe+(1-y) e-+(1-y) Na+===NaCuSe+(1-x)Cu,所以每转移(1-y)mol电子,产生(1-x)mol铜,D正确。故选D。二、非选择题(本题包括4小题,共58分)15.配位化学的应用十分广泛,在经济、生产、生活等方面都有重要作用。(1)在配合物中部分分子或离子与中心离子较紧密地结合在一起,组成在溶液中能够稳定存在的整体,称为“内界”(书写时用“[ ]”与外界分离)。与中心离子结合不够紧密的离子则处于“外界”。内界和外界不同,物质的性质也不同,如CoCl3与NH3形成的三种配合物A、B、C,Co3+的配位数均为6,但它们的颜色各异,如果各取1 mol A、B、C溶于水,加入足量硝酸银溶液,分别产生1 mol、2 mol、3 mol白色沉淀。则它们的化学式分别为A: [Co(NH3)4Cl2]Cl ;B: [Co(NH3)5Cl]Cl2 ,C: [Co(NH3)6]Cl3 ,它们的配体分别是A: NH3和Cl- ;B: NH3和Cl- ;C: NH3 。(2)甲醇和CO合成乙酸时,使用铑羰基化合物[Rh(CO)2I2]-作为催化剂,使得原本需要高压下才能进行的反应在低压下也能进行。其催化机理如图:①根据Rh的化合价可将Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ分为:1)化合价 +1 价,包含 Ⅰ、Ⅴ ;2)化合价 +3 价,包含 Ⅱ、Ⅲ、Ⅳ ;(有几种化合价填几类,可不填满,也可增加)②上述机理中包括 5 步反应,其中一步为氧化加成,该步反应的方程式为 。解析:(1)CoCl3与NH3形成的三种配合物A、B、C,Co3+的配位数均为6,说明“内界”有6个配体,如果各取1 mol A、B、C溶于水,加入足量硝酸银溶液,分别产生1 mol、2 mol、3 mol白色沉淀,说明“外界”Cl-的个数分别为1、2、3个,故化学式分别为A:[Co(NH3)4Cl2]Cl;B:[Co(NH3)5Cl]Cl2;C:[Co(NH3)6]Cl3;由以上结构可知,配体分别是A:NH3和Cl-;B:NH3和Cl-;C:NH3。(2)①由图示可知,CO可以认为化合价为0,根据正负化合价代数和为0可知,Ⅰ中Rh化合价为+1价,Ⅱ中Rh化合价为+3价,Ⅲ中Rh化合价为+3价,Ⅳ中Rh化合价为+3价,Ⅴ中Rh化合价为+1价;故为Rh+1价,包含Ⅰ、Ⅴ;Rh+3价,包含Ⅱ、Ⅲ、Ⅳ;②由图示可知,上述机理中包括5步反应,其中Ⅰ到Ⅱ的反应,Rh化合价由+1价变成+3价,作为还原剂被氧化,故氧化加成反应的方程式为。16.(2023·全国乙卷,35)中国第一辆火星车“祝融号”成功登陆火星。探测发现火星上存在大量橄榄石矿物(MgxFe2-xSiO4)。回答下列问题:(1)基态Fe原子的价电子排布式为_3d64s2__。橄榄石中,各元素电负性大小顺序为_O>Si>Fe>Mg__,铁的化合价为_+2__。(2)已知一些物质的熔点数据如下表:物质熔点/℃NaCl800.7SiCl4-68.8GeCl4-51.5SnCl4-34.1Na与Si均为第三周期元素,NaCl熔点明显高于SiCl4,原因是_Na的电负性小于Si,NaCl为离子晶体,而SiCl4为分子晶体__。分析同族元素的氯化物SiCl4、GeCl4、SnCl4熔点变化趋势及其原因_随着同族元素的电子层数的增多,其熔点依次升高,其原因是:SiCl4、GeCl4、SnCl4均形成分子晶体,分子晶体的熔点由分子间作用力决定,分子间作用力越大则其熔点越高;随着其相对分子质量增大,其分子间作用力依次增大__。SiCl4的空间结构为_正四面体__,其中Si的轨道杂化形式为_sp3__。(3)一种硼镁化合物具有超导性能,晶体结构属于立方晶系,其晶体结构、晶胞沿c轴的投影图如图所示,晶胞中含有_1__个Mg。该物质化学式为_MgB2__,B—B最近距离为 a 。解析:(1)Fe为26号元素,基态Fe原子的价电子排布式为3d64s2。元素的金属性越强,其电负性越小,元素的非金属性越强则其电负性越大,因此,橄榄石(MgxFe2-xSiO4)中,各元素电负性大小顺序为O>Si>Fe>Mg;因为MgxFe2-xSiO4中Mg、Si、O的化合价分别为+2、+4和-2,x+2-x=2,根据化合物中各元素的化合价的代数和为0,可以确定铁的化合价为+2。(2)Na与Si均为第三周期元素,NaCl熔点明显高于SiCl4,原因是:Na的电负性小于Si,NaCl为离子晶体,其熔点较高;而SiCl4为分子晶体,其熔点较低。由表中的数据可知, SiCl4、GeCl4、SnCl4熔点变化趋势为:随着同族元素的电子层数的增多,其熔点依次升高,其原因是:SiCl4、GeCl4、SnCl4均形成分子晶体,分子晶体的熔点由分子间作用力决定,分子间作用力越大则其熔点越高;随着其相对分子质量增大,其分子间作用力依次增大。SiCl4的空间结构为正四面体,其中Si的价层电子对数为4,因此Si的轨道杂化形式为sp3。(3)由硼镁化合物的晶体结构可知Mg位于正六棱柱的顶点和面心,由均摊法可以求出正六棱柱中含有12×+2×=3个Mg,由晶胞沿c轴的投影图可知本题所给晶体结构包含三个晶胞,则晶胞中Mg的个数为1;晶体结构中B在正六棱柱体内共6个,则该物质的化学式为MgB2;由晶胞沿c轴的投影图可知,B原子在图中两个正三角形的重心,该点到顶点的距离是该点到对边中点距离的2倍,顶点到对边的垂线长度为a,因此B—B最近距离为a××2=a。17.我国提取的月壤样品主要是由硅酸盐组成的辉石、斜长石,回答下列问题:(1)基态硅原子的价电子排布图为。(2)CO2与SiO2是同主族氧化物,但熔、沸点差距很大,其原因是 CO2是分子间作用力形成的分子晶体,SiO2是共价键形成的空间网状共价晶体 。(3)硅酸盐阴离子的基本结构单元如图1所示,其化学式SiO;图2阴离子由两个图1单元共用1个顶角氧组成,其所带的负电荷数为 6 ;图3是角项氧相连的硅氧四面体形成螺旋上升的长链,其Si、O原子的个数比为 13 。(4)Mg和Cu形成的晶体中,也存在四面体结构,Mg以金刚石方式堆积,剩余的4个四面体空隙放置Cu4四面体,如图4所示。Cu4四面体结构的镁配位数为 4 ,已知晶胞参数为a nm,NA为阿伏加德罗常数的值,则该晶体的密度为 ×1021 g·cm-3(列出计算表达式)。解析:(1)已知Si是14号元素,基态硅原子的核外电子排布式为:1s22s22p63s23p2,其价电子排布式为:3s23p2,则其价电子排布图为。(2)CO2是分子晶体,分子间是范德华力,SiO2是空间网状的共价晶体,原子之间是共价键,作用力远大于范德华力,所以固体CO2的熔、沸点比SiO2熔、沸点要小得多,故答案为:CO2是分子间作用力形成的分子晶体,SiO2是共价键形成的空间网状共价晶体。(3)由图可知,图1的化学式为SiO,形成二聚硅酸根离子是两个SiO通过1个O原子相连,可知图2的化学式为Si2O,在无限长链中,令含有n个Si,则含有[4n-(n-1)]=(3n+1)个O,故Si、O原子个数比为13。(4)如图4所示信息可知,Cu4相当于位于金刚石中正四面体中体内的碳原子位置,Cu4四面体结构的镁配位数即离Cu4最近的且距离相等的Mg个数为4,已知晶胞参数为a nm,NA为阿伏加德罗常数的值,一个晶胞中含有Mg个数为8×+6×+4=8,含有Cu个数为4×5=20,故一个晶胞的质量为 g,一个晶胞的体积为(a×10-7cm)3,则该晶体的密度为ρ===×1021g·cm-3。18.Zn2+、三乙撑二胺和对苯二甲酸根离子可形成晶体M,其晶胞示意图如下。(1)Zn2+的价层电子排布式是 3d10 。(2)C、O、N的电负性从大到小的顺序是 O>N>C 。(3)三乙撑二胺()与Zn2+能形成配位键的原因是 三乙撑二胺中的N给出孤电子对,Zn2+有空轨道能接受孤电子对 。(4)在晶体M每个空腔中装入一个顺式偶氮苯分子后形成晶体M1,晶胞示意图如图。一定条件下随着偶氮苯顺反结构的变化,晶体骨架发生畸变,晶体在M1和M2两种结构之间相互转化,可以吸收和释放N2,被称为“会呼吸”的晶体。晶体装载分子晶胞中Zn2+个数晶胞体积/cm3M1顺式偶氮苯x1.30×10-24M2反式偶氮苯42.46×10-24资料:ⅰ.反式偶氮苯顺式偶氮苯ⅱ.M1和M2相互转化时,Zn2+的配体和配体数均不变①N2的电子式是 N⋮⋮N 。②偶氮苯()中N的杂化轨道类型是 sp2 。偶氮苯存在顺反异构的原因是分子中两个氮原子间存在 π键 (填“σ键”或“π键”)。③x= 2 。④晶胞密度小则晶体内部的空隙大。能让“会呼吸”的晶体吸收N2的条件是 紫外 光照射。解析:(1)Zn2+的电子排布式为1s22s22p63s23p63d10,则其价层电子排布式是3d10。(2)C、O、N为同周期元素,从左到右的排列顺序为C、N、O,非金属依次增强,所以电负性从大到小的顺序是O>N>C。(3)Zn2+具有空轨道,三乙撑二胺()中的N原子具有孤对电子,所以三乙撑二胺与Zn2+能形成配位键的原因是:三乙撑二胺中的N给出孤电子对,Zn2+有空轨道能接受孤电子对。答案为:三乙撑二胺中的N给出孤电子对,Zn2+有空轨道能接受孤电子对。(4)①N原子的价电子数为5,需要形成三对共用电子,所以N2的电子式是N⋮⋮N。②偶氮苯()中N的价层电子对数为3,则杂化轨道类型是sp2。偶氮苯分子中,双键氮原子存在孤对电子,所以存在顺反异构,其原因是分子中两个氮原子间存在π键。③在晶体M的晶胞中,Zn2+位于棱上,每个棱被4个晶胞共用,则x=8×=2。④M1和M2相互转化时,Zn2+的配体和配体数均不变,即Zn2+、三乙撑二胺和对苯二甲酸根离子的个数比不变,现M1和M2中Zn2+个数比为24=12,所以相对分子质量比也为12,而M1的体积为1.30×10-24cm3,M2的体积为2.46×10-24cm3,所以二者的密度比为<11,所以M1的密度小。晶胞密度小则晶体内部的空隙大,从而得出M1能让“会呼吸”的晶体吸收N2,依据“反式偶氮苯顺式偶氮苯”,可得出条件是紫外光照射。






