




所属成套资源:新教材适用2023_2024学年高中化学新人教版选择性必修2全册课件(28份)
- 新教材适用2023_2024学年高中化学第2章分子结构与性质第2节分子的空间结构第1课时分子结构的测定和多样性价层电子对互斥模型课件新人教版选择性必修2 课件 0 次下载
- 新教材适用2023_2024学年高中化学第2章分子结构与性质第2节分子的空间结构第2课时杂化轨道理论课件新人教版选择性必修2 课件 0 次下载
- 新教材适用2023_2024学年高中化学第2章分子结构与性质第3节分子结构与物质的性质第2课时分子间的作用力分子的手性课件新人教版选择性必修2 课件 0 次下载
- 新教材适用2023_2024学年高中化学第3章晶体结构与性质实验活动简单配合物的形成课件新人教版选择性必修2 课件 0 次下载
- 新教材适用2023_2024学年高中化学第3章晶体结构与性质微专题4关于晶体结构的三个常考点课件新人教版选择性必修2 课件 0 次下载
高中化学人教版 (2019)选择性必修2第三节 分子结构与物质的性质课文配套课件ppt
展开
这是一份高中化学人教版 (2019)选择性必修2第三节 分子结构与物质的性质课文配套课件ppt,共46页。PPT课件主要包含了不重合,不为零,非极性键,等于零,随堂演练·知识落实等内容,欢迎下载使用。
第三节 分子结构与物质的性质
第1课时 共价键的极性
1.能从微观角度理解共价键的极性和分子极性的关系。2.通过键的极性对物质性质的影响的探析,形成“结构决定性质”的认知模型。
一、键的极性和分子的极性
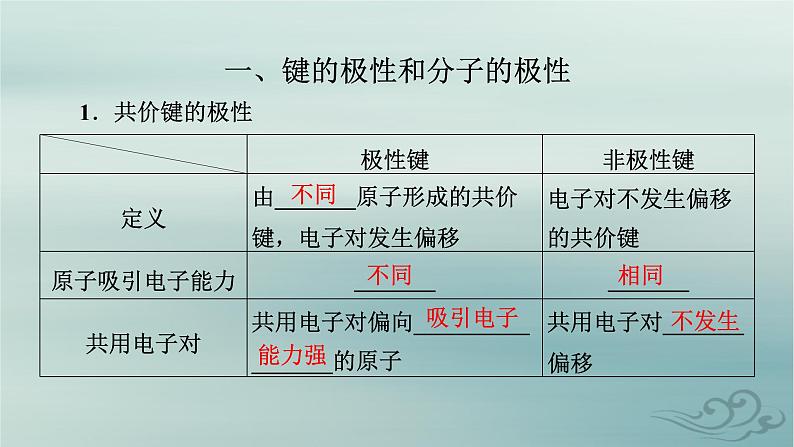
一般:电负性差值<1.7为共价键,且电负性差值越大,键的极性越大。
2.分子的极性(1)极性分子与非极性分子
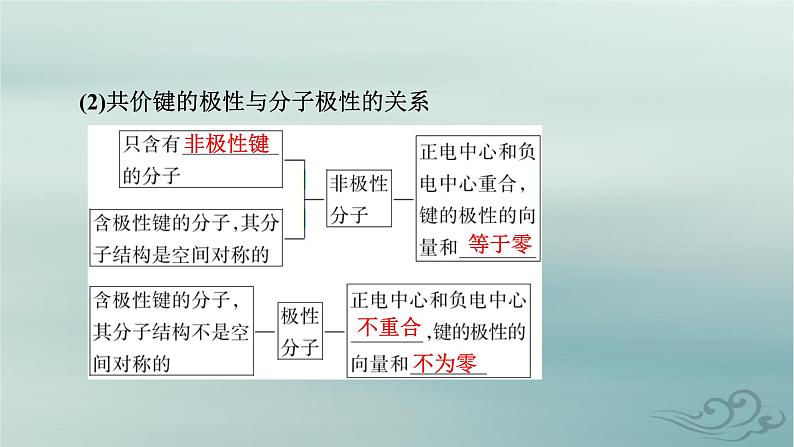
(2)共价键的极性与分子极性的关系
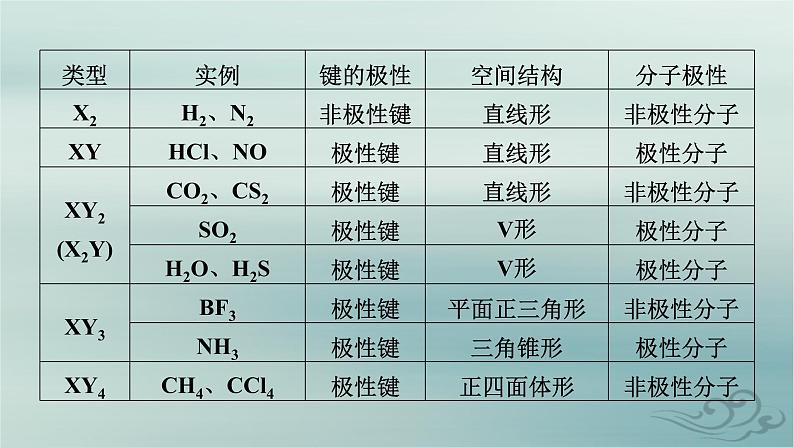
(3)利用化合价法判断ABn型分子中,若中心原子A的化合价的绝对值等于该元素的价电子数,则为非极性分子,否则为极性分子。如下表所示:
1.以非极性键结合的双原子分子一定是非极性分子。( )2.以极性键结合的分子一定是极性分子。( )3.非极性分子只能是双原子单质分子。( )4.非极性分子中,一定含有非极性共价键。( )5.极性分子中不可能含有极性键。( )
1.键的极性与分子极性有何关系?提示:①只含有非极性键的分子一定是非极性分子,如P4。②含极性键的分子,如果分子结构是空间对称的,则为非极性分子,否则为极性分子。③注意:含有非极性键的分子不一定是非极性分子(如H2O2);极性分子中不一定只含有极性键(如CH3CH2OH)。
2.臭氧是极性分子还是非极性分子?从结构上如何理解?提示:O3是极性分子;臭氧分子的空间结构与水分子的相似,由于中心氧原子有1对孤电子对,孤电子对对成键电子对排斥力大,故臭氧分子中的共价键是极性键,中心氧原子呈正电性,端位的两个氧原子呈负电性,故其分子具有微弱的极性。
1.下列各组物质中,属于由极性键构成的极性分子的是( )A.NH3和H2S B.CH4和Br2C.BF3和CO2 D.BeCl2和HCl解析:一般来讲,极性键是指不同的非金属元素原子之间形成的共价键,可以用通式A—B键表示,反之为非极性键,即A—A键;极性分子是指整个分子的正、负电荷的中心不重合,反之为非极性分子,以此进行判断。NH3含有极性键,空间构型为三角锥形,分子中正、负电荷的中心不重合,属于极性键形成的极性分子;H2S为V形,分子中正、
负电荷的中心不重合,且含有极性键,属于极性键形成的极性分子,满足条件,故A正确;CH4含极性键,空间构型为正四面体形,分子中正、负电荷的中心重合,属于极性键形成的非极性分子;Br2含有非极性键,为非极性键形成的非极性分子,不满足条件,故B错误;BF3分子中含有极性键,空间构型为平面三角形,结构对称,正负电荷的中心重合,属于非极性分子;CO2中含有极性键,但结构对称,正负电荷的中心重合,属于非极性分子,故C错误;BeCl2中正、负电荷的中心是重合的,为非极性分子;HCl为极性键形成的极性分子,故D错误。故选A。
2.下列分子既有σ键又有π键,且属于非极性分子的是( )A.C2H4 B.Cl2 C.H2O D.HCl解析:C2H4存在共价双键,含有σ键和π键,分子结构对称,正负电荷中心重合的分子是非极性分子,故A正确;Cl2只含有单键,只有σ键,故B错误;H2O中存在H—O,只有σ键,故C错误;HCl只含有单键,只有σ键,故D错误。故选A。
3.下列有关分子的叙述正确的是( )A.双原子分子AB一定是极性分子B.三原子分子AB2一定是非极性分子C.四原子分子AB3一定是极性分子D.ABn型分子的中心原子最外层满足8电子结构,则ABn一定是非极性分子
解析:双原子分子AB型,原子不同,则共价键一定为极性共价键,构成的分子一定为极性分子,A正确;三原子分子AB2中若正、负电荷的中心不重合,就属于极性分子,如H2O为极性分子,B错误;四原子分子AB3若正、负电荷的中心重合,就属于非极性分子,如BF3,C错误;CH4的中心原子C最外层满足8电子结构,CH4是非极性分子,NH3的中心原子N最外层满足8电子结构,但NH3为极性分子,D错误。故选A。
4.在我国南海300~500 m深的海底存在着大量的“可燃冰”,其主要成分为甲烷水合物。在常温、常压下它会分解成水和甲烷,因而得名。下列关于甲烷和水这两种分子极性的描述正确的是( )A.两种分子都是极性分子B.两种分子都是非极性分子C.CH4是极性分子D.H2O是极性分子,CH4是非极性分子
解析:水是“V”形结构,是极性分子,甲烷是正四面体结构,是非极性分子,故A、B错误;甲烷是正四面体结构,CH4是非极性分子,故C错误;根据前面分析,H2O是极性分子,CH4是非极性分子,故D正确。故选D。
键的极性和分子极性的关系
1.键的极性与反应活性(1)共价键的极性越强,键的活泼性也越强,容易发生断裂,易发生相关的化学反应。(2)成键元素的原子吸引电子能力越强,电负性越大,共价键的极性就越强,在化学反应中该分子的反应活性越强,在化学反应中越容易断裂。
二、键的极性对化学性质的影响
2.键的极性对化学性质的影响键的极性对物质的化学性质有重要影响。例如,羧酸是一大类含羧基(—COOH)的有机酸,羧基可电离出H+而呈酸性。羧酸的酸性可用pKa的大小来衡量,pKa越小,酸性越强。羧酸的酸性大小与其分子的组成和结构有关,如下表所示:不同羧酸的pKa
1.三氟乙酸的酸性大于三氯乙酸酸性的原因。提示:由于氟的电负性大于氯的电负性,F—C的极性大于Cl—C的极性,使F3C—的极性大于Cl3C—的极性,导致三氟乙酸的羧基中的羟基的极性更大,更易电离出氢离子。2.三氯乙酸的酸性大于二氯乙酸酸性的原因。提示:由于Cl3C—比Cl2CH—多一个氯原子,使Cl3C—的极性大于Cl2CH—的极性,导致三氯乙酸的羧基中的羟基的极性更大,更易电离出氢离子。
3.甲酸的酸性大于乙酸酸性的原因。提示:烃基(R—)是推电子基团,烃基越长推电子效应越大,使羧基中的羟基的极性越小,羧酸的酸性越弱。4.CH3CH2OH、H2O分别与钠反应,哪个反应更剧烈?解释原因。提示:水与钠反应更剧烈,是由于C的电负性略大于H的电负性,烷基是推电子基团,使醇分子中的氢氧键的极性小于水分子中的氢氧键的极性。
1.下列羧酸中酸性最弱的是( )A.HCOOH B.CH3COOHC.CH2ClCOOH D.CHCl2COOH解析:烃基是推电子基团,导致羧基中O—H的极性减小,电离氢离子能力减弱,酸性减小,故酸性HCOOH>CH3COOH;Cl的电负性比H大,C—Cl的极性大于C—H,导致羧基中O—H的极性增大,电离氢离子能力增强,酸性增强,C原子数相同时,Cl原子越多,酸性越强,故酸性CHCl2COOH>CH2ClCOOH> CH3COOH,故酸性最弱的是CH3COOH,B符合题意。故选B。
2.数据是科学推理中的重要证据,由下表中的数据,所得推论正确的是( )
A.相同浓度下,乙酸的酸性一定强于氯乙酸B.烃基是吸电子基团,烃基越长,吸电子效应越大,使羧基中的羟基的极性越小,羧酸的酸性越弱C.卤素原子是推电子基团,卤素原子使得羧基中羟基的极性变小,导致二氯乙酸的酸性强于一氯乙酸D.氟原子的电负性大于氯原子,使F3C—的极性大于Cl3C—的极性,使三氟乙酸羧基中羟基的极性增大,导致三氟乙酸容易电离出氢离子
解析:由表可知电离平衡常数Ka(CH3COOH)=10-4.76,Ka(CH2ClCOOH)=10-2.86,电离平衡常数越大电离程度越大,则相同浓度下,氯乙酸的酸性强于乙酸,A错误;烃基为推电子基团,碳原子数越多,推电子能力越强,则酸性越弱,故酸性有:甲酸>乙酸>丙酸,B错误;卤素原子为吸电子基团,卤素元素电负性越大,吸电子能力越强,故酸性:二氯乙酸>一氯乙酸,C错误;电负性越大吸引电子能力越强,F的电负性大于Cl,则F—C极性大于Cl—C的极性,F元素吸引电子能力较大导致F3C—C极性大于Cl3C—C的极性,则三氟乙酸的羧基中的羟基的极性更大,更易电离出氢离子,所以三氟乙酸的酸性较强,D正确。故选D。
3.CH3COOH是一种弱酸,而氯乙酸ClCH2COOH的酸性强于CH3COOH,这是因为—Cl是一种强吸电子基团,能使—OH上的H原子具有更大的活泼性。有的基团属于斥电子基团,能减弱—OH上H原子的活泼性。试依据上述规律填空:(1)HCOOH显酸性,而H2O显中性,这是由于HCOOH分子中存在______(填“吸”或“斥”)电子基团,这种基团是____________。(2)CH3COOH的酸性弱于HCOOH,这是由于CH3COOH分子中存在______(填“吸”或“斥”)电子基团,这种基团是__________。
(3)—C6H5也属于吸电子基团,故C6H5COOH的酸性比CH3COOH的酸性______(填“强”或“弱”)。(4)下列酸中:CF3COOH、CCl3COOH、CHCl2COOH、CH2ClCOOH,酸性最强的是__________________。解析:(1)HCOOH显酸性,H2O呈中性,说明甲酸分子中存在强吸电子基团,能使—OH上的H原子活泼性增强,甲酸中含有醛基,故醛基属于强吸电子基团。(2)CH3COOH酸性弱于HCOOH,说明乙酸分子中存在斥电子基团,能减弱—OH上H原子的活泼性而使该物质的酸性减弱,乙酸中含有—CH3,故—CH3属于斥电子基团,导致乙酸的酸性小
于甲酸。(3)由题给信息可知,—C6H5属于吸电子基团,—CH3属于斥电子基团,故C6H5COOH的酸性比CH3COOH的酸性强。(4)—F、—Cl、—H的吸电子的能力由大到小的顺序为—F>—Cl>—H,故酸性最强的是CF3COOH。
1.键的极性对物质的化学性质有重要影响由于不同的成键原子间电负性的差异,共用电子对会发生偏移,偏移的程度越大,即共价键的极性越强,在反应中越容易断裂。2.羧基的酸性大小与分子组成和结构的关系(1)含卤素原子的一元羧酸的酸性①含相同个数的不同卤素原子的羧酸,卤素原子的电负性数值越大,羧酸的酸性越强。②含不同数目的同种卤素原子的羧酸,卤素原子的数目越多,羧酸的酸性越强。
(2)只含烷基的一元羧酸的酸性随着烷基加长,酸性的差异越来越小。(3)只含烷基的多元羧酸的酸性烷基所含碳原子数越少,羧基个数越多,酸性越强。
1.下列物质中既含有极性键,又含有非极性键的极性分子是( )A.二氧化硫 B.四氯化碳C.过氧化氢 D.乙炔解析:二氧化硫是含有极性键的极性分子,A不符合题意;四氯化碳是含有极性键的非极性分子,B不符合题意;过氧化氢是含有极性键和非极性键的极性分子,C符合题意;乙炔是含有极性键和非极性键的非极性分子,D不符合题意。故选C。
2.下列叙述中正确的是( )A.卤化氢分子中,卤素的非金属性越强,共价键的极性越大,热稳定性也越强B.以极性键结合的分子,一定是极性分子C.判断A2B或AB2型分子是否是极性分子的依据是看分子中是否含有极性键D.非极性分子中,各原子间都应以非极性键结合
解析:卤素中非金属性越强,键的极性越大,热稳定性也越强,A项正确;以极性键结合的双原子分子一定是极性分子,但以极性键结合形成的多原子分子,也可能是非极性分子,如CO2,B项错误;A2B型如H2O、H2S等,AB2型如CO2、CS2等,判断其是否是极性分子的依据是看分子中是否含有极性键及分子的空间结构是否对称。如CO2、CS2为直线形,分子的空间结构对称,为非极性分子;如H2O,有极性键,分子的空间结构不对称,为极性分子,C项错误;多原子分子,其分子的空间结构对称,这样的非极性分子中可能含有极性键,D项错误。
3.使用微波炉加热,具有使受热物质均匀,表里一致、速度快、热效率高等优点,其工作原理是通电炉内的微波场以几亿的高频改变电场的方向,水分子因而能迅速摆动,产生热效应,这是因为( )A.水分子具有极性共价键B.水分子中有共用电子对C.水由氢、氧两元素组成D.水分子是极性分子
解析:水分子空间结构为V形,正负电荷中心不能重合,是极性分子,极性分子在电场中会发生偏转,当电场方向改变时,分子运动方向改变,因此在高频改变方向的电场中水分子会迅速摆动,D符合题意。故选D。
4.已知S2Cl2结构如图所示,下列关于S2Cl2的说法正确的是( )A.S2Cl2是非极性分子B.S2Cl2分子只含非极性键C.沸点:S2Br2>S2Cl2D.S与Cl间的共用电子对偏向于S
解析:S2Cl2是展开书页型结构,Cl—S位于两个书页面内,该物质结构不对称,正负电荷重心不重合,为极性分子,故A错误;S2Cl2分子中S—S为非极性键,S—Cl键为极性键,故B错误;S2Br2与S2Cl2结构相似,相对分子质量S2Br2>S2Cl2,则分子间作用力S2Br2>S2Cl2,故沸点:S2Br2>S2Cl2,故C正确;Cl的电负性强于S,故S与Cl间的共用电子对偏向于Cl,故D错误。故选C。
5.已知N、P同属于元素周期表的第VA族元素。NH3呈三角锥形,N原子位于锥顶,3个H原子位于锥底,N—H间的夹角是107°。(1)N4分子的空间结构为 ,它是一种__________(填“极性”成“非极性”)分子。(2)PH3分子与NH3分子的结构________(填“相似”或“不相似”),P—H为________(填“极性”或“非极性”)键,PH3为________(填“极性”或“非极性”)分子。
(3)NCl3是一种淡黄色油状液体,下列对NCl3的有关描述不正确的是______(填标号)。a.该分子呈平面三角形b.该分子中的化学键为极性键c.该分子为极性分子解析:(1)由图中可知,N4呈正四面体形,结构对称,是一种含有非极性键的非极性分子。(2)NH3与PH3是同主族元素形成的氢化物,结构相似,P—H为不同种元素原子之间形成的共价键,为极性键,PH3的空间结构为三角锥形,正、负电荷重心不重合,为极性分子。
相关课件
这是一份高中第二章 分子结构与性质第一节 共价键课文配套ppt课件,共38页。PPT课件主要包含了第一节共价键,mol,kJ·mol-1,反应物,生成物,正误判断,深度思考,应用体验,kJmol,键长和键角等内容,欢迎下载使用。
这是一份人教版 (2019)选择性必修2第一节 共价键图文课件ppt,共38页。PPT课件主要包含了第一节共价键,第1课时共价键,共用电子对,非金属,未成对电子,自旋状态相反的,电子出现概率最大,正误判断,深度思考,应用体验等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修2第三节 分子结构与物质的性质图文ppt课件,共28页。PPT课件主要包含了情境探究,方法突破,应用体验等内容,欢迎下载使用。










