






- 新教材适用2023_2024学年高中化学第3章晶体结构与性质第1节物质的聚集状态与晶体的常识课件新人教版选择性必修2 课件 0 次下载
- 新教材适用2023_2024学年高中化学第3章晶体结构与性质第2节分子晶体与共价晶体第1课时分子晶体课件新人教版选择性必修2 课件 0 次下载
- 新教材适用2023_2024学年高中化学第3章晶体结构与性质第2节分子晶体与共价晶体第2课时共价晶体课件新人教版选择性必修2 课件 0 次下载
- 新教材适用2023_2024学年高中化学第3章晶体结构与性质第3节金属晶体与离子晶体第1课时金属晶体离子晶体课件新人教版选择性必修2 课件 0 次下载
- 新教材适用2023_2024学年高中化学第3章晶体结构与性质第3节金属晶体与离子晶体第2课时过渡晶体与混合型晶体晶体类型的比较课件新人教版选择性必修2 课件 0 次下载
人教版 (2019)选择性必修2第三章 晶体结构与性质第四节 配合物与超分子备课课件ppt
展开第四节 配合物与超分子
1.能从微观角度理解配位键的形成条件和表示方法,能判断常见的配合物。2.能利用配合物的性质去推测配合物的组成,从而形成“结构决定性质”的认知模型。3.了解超分子的结构特点与性质。
1.概念由一个原子单方面提供_______________,而另一个原子提供____________而形成的化学键,即“电子对给予一接受”键。2.实例在四水合铜离子中,铜离子与水分子之间的化学键是由____________提供孤电子对给予____________,____________接受____________的孤电子对形成的。
3.表示方法配位键可以用A→B来表示,其中A是_________孤电子对的分子或离子,B是_________孤电子对的原子或金属离子。例如:①NH中的配位键表示为__________________ 。
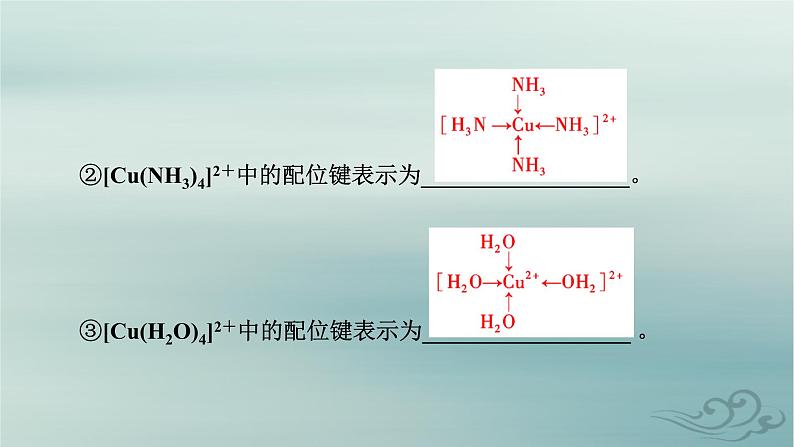
②[Cu(NH3)4]2+中的配位键表示为__________________。③[Cu(H2O)4]2+中的配位键表示为__________________ 。
4.配位键的形成条件(1)成键原子一方能提供孤电子对。如分子有NH3、H2O、HF、CO等;离子有Cl-、OH-、CN-、SCN-等。(2)成键原子另一方能提供空轨道。如H+、Al3+、B及过渡金属的原子或离子。(3)配位键同样具有饱和性和方向性。一般来说,多数过渡金属的原子或离子形成配位键的数目是基本不变的,如Ag+形成2个配位键,Cu2+形成4个配位键等。
1.共价键有饱和性,但NH3为什么仍能与H+结合生成NH呢?提示:NH3有孤电子对,H+有空轨道,NH3中的孤电子对进入H+的空轨道,两者共用形成化学键。2.H2O与H3O+相比,回答下列问题:(1)中心原子的杂化方式是否相同?提示:相同,都为sp3杂化。(2)微粒的空间结构是否相同?提示:不同。H2O呈V形,H3O+呈三角锥形。
(3)微粒中的键角是否相同?若不同,哪一个键角大一些?提示:不同。H3O+中键角大。因为H2O中中心氧原子有2个孤电子对,而H3O+中中心氧原子有1个孤电子对,孤电子对对成键电子对的作用力大。
3.配位键与普通的共价键有什么不同?
1.下列物质:①H3O+ ②[Cu(NH3)4]2+ ③CH3COO- ④NH3 ⑤CH4中存在配位键的是( )A.①② B.①③ C.④⑤ D.②④
2.下列各种说法中错误的是( )A.形成配位键的条件是一方有空轨道,一方有孤电子对B.共价键的形成条件是成键原子必须有未成对电子C.配位化合物中的配体可以是分子也可以是阴离子D.配位键是一种特殊的共价键
解析:微粒间形成配位键的条件是:一方是能够提供孤电子对的原子或离子,另一方是能够接受孤电子对的空轨道的原子或离子,故A正确;形成共价键的成键原子不一定有未成对电子,如配位键中就是一方提供电子对,双方共用,故B错误;配位化合物中,配体可以是H2O、NH3、CO等含有孤电子对的分子,也可以是F-、Cl-、CN-等含有孤电子对的阴离子,故C正确;配位键又称配位共价键,是一方提供孤电子对,一方提供空轨道形成的,是一种特殊的共价键,故D正确。故选B。
3.下列物质中都存在离子键、极性键和配位键的是( )A.过氧化钠、硫酸四氨合铜、氢化钠B.硝酸铵、氢氧化二氨合银、硫酸铵C.硫酸、氮化钙、氢氧化钡D.氯化铵、氢氧化钠、双氧水
解析:Na2O2中存在离子键和非极性键,NaH中只存在离子键,均不存在极性键和配位键,A不符合题意;NH4NO3、[Ag(NH3)2]OH、(NH4)2SO4中均存在离子键、极性键和配位键,B符合题意;H2SO4中不存在离子键,Ca3N2中只存在离子键,Ba(OH)2中不存在配位键,C不符合题意;NaOH中不存在配位键,H2O2中只有共价键,D不符合题意。故选B。
1.概念通常把金属离子或原子(称为中心离子或原子)与某些分子或离子(称为配体或配位体)以____________结合形成的化合物称为配位化合物,简称配合物。如[Cu(NH3)4]SO4、[Ag(NH3)2]OH等均为配合物。2.组成配合物[Cu(NH3)4]SO4的组成如图所示:
(1)中心原子:提供空轨道接受孤电子对的原子。中心原子一般都是带正电荷的阳离子(此时又叫中心离子),最常见的有过渡金属离子:Fe3+、Ag+、Cu2+、Zn2+等。(2)配体:提供孤电子对的阴离子或分子,如Cl-、NH3、H2O等。配体中直接同中心原子配位的原子叫做配位原子。配位原子必须是含有孤电子对的原子,如NH3中的N,H2O中的O等。(3)配位数:直接与中心原子形成的____________的数目。如[Fe(CN)6]4-中Fe2+的配位数为______。
Cu2++2NH3·H2O===
Cu(OH)2+4NH3===
[Cu(NH3)4]2++2OH-、
Ag++Cl-===AgCl↓、AgCl+2NH3===[Ag(NH3)2]++Cl-
4.配合物的形成对性质的影响(1)颜色改变,如Fe(SCN)3的形成。(2)溶解度改变,如AgCl沉淀可溶于氨水得到[Ag(NH3)2]+。5.配合物的应用(1)配合物跟人类生活有密切的关系。例如,在人和动物体内起输送氧气作用的血红素是Fe2+的配合物。(2)配合物在生产和科学技术方面的应用也很广泛,例如,在医药科学、化学催化剂、新型分子材料等领域都有着广泛的应用。
1.配位键实质上是一种特殊的共价键。( )2.提供孤电子对的微粒既可以是分子,也可以是离子。( )3.有配位键的化合物就是配位化合物。( )4.配位化合物都很稳定。( )5.在配合物[C(NH3)5Cl]Cl2中的Cl-均可与AgNO3反应生成AgCl沉淀。( )6.Ni(CO)4是配合物,它是由中心原子与配体构成的。( )
1.回答下列关于配合物[TiCl(H2O)5]Cl2· H2O的问题。(1)[TiCl(H2O)5]Cl2· H2O中提供孤电子对的是什么?提示:Cl-、H2O。(2)[TiCl(H2O)5]Cl2· H2O在溶液中电离出什么离子?提示:[TiCl(H2O)5]2+、Cl-。(3)1 ml [TiCl(H2O)5]Cl2·H2O与足量AgNO3溶液反应,产生沉淀的物质的量是多少?提示:2 ml。
2.(1)人体内血红蛋白是Fe2+卟啉配合物,Fe2+与O2结合形成配合物,而CO与血红蛋白中Fe2+也能形成配合物。根据生活常识,比较说明其配合物的稳定性。提示:血红蛋白中Fe2+与CO形成的配合物更稳定。(2)[Cu(NH3)4]2+与[Cu(H2O)4]2+哪个配位离子更稳定?原因是什么?提示:[Cu(NH3)4]2+更稳定。因为N和O都有孤电子对,但O电负性大,吸引孤电子对的能力强,故NH3提供孤电子对的能力比H2O大。
(3)NH3可与Cu2+形成配合物,但NF3很难与Cu2+形成配合物,原因是什么?提示:电负性:F>H,使得NF3提供孤电子对的能力小于NH3。
1.下列关于配合物的说法中正确的是( )A.化学式[TiCl(H2O)5]Cl2·H2O的配合物中配体是Cl-和H2O,配位数是9B.含有配位键的物质一定是配位化合物C.配合物[Ag(NH3)2]Cl中存在离子键、配位键、极性键和非极性键D.向硫酸铜溶液中滴加过量的氨水,溶液呈深蓝色是因为存在[Cu(NH3)4]2+配离子
解析:该配合物中:中心原子为Ti,配体是氯离子和水,配位数为6,A错误;氯化铵中氮原子和氢原子之间存在一个配位键,但氯化铵不是配位化合物,B错误;配合物中内界和外界之间为离子键,中心原子和配位原子之间为配位键,配体中氮原子和氢原子之间为极性共价键,不存在非极性键,C错误;硫酸铜中加过量氨水形成四氨合铜配离子,为深蓝色,D正确。故选D。
4.配合物Na3[Fe(CN)6]可用于离子检验,下列说法不正确的是( )A.此配合物中存在离子键、配位键、极性键B.配离子为[Fe(CN)6]3-,中心离子为Fe3+,配位原子为NC.1 ml配合物中含有12 ml σ键D.该配合物为离子化合物,易电离,1 ml配合物电离得到阴阳离子共4 ml
解析:Na+与[Fe(CN)6]3-之间存在离子键,CN-与Fe3+之间存在配位键,CN-中碳原子与氮原子之间存在极性键,A项正确;配合物Na3[Fe(CN)6]中,配离子为[Fe(CN)6]3-,中心离子为Fe3+,配位原子为C,B项错误;CN-中碳原子与氮原子之间存在1个σ键,CN-与Fe3+之间的配位键属于σ键,则1 ml配合物Na3[Fe(CN)6]中σ键为(6+6) ml=12 ml,C项正确;该配合物为离子化合物,易电离,其电离方程式为Na3[Fe(CN)6]===3Na++[Fe(CN)6]3-,1 ml该配合物电离得到阴、阳离子共4 ml,D项正确。故选B。
(1)配合物的稳定性配合物具有一定的稳定性。配合物中的配位键越强,配合物越稳定。当作为中心原子(或离子)的金属原子(或离子)相同时,配合物的稳定性与配体的性质有关。(2)配位键的稳定性①电子对给予体形成配位键的能力:NH3>H2O。②接受体形成配位键的能力:H+>过渡金属>主族金属。③配位键越强,配合物越稳定。如稳定性:Cu2+—OH-
2.超分子的两个重要特征是_______________和____________。
3.实例(1)“杯酚”分离C60和C70:将C60和C70的混合物加入一种空腔大小适配C60的“杯酚”中,再加入甲苯溶剂,溶解未装入“杯酚”的C70,过滤后分离C70;再向不溶物中加入氯仿,溶解“杯酚”而将不溶解的C60释放出来并沉淀。(2)冠醚识别碱金属离子:冠醚是皇冠状的分子,有不同大小的空穴,能与正离子,尤其是碱金属离子络合,并随环的大小不同而与不同的金属离子络合,利用此性质可以识别碱金属离子。(3)细胞和细胞器的双分子膜。(4)DNA分子。
1.冠醚与碱金属离子之间的配位键属于离子键、共价键、氢键还是分子间作用力?提示:共价键。2.冠醚与碱金属离子形成配合物得到的晶体里还有什么粒子?这类晶体是离子晶体、共价晶体还是分子晶体?提示:阴离子,离子晶体。
1.下列关于超分子和配合物的叙述不正确的是( )A.细胞和细胞器的双分子膜具有自组装性质B.利用超分子的分子识别特征,可以分离C60和C70C.配位化合物中配位键强度都很大,因而配合物都很稳定D.配离子[Fe(CN)5(NO)]2-的中心离子为Fe3+,配位数为6,配位原子为C和N
解析:细胞和细胞器的双分子膜具有自组装性质,生物体的细胞即是由各种生物分子自组装而成,A正确;C60和C70的分子直径不同,利用超分子的“分子识别”特性可以将C60和C70分离开来,B正确;含有孤电子对和含有空轨道的原子之间形成配位键,配位键属于共价键,有的配合物很稳定,有的很不稳定,C错误;配离子[Fe(CN)5(NO)]2-的中心离子为Fe3+,提供空轨道,NO和CN-与Fe3+形成配位键,配位数为6,C和N有孤对电子,作为配位原子,D正确。故选C。
2.利用超分子可分离C60和C70。将C60、C70混合物加入一种空腔大小适配C60的杯酚中进行分离的流程如图所示。下列说法错误的是( )A.该流程体现了超分子具有“分子识别”的特征B.杯酚分子中存在大π键C.杯酚与C60形成氢键D.C60与金刚石晶体类型不同
解析:利用杯酚分离C60和C70体现了超分子具有“分子识别”的特征,A项正确;杯酚分子中含有苯环结构,存在大π键,B项正确;杯酚与C60形成的不是氢键,C项错误;金刚石是共价晶体,C60为分子晶体,二者晶体类型不同,D项正确。故选C。
解析:该配合物的配体是水分子和溴离子,故A错误;该配合物的中心微粒是Cr3+,中心微粒在形成配位键时提供空轨道,故B正确;配合物溶于水,只能电离出外界离子,1 ml该配合物与足量AgNO3溶液反应可生成1 ml AgBr沉淀,故C错误;该配合物中心离子的配体是水分子和溴离子,配位数为6,故D错误。故选B。
2.某超分子的结构如图所示。下列说法不正确的是( )
3.+3价C的八面体配合物CClm·nNH3,中心原子的配位数为6,若1 ml配合物与AgNO3作用生成1 ml AgCl沉淀,则m和n的值是( )A.m=1、n=5 B.m=3、n=3C.m=3、n=4 D.m=3、n=5解析:+3价C的八面体配合物CClm·nNH3,根据电荷守恒,m=3;中心原子的配位数为6,若1 ml配合物与AgNO3作用生成1 ml AgCl沉淀,说明外界有1个氯离子,则配体为2个氯离子、4个NH3,n=4,故选C。
4.“杯酚”(图b)分离C60和C70的过程(图a)示意如下:
5.人们熟知的化学主要是研究以共价键相结合的分子的合成、结构、性质和变换规律。有的学者所倡导的超分子化学已成为今后化学发展的另一个全新的领域。超分子通常是指由两种或两种以上的分子通过分子间相互作用结合在一起,组成复杂的、有组织的聚集体,并保持一定的完整性使其具有明确的微观结构和宏观特性。目前已报道的超分子大环主体有冠醚、环糊精、杯芳烃、杯吡咯、杯咔唑、瓜环葫芦脲、柱芳烃等。
(1)若冠醚与碱金属离子之间的作用为配位键,则该配位键属于_________(填字母,下同)。A.离子键 B.共价键C.氢键 D.分子间作用力(2)冠醚与碱金属离子形成配合物得到的晶体里还有的粒子种类是_______________,这类晶体是____________晶体。
高中化学人教版 (2019)选择性必修2第四节 配合物与超分子评课ppt课件: 这是一份高中化学人教版 (2019)选择性必修2第四节 配合物与超分子评课ppt课件,共41页。PPT课件主要包含了目录索引等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修2第四节 配合物与超分子作业ppt课件: 这是一份高中化学人教版 (2019)选择性必修2第四节 配合物与超分子作业ppt课件,共38页。
高中化学人教版 (2019)选择性必修2第四节 配合物与超分子教学ppt课件: 这是一份高中化学人教版 (2019)选择性必修2第四节 配合物与超分子教学ppt课件,共46页。PPT课件主要包含了课前·新知导学,四水合铜离子,孤电子对,配位键,分子或离子,配合物,配合物的形成实验,蓝色沉淀,深蓝色晶体,Fe2+等内容,欢迎下载使用。













