



所属成套资源:【名校真题】各省名校高一上学期期中化学试题
【期中真题】江苏省南京市六校联合2021-2022学年高一上学期期中调研考试化学试题.zip
展开这是一份【期中真题】江苏省南京市六校联合2021-2022学年高一上学期期中调研考试化学试题.zip,文件包含期中真题江苏省南京市六校联合2021-2022学年高一上学期期中调研考试化学试题原卷版docx、期中真题江苏省南京市六校联合2021-2022学年高一上学期期中调研考试化学试题解析版docx等2份试卷配套教学资源,其中试卷共24页, 欢迎下载使用。
2021~2022学年第一学期高一期中六校联合调研试题
高一化学
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 Cl 35.5 Ca 40 Mn 55
第一部分(共60分)
一、单项选择题(共60分,每小题3分)
1. 2022年的冬奥会由北京和张家口市联合举办,鉴于目前全球新冠肺炎疫情防控形势依旧严峻复杂,最重要的工作是防疫。在生活中以下物质不能用于杀菌消毒的是
A. 纯碱 B. “84消毒液” C. 75%酒精 D. 漂白粉
【答案】A
【解析】
【详解】A.纯碱是Na2CO3,不能用于杀菌消毒,A项选;
B.“84消毒液”中含有NaClO,NaClO具有氧化性,可以用于杀菌消毒,B项不选;
C.75%酒精可以破坏组成病毒的蛋白质,使病毒失活,可以用于杀菌消毒,C项不选;
D.漂白粉中的主要成分为Ca(ClO)2,Ca(ClO)2具有氧化性,可以用于杀菌消毒,D项不选;
答案选A。
2. 下列叙述正确的是
A. 向FeCl3溶液中加入蒸馏水,加热至有红褐色物质生成,停止加热制备Fe(OH)3胶体
B. 氧化还原反应中有一种反应物为氧化剂,必然有另一种反应物作为还原剂
C. 胶体区别于其他分散系的本质是有丁达尔效应
D. 金刚石和石墨是同素异形体,它们的充分燃烧产物均为CO2
【答案】D
【解析】
【详解】A.制备Fe(OH)3胶体的方法为在沸水中逐滴加入饱和FeCl3溶液,继续加热至有红褐色物质生成,A错误;
B.氧化剂与还原剂可为同种物质,B错误;
C.胶体区别于其他分散系的本质是粒子直径大小,1-100nm为胶体,C错误;
D.金刚石和石墨是同素异形体,组成元素为C,它们的充分燃烧产物均为CO2,D正确;
答案选D。
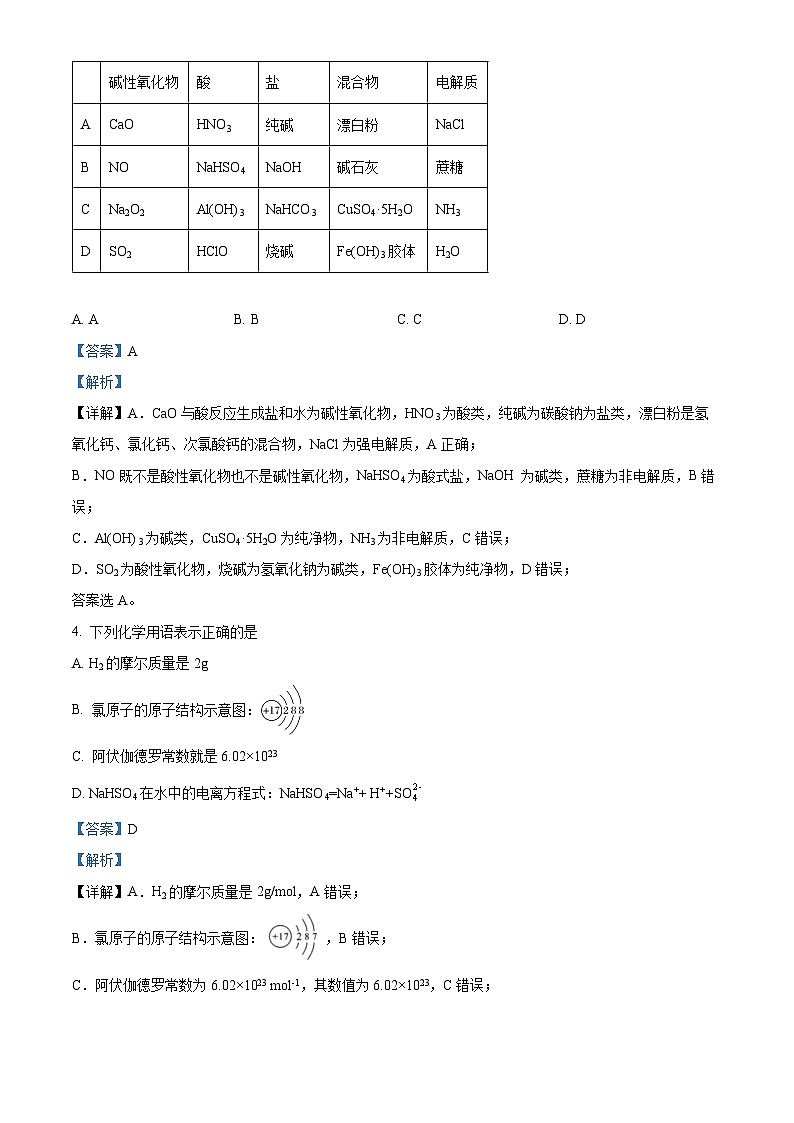
3. 下列关于物质的分类中,正确的是
碱性氧化物
酸
盐
混合物
电解质
A
CaO
HNO3
纯碱
漂白粉
NaCl
B
NO
NaHSO4
NaOH
碱石灰
蔗糖
C
Na2O2
Al(OH)3
NaHCO3
CuSO4·5H2O
NH3
D
SO2
HClO
烧碱
Fe(OH)3胶体
H2O
A. A B. B C. C D. D
【答案】A
【解析】
【详解】A.CaO与酸反应生成盐和水为碱性氧化物,HNO3为酸类,纯碱为碳酸钠为盐类,漂白粉是氢氧化钙、氯化钙、次氯酸钙的混合物,NaCl为强电解质,A正确;
B.NO既不是酸性氧化物也不是碱性氧化物,NaHSO4为酸式盐,NaOH 为碱类,蔗糖为非电解质,B错误;
C.Al(OH)3为碱类,CuSO4·5H2O为纯净物,NH3为非电解质,C错误;
D.SO2为酸性氧化物,烧碱为氢氧化钠为碱类,Fe(OH)3胶体为纯净物,D错误;
答案选A。
4. 下列化学用语表示正确的是
A. H2的摩尔质量是2g
B. 氯原子的原子结构示意图:
C. 阿伏伽德罗常数就是6.02×1023
D. NaHSO4在水中的电离方程式:NaHSO4=Na++ H++SO
【答案】D
【解析】
【详解】A.H2的摩尔质量是2g/mol,A错误;
B.氯原子的原子结构示意图:,B错误;
C.阿伏伽德罗常数为6.02×1023 mol-1,其数值为6.02×1023,C错误;
D.NaHSO4在水中完全电离为钠离子、氢离子、硫酸根离子,电离方程式:NaHSO4=Na++ H++SO,D正确;
答案选D。
5. 下列电离方程式书写正确的是
A. KClO3=K++Cl-+3O2- B. Fe(NO3)3=Fe2++3NO
C. NH4NO3=NH+NO D. NaHCO3=Na++H++ CO
【答案】C
【解析】
【详解】A.氯酸钾电离方程式为KClO3=K++ClO,A错误;
B.硝酸铁中Fe为+3价,电离方程式为Fe(NO3)3=Fe3++3NO,B错误;
C.硝酸铵为强电解质,完全电离,电离出铵根和硝酸根,C正确;
D.碳酸氢根不完全电离,所以碳酸氢钠的电离方程式为NaHCO3=Na++HCO,D错误;
综上所述答案为C。
6. 下列各组离子在指定溶液中一定能大量共存的
A. 强碱性溶液:Na+、Mg2+、NO、SO
B. 无色溶液:K+、H+、SO、MnO
C. 含大量SO的澄清溶液:Mg2+、Cu2+、Cl-、NO
D. 在氯水中:K+、Cl-、Fe2+、CO
【答案】C
【解析】
【详解】A.强碱性溶液中存在大量OH-,Mg2+、OH-之间反应生成难溶物氢氧化镁,不能大量共存,A不符合题意;
B.MnO为紫色,不满足无色的要求,B不符合题意;
C.Mg2+、Cu2+、Cl-、NO之间不反应,都不与SO反应,能够大量共存,C符合题意;
D. Fe2+与CO要反应,不能大量共存,D不符合题意;
答案为C。
7. 下列有关物质的性质与用途具有对应关系的是
A. Na2O2能与CO2反应生成O2,因此可用来做供氧剂
B. NaHCO3能与碱反应,可用作食品疏松剂
C. 苏打易溶于水,可用于去除油污
D. Cl2具有强氧化性,氯水可用作自来水消毒
【答案】A
【解析】
【详解】A.Na2O2与二氧化碳反应生成氧气,则用作防毒面具和潜水艇中作为氧气来源,A正确;
B.NaHCO3用作糕点的膨松剂,是利用碳酸氢钠不稳定受热分解生成二氧化碳,B错误;
C.苏打为碳酸钠,其水溶液呈碱性,油脂在碱性溶液中反应生成可溶物,所以可用于去除油污与其易溶于水无关,C错误;
D.Cl2具有强氧化性,溶于水生成次氯酸,次氯酸具有强氧化性可用作自来水消毒,D错误;
答案选A。
8. 在给定条件下,下列选项所示的物质间转化均能实现的是
A. NaNa2O2
B. NaClO(aq)HClO(aq)
C. 饱和食盐水NaHCO3
D. FeFeCl2
【答案】B
【解析】
【详解】A.NaNa2O,在点燃条件下生成过氧化钠,A错误;
B.NaClO(aq)HClO(aq)可以实现,次氯酸的酸性小于碳酸,B正确;
C.盐酸的酸性大于碳酸,二氧化碳不能和氯化钠水溶液反应生成碳酸氢钠,C错误;
D.FeFeCl3,不能生成氯化亚铁,D错误;
答案选B。
9. 下列离子方程式正确的是
A. 氯气与水反应:Cl2+H2O=2H++ Cl-+ClO-
B. 饱和碳酸钠溶液中加入足量二氧化碳:CO+CO2+H2O+2Na+= 2NaHCO3↓
C. 单质钠与水反应:2Na+H2O=2Na++ OH-+H2↑
D. 氢氧化钡溶液与硫酸铜溶液:Ba2++ SO=BaSO4↓
【答案】B
【解析】
【详解】A.氯气与水反应生成HCl和HClO,HClO为弱酸,不能拆成离子,A错误;
B.由于碳酸氢钠的溶解度小于碳酸钠,饱和碳酸钠溶液中加入足量二氧化碳析出碳酸氢钠,离子方程式为CO+CO2+H2O+2Na+= 2NaHCO3↓,B正确;
C.选项所给方程式电荷不守恒,正确为2Na+2H2O=2Na++ 2OH-+H2↑,C错误;
D.氢氧化钡和硫酸铜反应还生成氢氧化铜沉淀,离子方程式为Cu2++2OH-+Ba2++ SO=BaSO4↓+ Cu(OH)2↓,D错误;
综上所述答案为B。
10. 下列变化过程中,必须加入还原剂才能实现的是
A. KClO3→KCl B. MnO2→Mn2+
C. CaO→CaCO3 D. Cl-→Cl2
【答案】B
【解析】
【详解】A.KClO3→KCl中,Cl元素化合价降低,发生还原反应,但KClO3在MnO2催化下可以分解生成KCl和O2,不加入还原剂也能实现,A不符合题意;
B.MnO2→Mn2+中,Mn元素的化合价降低,MnO2作氧化剂,必须加入还原剂才能实现,B符合题意;
C.CaO→CaCO3中,各元素化合价均为改变,该反应不是氧化还原反应,不需要加入氧化剂或还原剂,C不符合题意;
D.Cl-→Cl2中,Cl元素化合价升高,Cl-作还原剂,需要加入氧化剂才能实现,D不符合题意;
答案选B。
11. 下列说法正确的是
A. 除去NaHCO3溶液中的少量Na2CO3溶液,可以用通入足量CO2
B. Na2O和Na2O2都能和水反应生成碱,都是碱性氧化物
C. Na在空气中燃烧,发生黄色火焰,生成白色固体
D. 可以通过加入Ba(OH)2或Ca(OH)2溶液鉴别Na2CO3溶液和NaHCO3溶液
【答案】A
【解析】
【详解】A.CO2可以和Na2CO3在水溶液中反应生成NaHCO3,A正确;
B.Na2O2与水反应时还会生成氧气,发生氧化还原反应,不是碱性氧化物,B错误;
C.Na在空气中燃烧,生成淡黄色固体过氧化钠,C错误;
D.Na2CO3、NaHCO3均能和Ba(OH)2或Ca(OH)2溶液生成沉淀,无法鉴别,D错误;
综上所述答案为A。
12. 某兴趣小组的同学向一定体积的 Ba(OH)2溶液中逐滴加入稀硫酸,并测得混合溶液的导电能力随时间变化的曲线如图所示。下列说法中错误的是
A. a时刻 Ba(OH)2溶液与稀硫酸恰好完全中和
B. a时刻溶液的导电能力约为0,说明溶液中几乎没有自由移动的离子
C. AB段溶液的导电能力不断减弱说明生成的 BaSO4不是电解质
D. BC段溶液的导电能力不断增大主要是由于过量的H2SO4电离出的离子导电
【答案】C
【解析】
【分析】溶液导电性与离子浓度成正比,向一定体积的Ba(OH)2中逐滴加入稀硫酸溶液至过量,AB段发生的离子反应方程式为Ba2++2OH-+2H++SO=BaSO4↓+2H2O,导致溶液中离子浓度减小,B点酸碱恰好完全反应生成硫酸钡和水,BC段溶液的导电能力不断增大,主要是由于过量的硫酸电离出的离子导电。
【详解】A.a时刻溶液导电能力为0,说明溶液中几乎没有自由移动的离子,即硫酸与氢氧化钡恰好反应,A正确;
B.溶液导电能力与离子浓度成正比,a时刻溶液的导电能力约为0,说明溶液中几乎没有自由移动的离子,B正确;
C.AB段二者发生反应Ba2++2OH-+2H++SO=BaSO4↓+2H2O,BaSO4难溶于水,导致溶液中离子浓度减小,导电能力减弱,但BaSO4是强电解质,C错误;
D.BC段硫酸过量,BC段溶液的导电能力不断增大,主要是由于过量的硫酸电离出的离子导电,D正确;
故答案选C。
13. 已知氯酸钠(NaClO3)与盐酸反应的化学方程式:NaClO3+6HCl=NaCl+3Cl2↑+3H2O。下列说法正确的是
A. 该反应生成6.72L的Cl2,转移电子的物质的量为0.5mol
B. NaClO3被还原,发生还原反应
C. 还原性:Cl2>HCl
D. 氧化剂:还原剂=1:6
【答案】B
【解析】
【详解】A.未注明温度和压强,无法确定6.72L氯气的物质的量,A错误;
B.NaClO3中Cl元素化合价降低,得电子被还原,发生还原反应,B正确;
C.还原剂的还原性大于还原产物,HCl为还原剂,Cl2为还原产物,所以还原性HCl>Cl2,C错误;
D.NaClO3为氧化剂,部分HCl化合价升高为还原剂,根据化合价的变化可知氧化剂:还原剂=1:5,D错误;
综上所述答案B。
14. 设NA为阿伏伽德罗常数的值。下列说法正确的是
①标准状态下,11.2L以任意比例混合的氮气和氧气所含原子数为NA
②2摩尔氯含有2NA个氯分子
③同温同压下,O2和Cl2的密度之比为32:71
④常温下,7.8g固体Na2O2中,含有阴阳离子总数为0.4NA
⑤1molFe与足量Cl2充分反应,转移的电子数3 NA
A. ①②③④⑤ B. ①③⑤ C. ②③⑤ D. ①③④
【答案】B
【解析】
【详解】①标况下11.2L氧气和氮气的混合物的物质的量为0.5mol,氧气和氮气均为双原子分子,所以11.2L以任意比例混合的氮气和氧气所含原子数为NA,①正确;
②2摩尔氯指代不明,若为2摩尔氯原子,则为NA个氯分子,②错误;
③同温同压下,气体的密度之比等于摩尔质量之比,O2和Cl2的密度之比为32:71,③正确;
④7.8g固体Na2O2的物质的量为0.1mol,过氧化钠由钠离子和过氧根构成,所以含有阴阳离子总数为0.3NA,④错误;
⑤1molFe与足量Cl2充分反应,Fe全部转化为Fe3+,转移的电子数3NA,⑤正确;
综上所述答案为B。
15. 同温同压下,等体积的和相比较,下列叙述不正确的是
A. 质量比为11:8 B. 密度比为11:8 C. 物质的量比为8:11 D. 分子个数比为1:1
【答案】C
【解析】
【分析】依据阿伏加德罗定律:同温同压下,等体积任何气体具有相同的分子数,具有相同物质的量,所以温同压下,等体积的和相比较,分子数相同,物质的量相同。
【详解】A.依据可知二者质量之比为44:32=11:8,故A正确;
B.相同条件下气体密度之比等于摩尔质量之比等于44:32=11:8,故B正确;
C.同温同压下,等体积的和相比较,物质的量相同,故C错误;
D.同温同压下,等体积的和相比较,分子数相同,故D正确;
故选C。
16. 下列实验目的、现象与结论匹配的是
实验目的
实验操作与现象
A
测定84消毒液的pH
用洁净玻璃棒蘸取少量84消毒液滴在pH试纸上
B
证明NaCl样品中含有钾盐
做焰色试验,通过蓝色钴玻璃观察到紫色火焰
C
除去CO2,提纯CO
将含有少量CO2的CO气体缓缓通过足量的过氧化钠粉末,淡黄色粉末变为白色
D
验证某苏打样品中含有NaCl
取少量样品于试管中,加水溶解,再加入足量稀盐酸,最后滴加AgNO3溶液,有白色沉淀生成
A. A B. B C. C D. D
【答案】B
【解析】
【详解】A.“84”消毒液具有漂白性,可使pH试纸褪色,故不能用pH试纸测定其pH,A错误;
B.蓝色钴玻璃能滤去黄光,不能滤去紫光,故做焰色试验,通过蓝色钴玻璃观察到紫色火焰,故B正确;
C.CO2与过氧化钠反应生成氧气,CO中引入新杂质,不能除杂,故C错误;
D.盐酸含有Cl-,也能使AgNO3溶液反应,生成白色沉淀,不能验证苏打样品含NaCl,故D错误;
答案选B。
17. 同温同压下,在两个容积相同的容器中,一个盛有C2H4气体,另一个盛有N2和CO的混合气体。两容器内的气体一定具有相同的( )
①分子数②密度③质量④质子数⑤原子数⑥电子数
A. ①④⑥ B. ①②⑤ C. ③④⑥ D. ①②③
【答案】D
【解析】
【详解】①在同温同压下,相同体积的任何气体含有相同的分子数,C2H4与N2和CO的总分子数目相同,故①正确;
②N2和CO的相对分子质量都是28,故混合气体平均相对分子质量为28,C2H4的相对分子质量为28,同温同压下,气体密度之比等于相对分子质量之比,故两容器内气体的密度相等,故②正确;
③CO、N2和C2H4的摩尔质量都是28g/mol,C2H4物质的量与N2和CO的总物质的量相等时,质量一定相等,故③正确;
④CO分子中质子数为14,N2分子中质子数为14,C2H4分子中质子数为16,故C2H4分子数目与N2和CO的总分子数相等时,质子数一定不相等,故④错误;
⑤CO、N2是双原子分子、C2H4是6原子分子,C2H4分子数目与N2和CO的总分子数相等时,原子数一定不相等,故⑤错误;
⑥CO分子中电子数为14,N2分子中电子数为14,C2H4分子中电子数为16,故C2H4分子数目与N2和CO的总分子数相等时,电子数一定不相等,故⑥错误;
故答案选D。
18. Cl2O是黄棕色具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水且会与水反应生成次氯酸,与有机物、还原剂接触或加热时会发生燃烧并爆炸。制取Cl2O的装置如图所示。
已知:Cl2O的熔点为-116℃,沸点为3.8℃,Cl2的沸点为-34.6℃;HgO+2Cl2=HgCl2+Cl2O
下列说法不正确的是
A. 装置②、③中盛装的试剂依次是饱和食盐水和浓硫酸
B. 通入干燥空气的目的是将生成的Cl2O稀释减少爆炸危险
C. 从装置⑤中逸出气体主要成分是Cl2O
D. 装置④与⑤之间不用橡皮管连接,是为了防止橡皮管燃烧和爆炸
【答案】C
【解析】
【分析】本实验的目的是先制得干燥、纯净的氯气,再与HgO反应制取Cl2O,最后利用液化法实现Cl2O与Cl2的分离。
【详解】A.利用KMnO4与浓盐酸反应制得的氯气中混有HCl气体和水蒸气,装置②用饱和食盐水吸收HCl,装置③用浓硫酸吸收水蒸气,从而制得干燥、纯净的氯气,A正确;
B.通入干燥的空气,一方面可将装置内的Cl2O不断排出,另一方面可起稀释作用,降低Cl2O的浓度,减少爆炸危险,B正确;
C.Cl2O的沸点为3.8℃,Cl2的沸点为-34.6℃,用液氨降温,可将Cl2O液化,则从装置⑤中逸出气体的主要成分是Cl2,C不正确;
D.题干信息显示,Cl2O与有机物接触会发生燃烧并爆炸,所以装置④与⑤之间不用橡皮管连接,D正确;
故选C。
19. 固体化合物X由3种元素组成。某学习小组进行了如下实验:
下列推断不正确的是( )
A. 由现象1得出化合物X含有O元素
B. X的化学式Na2CuO2
C. 固体混合物Y的成分是Cu和NaOH
D. 若X与浓盐酸反应产生黄绿色气体,则反应中X作氧化剂
【答案】B
【解析】
【分析】固体X经H2还原后得到的混合气体能使白色CuSO4变为蓝色,则说明产物中有水蒸气,即化合物X中含有O元素;最终所得固体单质呈紫红色,则该单质为Cu,说明化合物X含有Cu元素,且m(Cu)=1.28g,则2.38g X中含有Cu 0.02mol;最终所得碱性溶液的焰色反应为黄色,则说明化合物X中含有Na,该碱性溶液为NaOH,且n(NaOH)=n(HCl)=0.02mol;经H2还原后,所得固体混合物Y的成分是Cu和NaOH;综上所述,2.38g化合物X含1.28g Cu、0.02mol Na和O元素,则m(O)=2.38g-1.28g-0.02mol×23g/mol=0.64g,则n(O)=0.04mol,即2.38g化合物X含0.02mol Cu、0.02mol Na、0.04mol O,故化合物X的化学式为NaCuO2。
【详解】A、现象1为混合气体能使白色CuSO4变为蓝色,说明经H2还原的产物中有水蒸气,从而得出化合物X含有O元素,A正确;
B、经分析,2.38g化合物X含0.02mol Cu、0.02mol Na、0.04mol O,故化合物X的化学式为NaCuO2,B错误;
C、固体Y加水得紫红色的该单质为Cu,碱性溶液为NaOH溶液,故固体混合物Y的成分是Cu和NaOH,C正确;
D、若X与浓盐酸反应产生黄绿色气体Cl2,则浓盐酸做还原剂,X作氧化剂,D正确;
故选B。
20. 硝酸厂烟气中含有大量氮氧化物(NOx)。常温下,将烟气与H2的混合气体通入Ce(SO4)2与Ce2(SO4)3的混合溶液中可实现无害化处理,其转化过程如图所示。下列说法正确的是
A. 反应Ⅰ的离子方程式为Ce4++H2=Ce3++2H+
B. 反应Ⅱ中氧化产物与还原产物的物质的量之比为2∶1
C. 该转化过程的实质是NO被H2氧化
D. 反应过程中混合溶液内Ce3+和Ce4+离子总数一定保持不变
【答案】D
【解析】
【分析】根据进出图可知,Ce4+把H2氧化为H+,自身被还原为Ce3+,然后Ce3+在酸性条件下再被NO氧化为Ce4+,NO被还原为N2,同时还生成水,据此解答。
【详解】A.过程Ⅰ发生的反应为Ce4+把H2氧化为H+,自身被还原为Ce3+,反应的离子方程式为:2Ce4++H2=2Ce3++2H+,故A错误;
B.过程Ⅱ为2NO+4Ce3++4H+=N2+4Ce4++2H2O,氧化产物为Ce4+,还原产物为N2,两者之比为4∶1,故B错误;
C.该转化过程的实质为NO被H2还原为N2,H2被氧化为水,故C错误;
D.处理过程中,Ce3+和Ce4+做催化剂,催化剂在反应前后,质量不变,数量不变,故D正确;
故选D。
第二部分(共40分)
21. 回答下列问题:
(1)以下物质:①KClO3晶体 ②醋酸 ③氨水 ④熔融NaCl ⑤蔗糖 ⑥液氯 ⑦SO2;现状态下能导电的是_______(填序号,下同);属于电解质的是_______;属于非电解质的是 _______。
(2)加热13.7 g碳酸钠和碳酸氢钠固体混合物,使碳酸氢钠完全分解,混合物质量减少3.1 g,则原混合物中碳酸钠的质量为 _______。
(3)某溶液中只含有Na+、Al3+、Cl-、SO四种离子,已知前三种离子的个数比为3:1:2,则溶液中Al3+和SO的离子个数比为_______。
(4)ClO2是一种杀菌消毒效率高、二次污染小的水处理剂。ClO2实验室制法是:2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O,该反应中氧化剂的化学式是_______,被氧化的元素是 _______(填元素符号)。
(5)配平:_______。
_______KI+_______HNO3——_______KNO3+_______NO↑+_______I2+_______H2O
【答案】(1) ①. ③④ ②. ①②④ ③. ⑤⑦
(2)5.3g (3)1:2
(4) ①. KClO3 ②. C
(5)6KI+8HNO3 =6KNO3+2NO↑+3I2+4H2O
【解析】
【小问1详解】
现状态下有自由移动的阴阳离子则能导电:③④;属于电解质的是①②④;属于非电解质的是⑤⑦;
【小问2详解】
加热13.7 g碳酸钠和碳酸氢钠的固体混合物,使碳酸氢钠完全分解,混合物质量减少3.1 g,减少的质量为CO2和水的质量,二者物质的量为1:1, 总物质的量为:=0.05mol,2NaHCO3Na2CO3+H2O+CO2↑,碳酸氢钠的物质的量为0.1mol,其质量为:8.4g,则原混合物中碳酸钠的质量为13.7g-8.4g=5.3g;
【小问3详解】
某溶液中只含有Na+、Al3+、Cl-、SO四种离子,已知前三种离子的个数比为3:1:2,根据电荷守恒可得 3×(+1)+1×(+3)+ 2×(-1)+x×(-2)=0,SO=2,则溶液中Al3+和SO的离子个数比为:1:2;
【小问4详解】
ClO2实验室制法是:2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O,Cl元素化合价降低,该反应中氧化剂的化学式是KClO3;C元素化合价升高被氧化;
【小问5详解】
根据电子转移,I由-1价升高到0价,N由+5降低到+2,最小公倍数为6,再根据元素守恒配平:6KI+8HNO3 =6KNO3+2NO↑+3I2+4H2O。
22. I.现有一定量含有Na2O杂质的Na2O2试样,用如图所示的实验装置测定Na2O2试样的纯度(通过CO2与样品反应后生成O2的量测定Na2O2的含量。可供选用的反应物:CaCO3固体、盐酸、硫酸溶液和蒸馏水)。回答下列问题:
(1)装置A中液体试剂应选用_______。
(2)装置B的作用是_______;装置E中碱石灰的作用是_______。
(3)装置D中发生反应的化学方程式是_______。
II.现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下:
(4)操作Ⅰ的名称_______,写出反应Ⅰ的化学方程式_______。
(5)写出反应Ⅱ的化学方程式:_______。
(6)制得的纯碱中含有少量NaCl
①设计实验方案检验NaCl的存在_______。
②取8.2g纯碱样品加入足量稀硫酸,得到标准状况下1680 mL(全部逸出)。求样品中纯碱的质量分数_______写出计算过程(计算结果保留两位小数)。
【答案】(1)盐酸 (2) ①. 除去CO2中的HCl ②. 除去未反应的CO2
(3)2Na2O2+2CO2=2Na2CO3+O2
(4) ①. 过滤 ②.
(5)2NaHCO3Na2CO3+CO2↑+H2O
(6) ①. 取少量样品于试管中,加入过量硝酸后再加入AgNO3溶液,产生沉淀 ②.
【解析】
【小问1详解】
装置A制备二氧化碳,实验室用石灰石和稀盐酸反应制取二氧化碳,所以液体试剂应选用稀盐酸;
【小问2详解】
A中生成的二氧化碳含有杂质氯化氢,装置B的作用是除去CO2中的HCl;碱石灰能吸收二氧化碳气体,为准确测量生成氧气的体积,装置E中碱石灰的作用是除去未反应的CO2;
【小问3详解】
装置D中过氧化钠和二氧化碳反应生成碳酸钠和氧气,发生反应的化学方程式是2Na2O2+2CO2=2Na2CO3+O2;
【小问4详解】
操作Ⅰ是碳酸氢钠固体和母液分离,方法为过滤,反应Ⅰ是氯化钠、氨气、水反应生成碳酸氢钠沉淀和氯化铵,反应的化学方程式是;
【小问5详解】
反应Ⅱ是碳酸氢钠在加热条件下分解为碳酸钠、二氧化碳、水,反应的化学方程式是2NaHCO3Na2CO3+CO2↑+H2O;
【小问6详解】
①检验碳酸钠中是否含有氯化钠,先加硝酸除去碳酸根离子,再加硝酸银,有沉淀生成,说明含有氯化钠。
②设8.2g纯碱样品中含碳酸钠的质量为xg;标准状况下1680 mL的物质的量是;
x=
样品中纯碱的质量分数。
23. 某化学兴趣小组在实验室制取漂白粉,并探究氯气与石灰乳反应的条件和产物。已知:氯气和碱的反应为放热反应。温度较高时,氯气和碱还能发生如下反应:3Cl2+6OH-5Cl-+ClO3-+3H2O。该兴趣小组设计了下列实验装置,进行实验。
请回答下列问题:
(1)装置甲和丁中发生反应的离子方程式分别是_______、_______。
(2)该兴趣小组用过量浓盐酸与8.7 g MnO2制备氯气,并将所得氯气与过量的石灰乳反应,则理论上最多可制得Ca(ClO)2_______g。
(3)为了探究反应条件对产物的影响,他们另取一定量的石灰乳,缓慢、匀速地通入足量氯气,得出了ClO-、ClO两种离子的物质的量(n)与反应时间(t)的关系曲线,粗略表示为图2(不考虑氯气和水的反应)。
①图中曲线I表示_______离子的物质的量随反应时间变化的关系。
②所取石灰乳中含有Ca(OH)2的物质的量为_______mol。
(4)实验结束后小组成员发现,产物中Ca(ClO)2的质量明显小于理论值。为了提高Ca(ClO)2的产率,可对丙装置作适当改进。你给出的措施是_______。
【答案】(1) ①. MnO2+4H++2Cl-Mn2++Cl2↑+2H2O ②. Cl2+2OH-=Cl-+ClO-+H2O
(2)7.15 (3) ①. ClO- ②. 0.25
(4)将丙装置浸在盛有冷水(或冰水)的水槽中
【解析】
【分析】甲中为浓盐酸和二氧化锰反应制取氯气,反应过程中会发出氯化氢气体,所以通过饱和食盐水的作用是除去Cl2中混有的HCl气体;在丙中发生的反应为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;丁中氢氧化钠溶液可吸收多余的氯气,据此分析解题。
【小问1详解】
甲中浓盐酸和二氧化锰反应制取氯气的方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O; 丁中氢氧化钠溶液可吸收多余的氯气生成氯化钠、次氯酸钠、水,离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;
【小问2详解】
足量浓盐酸与8.7g MnO2制备氯气,并将所得氯气与过量的石灰乳反应,则理论上最多可制得Ca(ClO)2;可以依据反应MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O;2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,得到定量关系:8.7g MnO2物质的量为0.1mol;2MnO2~Ca(ClO)2所以理论上最多可制得Ca(ClO)2 的物质的量为0.05mol,质量=0.05mol×143g/mol=7.15g;
小问3详解】
①当温度低时,氯气和氢氧化钙反应生成氯化钙和次氯酸钙;当温度高时,生成氯酸钙和氯化钙,刚开始反应时,温度较低,氯气和氢氧化钙反应生成氯化钙和次氯酸钙,所以图2中曲线I表示离子ClO-的物质的量随反应时间变化的关系;
②根据氧化还原反应中得失电子数相等计算Cl-的物质的量,设被还原的氯离子的物质的量为n,则n×1=0.10mol×1+0.05mol×5=0.35mol,含氯离子的物质的量为:0.35mol+0.1mol+0.05mol=0.5mol,氯化钙、次氯酸钙、氯酸钙中钙离子和含氯离子的个数比为1:2,所以所取石灰乳中含有Ca(OH)2的物质的量为0.25mol;
【小问4详解】
由于反应在高温度下发生副反应,所以改进措施可以把丙装置放入冰水中,避免发生3Cl2+6OH- 5Cl-+ClO+3H2O。
相关试卷
这是一份【期中真题】江苏省南京市2022-2023学年高二上学期期中调研化学试题.zip,文件包含期中真题江苏省南京市2022-2023学年高二上学期期中调研化学试题原卷版docx、期中真题江苏省南京市2022-2023学年高二上学期期中调研化学试题解析版docx等2份试卷配套教学资源,其中试卷共23页, 欢迎下载使用。
这是一份【期中真题】黑龙江省八校2022届高三上学期期中联合考试化学试题.zip,文件包含期中真题黑龙江省八校2022届高三上学期期中联合考试化学试题原卷版docx、期中真题黑龙江省八校2022届高三上学期期中联合考试化学试题解析版docx等2份试卷配套教学资源,其中试卷共27页, 欢迎下载使用。
这是一份【期中真题】江苏省南京市六校联合体2022-2023学年高三上学期11月联考化学试题.zip,文件包含期中真题江苏省南京市六校联合体2022-2023学年高三上学期11月联考化学试题原卷版docx、期中真题江苏省南京市六校联合体2022-2023学年高三上学期11月联考化学试题解析版docx等2份试卷配套教学资源,其中试卷共27页, 欢迎下载使用。












