

所属成套资源:新教材适用2023_2024学年高中化学新人教版选择性必修1提能作业(28份)
- 新教材适用2023_2024学年高中化学第3章水溶液中的离子反应与平衡第4节沉淀溶解平衡第2课时盐类的水解提能作业新人教版选择性必修1 试卷 0 次下载
- 新教材适用2023_2024学年高中化学第4章化学反应与电能学业质量标准检测新人教版选择性必修1 试卷 0 次下载
- 新教材适用2023_2024学年高中化学第4章化学反应与电能第1节原电池第2课时化学电源提能作业新人教版选择性必修1 试卷 0 次下载
- 新教材适用2023_2024学年高中化学第4章化学反应与电能第2节电解池第1课时电解原理提能作业新人教版选择性必修1 试卷 0 次下载
- 新教材适用2023_2024学年高中化学第4章化学反应与电能第2节电解池第2课时电解原理的应用提能作业新人教版选择性必修1 试卷 0 次下载
高中化学人教版 (2019)选择性必修1第一节 原电池第1课时综合训练题
展开
这是一份高中化学人教版 (2019)选择性必修1第一节 原电池第1课时综合训练题,共5页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
A 级·基础达标练
一、选择题
1.某化学兴趣小组利用反应Zn+2FeCl3===ZnCl2+2FeCl2,设计了如图所示的原电池装置,下列说法正确的是( D )
A.Zn为负极,发生还原反应
B.b电极反应式为2Fe3++2e-===2Fe2+
C.电子流动方向是a电极→FeCl3溶液→b电极
D.电池的正极材料可以选用石墨、铂电极,也可以用铜
解析:Zn为负极,发生氧化反应,A项错;因Cl-向负极移动,b是负极,a是正极,Fe3+在a极上发生还原反应,2Fe3++2e-===2Fe2+,B项错误;电子由负极沿导线流向正极,电子不能通过电解质溶液,C项错误;正极材料本身不参与反应,可以选石墨、铂电极,也可选比锌活泼性差的铜,D项正确。
2.有关如图所示原电池的叙述,正确的是(盐桥中装有含琼胶的KCl饱和溶液)( C )
A.铜片上发生氧化反应
B.取出盐桥后,电流计依然发生偏转
C.反应中,盐桥中的K+会移向CuSO4溶液
D.反应前后铜片质量不改变
解析:Cu为正极,发生还原反应,A项错误;取出盐桥后,原电池断路,电流计指针不偏转,B项错误;原电池工作时,阳离子向正极移动,阴离子向负极移动,盐桥中K+会向CuSO4溶液移动,C项正确;Cu极上的反应为Cu2++2e-===Cu,正极上析出铜,使铜片质量增加,D项错误。
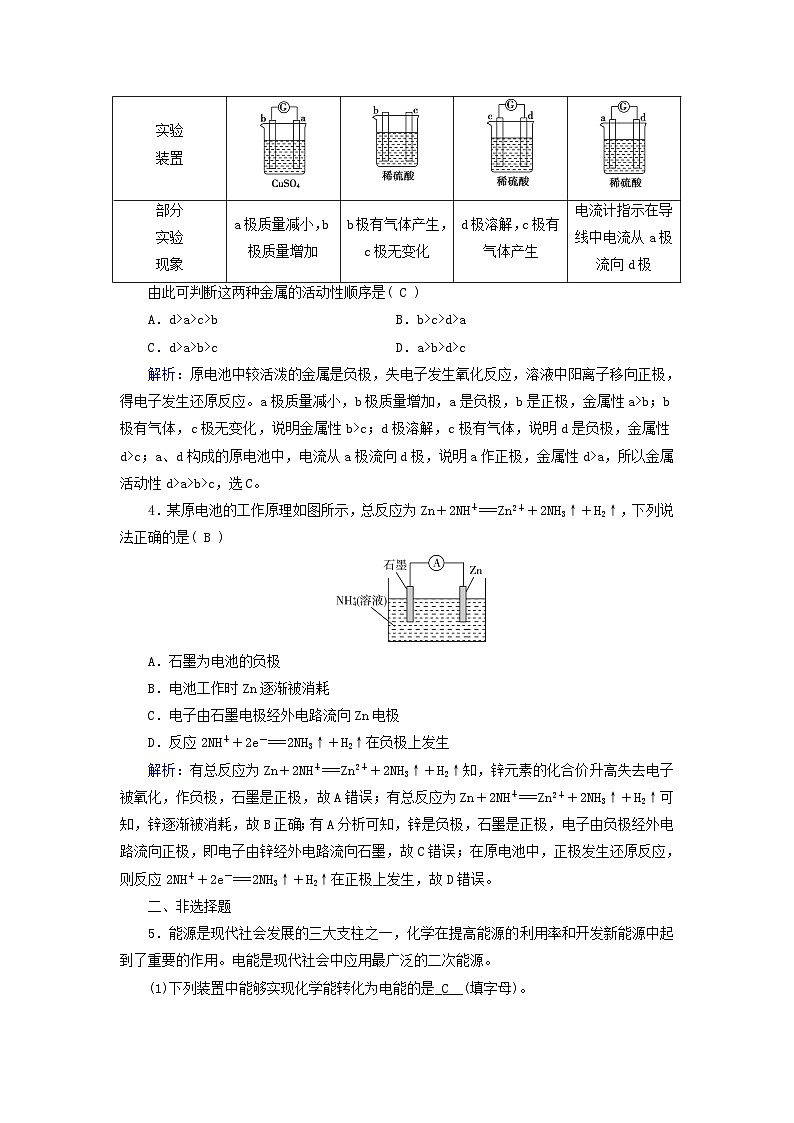
3.有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
由此可判断这两种金属的活动性顺序是( C )
A.d>a>c>b B.b>c>d>a
C.d>a>b>c D.a>b>d>c
解析:原电池中较活泼的金属是负极,失电子发生氧化反应,溶液中阳离子移向正极,得电子发生还原反应。a极质量减小,b极质量增加,a是负极,b是正极,金属性a>b;b极有气体,c极无变化,说明金属性b>c;d极溶解,c极有气体,说明d是负极,金属性d>c;a、d构成的原电池中,电流从a极流向d极,说明a作正极,金属性d>a,所以金属活动性d>a>b>c,选C。
4.某原电池的工作原理如图所示,总反应为Zn+2NHeq \\al(+,4)===Zn2++2NH3↑+H2↑,下列说法正确的是( B )
A.石墨为电池的负极
B.电池工作时Zn逐渐被消耗
C.电子由石墨电极经外电路流向Zn电极
D.反应2NHeq \\al(+,4)+2e-===2NH3↑+H2↑在负极上发生
解析:有总反应为Zn+2NHeq \\al(+,4)===Zn2++2NH3↑+H2↑知,锌元素的化合价升高失去电子被氧化,作负极,石墨是正极,故A错误;有总反应为Zn+2NHeq \\al(+,4)===Zn2++2NH3↑+H2↑可知,锌逐渐被消耗,故B正确;有A分析可知,锌是负极,石墨是正极,电子由负极经外电路流向正极,即电子由锌经外电路流向石墨,故C错误;在原电池中,正极发生还原反应,则反应2NHeq \\al(+,4)+2e-===2NH3↑+H2↑在正极上发生,故D错误。
二、非选择题
5.能源是现代社会发展的三大支柱之一,化学在提高能源的利用率和开发新能源中起到了重要的作用。电能是现代社会中应用最广泛的二次能源。
(1)下列装置中能够实现化学能转化为电能的是_C__(填字母)。
(2)写出该装置正极反应的电极反应式 2H++2e-===H2↑ 。
(3)该装置中溶液里的阴离子移向_Zn__(填电极的化学式)极。
(4)若装置中转移了0.2 ml电子,则理论上溶液增加的质量是_6.3_g__。
解析:(1)原电池的构成条件:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发地进行氧化还原反应,C装置符合构成原电池的条件,故C正确。
(2)C装置中Ag作正极,正极上氢离子得电子生成氢气,其电极反应式为2H++2e-===H2↑。
(3)阴离子移向负极锌。
(4)装置中转移了0.2 ml电子,根据总反应:Zn+2H+===Zn2++H2↑,则理论上溶液质量增重0.1×65 g-0.1×2 g=6.3 g。
6. (1)控制适合的条件,将反应2Fe3++2I-2Fe2++I2设计成如图所示的原电池。
请回答下列问题:
①反应开始时,乙中石墨电极上发生_氧化__(填“氧化”或“还原”)反应,电极反应式为 2I--2e-===I2 。
甲中石墨电极上发生_还原__(填“氧化”或“还原”)反应,电极反应式为 2Fe3++2e-===2Fe2+ 。
②电流表读数为0时,反应达到平衡状态,此时在甲中加入FeCl2固体,则乙中的石墨作_正__(填“正”或“负”)极,该电极的电极反应式为 I2+2e-===2I- 。
(2)利用反应2Cu+O2+2H2SO4===2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为 O2+4e-+4H+===2H2O 。
解析:(1)根据反应2Fe3++2I-===2Fe2++I2,原电池的电极反应:负极2I--2e-===I2,发生氧化反应;正极2Fe3++2e-===2Fe2+,发生还原反应。①反应开始时,乙中石墨电极上发生氧化反应;②当电流表读数为0时反应已平衡,此时,在甲中加入FeCl2固体,反应2Fe3++2I-2Fe2++I2向左移动。因此,右侧石墨作正极,电极反应式为I2+2e-===2I-;左侧石墨作负极,电极反应式为2Fe2+-2e-===2Fe3+。
(2)Cu作负极,O2在正极上得电子:O2+4e-+4H+===2H2O。
7.反应Fe+H2SO4===FeSO4+H2,请回答下列问题。
(1)若要使该反应的反应速率加快,下列措施可行的是_C__(填字母)。
A.将铁粉改为铁片
B.加入少量醋酸钠固体
C.滴加少量CuSO4
D.将稀硫酸改为98%的浓硫酸
(2)若将上述反应设计成原电池,石墨棒为原电池某一极材料,则石墨棒为极_正__(填“正”或“负”)。石墨棒上产生的现象为_有气泡产生__,该极上发生的电极反应为 2H++2e-===H2↑ ,原电池工作时溶液中的SOeq \\al(2-,4)移向_负__(填“正”或“负”)极,若反应产生3.36 L气体(已换算成标况下),则理论上消耗铁的质量是_8.4__g。
(3)实验后同学们经过充分讨论,认为符合某些要求的化学反应都可以设计成原电池。下列化学反应在理论上可以设计成原电池的是_D__。
A.AgNO3+HCl===AgCl+HNO3
B.NaOH+HCl===NaCl+H2O
C.C(s)+H2O(g)===CO(g)+H2(g)
D.Pb+PbO2+2H2SO4===2PbSO4+2H2O
在所选反应中选择其中某个反应设计成原电池,该电池负极反应为: Pb-2e-+SOeq \\al(2-,4)===PbSO4 。
解析:(1)将铁粉改为铁片则减小铁与硫酸的接触面积,故反应速率减慢,A不合题意;加入少量醋酸钠固体则有反应CH3COO-+H+CH3COOH,将导致溶液中H+离子浓度减小,故反应速率减慢,B不合题意;滴加少量CuSO4由于反应Fe+CuSO4===FeSO4+Cu,在置换出铜附在铁上可形成微小的原电池,故反应速率加快,C符合题意;常温下浓硫酸将铁钝化,在铁表面形成致密的氧化物保护膜,阻止反应继续进行,故将稀硫酸改为98%的浓硫酸,将使反应速率减慢,D不合题意。
(2)若将上述反应设计成原电池,则铁电极上发生的电极反应式为:Fe-2e-===Fe2+,发生氧化反应,作负极,故石墨棒为原电池某一极材料,则石墨棒为正,发生的电极反应式为:2H++2e-===H2↑,石墨棒上产生的现象为有大量的无色气泡产生,原电池工作时阳离子移向正极,阴离子移向负极,故溶液中的SOeq \\al(2-,4)移向负极,根据总反应方程式可知,若反应产生3.36 L气体(已换算成标况下),则理论上消耗铁的质量是eq \f(3.36 L,22.4 L·ml-1)×56 g·ml-1=8.4 g。
(3)由于原电池中是电子的定向移动形成电流的,故理论上任何一个自发进行的氧化还原反应均可以设计成原电池,据此分析解题:
AgNO3+HCl===AgCl+HNO3反应中各元素的化合价没有发生变化,不是氧化还原反应,A不合题意;NaOH+HCl===NaCl+H2O反应中各元素的化合价没有发生变化,不是氧化还原反应,B不合题意;C(s)+H2O(g)===CO(g)+H2(g)反应中虽然C和H元素的化合价发生了变化,但是该反应不能自发进行,故不能设计成原电池,C不合题意;Pb+PbO2+2H2SO4===2PbSO4+2H2O反应中Pb的化合价发生改变,且能够自发进行,可以设计成原电池,D符合题意;Pb+PbO2+2H2SO4===2PbSO4+2H2O反应中Pb转化PbSO4,化合价升高,发生氧化反应,故该电池负极反应为:Pb-2e-+SOeq \\al(2-,4)===PbSO4。
B 级·能力提升练
一、选择题
1.下列装置不可以组成原电池的是( C )
解析:C中的装置没有形成闭合回路。
2.下列关于实验现象的描述不正确的是( C )
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.把镁条和铝条紧靠在一起浸入氢氧化钠溶液中,镁条表面出现气泡
C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有稀盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率增大
解析:选项A形成原电池,铜片作正极,表面出现氢气泡;选项B也形成原电池,但在强碱性溶液中,铝可以反应,镁不能,铝失去电子作负极,镁作正极,表面出现氢气泡;C选项铜片把三价铁离子还原为亚铁离子,不能置换出金属铁;D选项锌能置换出铜,锌、铜形成无数微小原电池,增大气泡放出速率。
3.某锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( C )
A.铜电极上发生氧化反应
B.电池工作一段时间后,甲池的c(SOeq \\al(2-,4))减小
C.电池工作一段时间后,乙池溶液的总质量增加
D.阴、阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
解析:Cu作正极,电极上发生还原反应,A项错误;电池工作过程中,SOeq \\al(2-,4)不参加电极反应,故甲池的c(SOeq \\al(2-,4))基本不变,B项错误;电池工作时,甲池反应为Zn-2e-===Zn2+,乙池反应为Cu2++2e-===Cu,甲池中Zn2+会通过阳离子交换膜进入乙池,以维持溶液中电荷平衡,由电极反应式可知,乙池中每有64 g Cu析出,则进入乙池的Zn2+为65 g,溶液总质量略有增加,C项正确;由题干信息可知,阴离子不能通过阳离子交换膜,D项错误。
4.图甲和图乙均是双液原电池装置。下列说法不正确的是( C )
A.甲中电池总反应的离子方程式为Cd(s)+C2+(aq)===C(s)+Cd2+(aq)
B.反应2Ag(s)+Cd2+(aq)===Cd(s)+2Ag+(aq)不能发生
C.盐桥的作用是形成闭合回路,并传导电子
D.乙中有1 ml电子通过外电路时,正极有108 g Ag析出
解析:由甲可知,Cd的活动性强于C,由乙可知,C的活动性强于Ag,即Cd的活动性强于Ag,故Ag不能置换出Cd,B项错误;电子不能通过盐桥,C项错误。
5.将如图所示实验装置的K闭合(已知:盐桥中装有琼脂凝,内含KCl),下列判断正确的是( A )
A.Cu电极上发生还原反应
B.电子沿Zn→a→b→Cu路径移动
C.片刻后甲池中c(SOeq \\al(2-,4))增大
D.片刻后可观察到滤纸b处变红色
解析:该原电池中Zn作负极,Cu作正极,正极上发生得电子的还原反应,A正确;电子沿Zn→a,b→Cu路径流动,电子不进入电解质溶液,B错误;原电池中阴离子向负极移动,即盐桥中的Cl-移向甲烧杯,所以片刻后甲池中c(Cl-)增大,c(SOeq \\al(2-,4))不变,C错误;滤纸b电极是电解池的阳极,溶液中OH-放电,使得b处c(H)+增大,故滤纸b处不会变色,而a处是电解池的阴极,溶液中H+放电,使得a处c(OH-)增大,故变红的是滤纸a处,D错误。
二、非选择题
6.某研究性学习小组根据反应2KMnO4+10FeSO4+8H2SO4===2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如图原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1 ml·L-1,溶液的体积均为200 mL,盐桥中装有饱和K2SO4溶液。
回答下列问题:
(1)此原电池的负极是石墨_b__(填“a”或“b”),电池工作时,盐桥中的SOeq \\al(2-,4)移向_乙__(填“甲”或“乙”)烧杯。
(2)正极反应式为: MnOeq \\al(-,4)+8H++5e-===Mn2++4H2O 。
(3)若不考虑溶液的体积变化,MnSO4浓度变为1.5 ml·L-1,则反应中转移的电子为_0.5__ ml。
解析:(1)由总反应方程式可知,石墨b是原电池的负极,硫酸亚铁在负极失去电子发生氧化反应生成硫酸铁,电池工作时,阴离子硫酸根离子向负极移动,即向乙烧杯移动。
(2)由总反应方程式可知,石墨a是正极,酸性条件下,高锰酸根离子在正极得到电子发生还原反应生成锰离子,电极反应式为MnOeq \\al(-,4)+5e-+8H+===Mn2++4H2O。
(3)由电极反应式可知,生成1 ml锰离子,反应转移5 ml电子,则溶液的体积未变,溶液中的MnSO4浓度由1 ml·L-1变为1.5 ml·L-1时,转移电子的物质的量为(1.5 ml·L-1-1 ml·L-1)×0.2 L×5=0.5 ml。
7.某研究性学习小组欲探究原电池的形成条件,按图所示装置进行实验并得到下表实验结果:
分析上述实验,回答下列问题:
(1)实验2中电流由_B__(填“A”或“B”,下同)极流向_A__极。
(2)实验6中电子由B极流向A极,表明负极是_铝__(填“镁”或“铝”)电极。
(3)实验5表明_B__。
A.铜在潮湿空气中不会被腐蚀
B.铜的腐蚀是自发进行的
(4)分析上表有关信息,下列说法不正确的是_A__。
A.相对活泼的金属一定作负极
B.失去电子的电极是负极
C.烧杯中的液体必须是电解质溶液
D.原电池中,浸入同一电解质溶液中的两个电极,是活泼性不同的两种金属(或其中一种是导电的非金属)
解析:(1)原电池中,电流由正极流向负极,实验2中,Cu为正极,Zn为负极。
(2)电子由负极流向正极,实验6中电子由B极流向A极,表明负极是Al。
(3)实验5说明铜的腐蚀是自发进行的。
(4)判断原电池负极时,不能简单地比较金属的活动性,要看反应的具体情况,如Al在强碱溶液中比Mg更易失电子,形成原电池时,Al作负极,Mg作正极,故A错误。实验
装置
部分
实验
现象
a极质量减小,b极质量增加
b极有气体产生,c极无变化
d极溶解,c极有气体产生
电流计指示在导线中电流从a极流向d极
实验
序号
A
B
烧杯中
的液体
灵敏电流计指
针有无偏转
1
Zn
Zn
乙醇
无
2
Zn
Cu
稀硫酸
有
3
Zn
Zn
稀硫酸
无
4
Zn
Cu
苯
无
5
Cu
C
氯化钠溶液
有
6
Mg
Al
氢氧化钠溶液
有
相关试卷
这是一份高中化学人教版 (2019)选择性必修1第二节 电解池第1课时测试题,共5页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
这是一份人教版 (2019)选择性必修1第一节 原电池第2课时习题,共5页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
这是一份人教版 (2019)选择性必修1第一节 原电池第一课时课时练习,共11页。试卷主要包含了 有关电化学知识的描述正确的是, 某原电池装置如图所示, 图甲和图乙均是双液原电池装置等内容,欢迎下载使用。









