
2024届高三化学一轮复习课件:模型认知——电化学中的“多池”与“多室”
展开
这是一份2024届高三化学一轮复习课件:模型认知——电化学中的“多池”与“多室”,共3页。
探究点1 多池串联电化学装置及分析
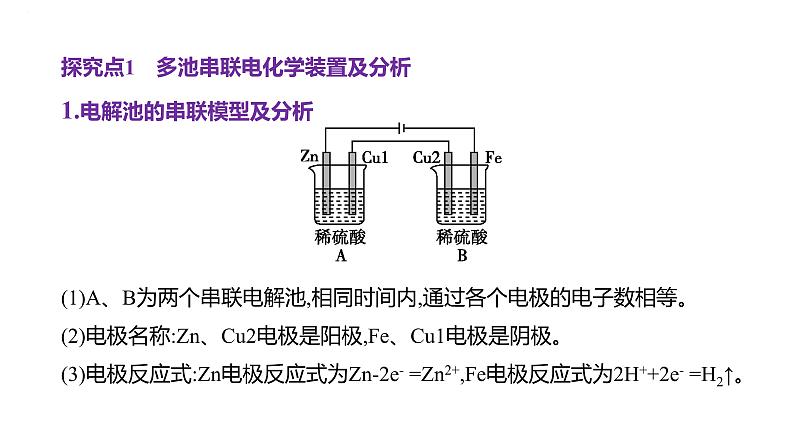
1.电解池的串联模型及分析(1)A、B为两个串联电解池,相同时间内,通过各个电极的电子数相等。(2)电极名称:Zn、Cu2电极是阳极,Fe、Cu1电极是阴极。(3)电极反应式:Zn电极反应式为Zn-2e- =Zn2+,Fe电极反应式为2H++2e- =H2↑。
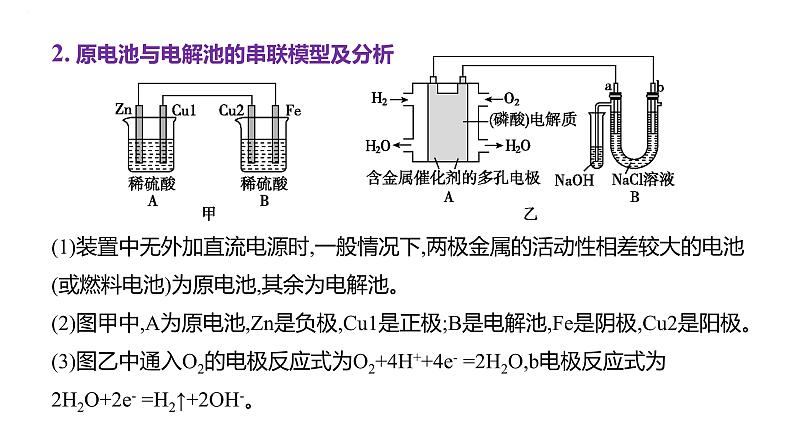
2. 原电池与电解池的串联模型及分析(1)装置中无外加直流电源时,一般情况下,两极金属的活动性相差较大的电池(或燃料电池)为原电池,其余为电解池。(2)图甲中,A为原电池,Zn是负极,Cu1是正极;B是电解池,Fe是阴极,Cu2是阳极。(3)图乙中通入O2的电极反应式为O2+4H++4e- =2H2O,b电极反应式为2H2O+2e- =H2↑+2OH-。
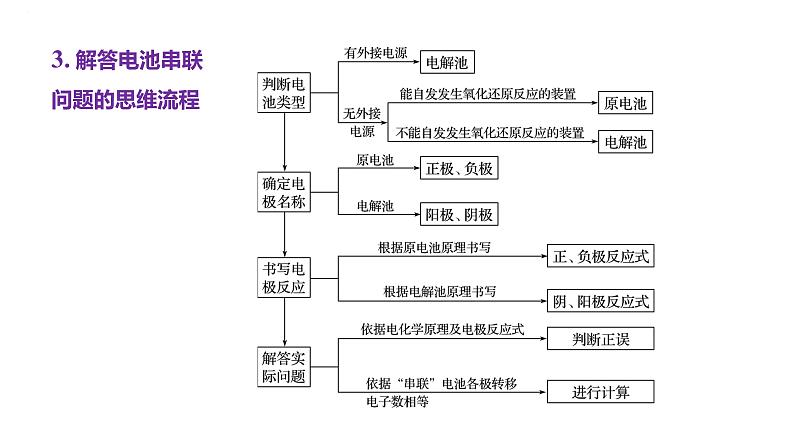
3. 解答电池串联问题的思维流程
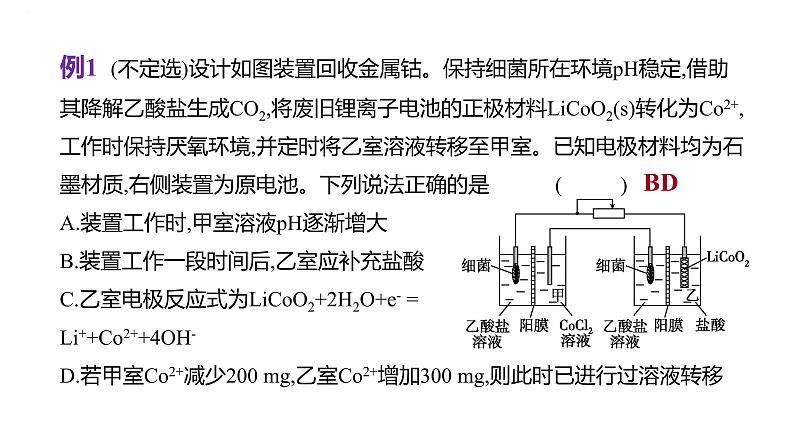
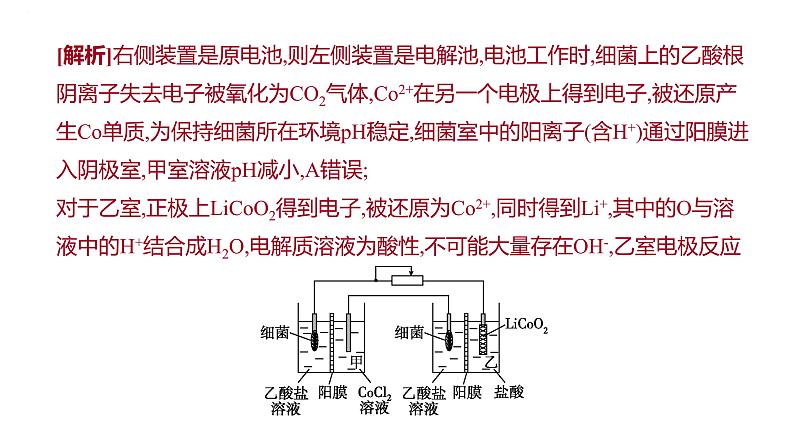
例1 (不定选)设计如图装置回收金属钴。保持细菌所在环境pH稳定,借助其降解乙酸盐生成CO2,将废旧锂离子电池的正极材料LiCO2(s)转化为C2+,工作时保持厌氧环境,并定时将乙室溶液转移至甲室。已知电极材料均为石墨材质,右侧装置为原电池。下列说法正确的是( )A.装置工作时,甲室溶液pH逐渐增大B.装置工作一段时间后,乙室应补充盐酸C.乙室电极反应式为LiCO2+2H2O+e- =Li++C2++4OH-D.若甲室C2+减少200 mg,乙室C2+增加300 mg,则此时已进行过溶液转移
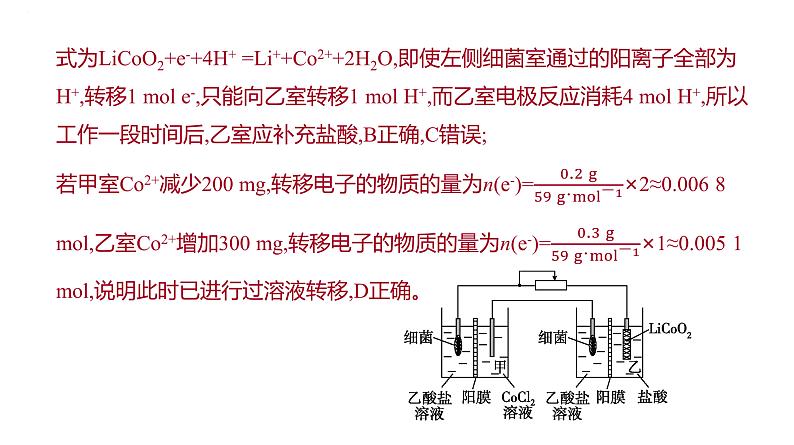
[解析]右侧装置是原电池,则左侧装置是电解池,电池工作时,细菌上的乙酸根阴离子失去电子被氧化为CO2气体,C2+在另一个电极上得到电子,被还原产生C单质,为保持细菌所在环境pH稳定,细菌室中的阳离子(含H+)通过阳膜进入阴极室,甲室溶液pH减小,A错误;对于乙室,正极上LiCO2得到电子,被还原为C2+,同时得到Li+,其中的O与溶液中的H+结合成H2O,电解质溶液为酸性,不可能大量存在OH-,乙室电极反应
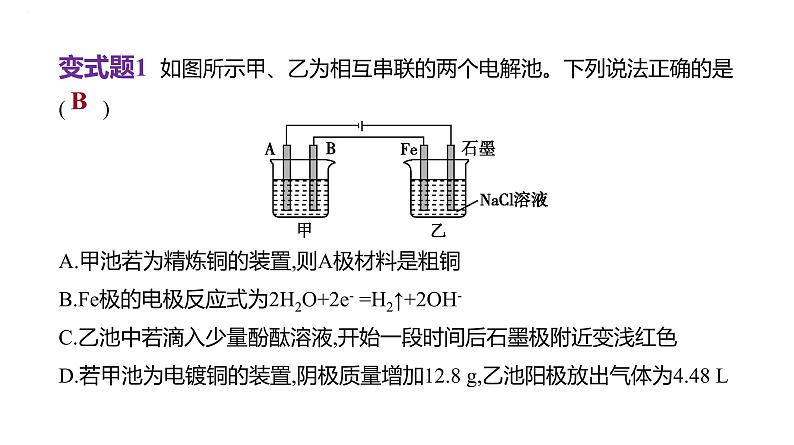
变式题1 如图所示甲、乙为相互串联的两个电解池。下列说法正确的是 ( )A.甲池若为精炼铜的装置,则A极材料是粗铜B.Fe极的电极反应式为2H2O+2e- =H2↑+2OH-C.乙池中若滴入少量酚酞溶液,开始一段时间后石墨极附近变浅红色D.若甲池为电镀铜的装置,阴极质量增加12.8 g,乙池阳极放出气体为4.48 L
[解析] 甲池中A为阴极、B为阳极,甲池若为精炼铜的装置,粗铜为电解池的阳极,则B极材料是粗铜,A错误;乙池中铁为阴极,石墨为阳极,水在阴极得到电子发生还原反应生成氢气和氢氧根离子,电极反应式为2H2O+2e- =H2↑+2OH-,B正确;乙池中铁为阴极,石墨为阳极,水在阴极得到电子发生还原反应生成氢气和氢氧根离子,氯离子在阳极失去电子发生氧化反应生成氯气,则乙池中若滴入少量酚酞溶液,开始一段时间后铁极附近变浅红色,C错误;缺标准状况下,无法计算甲池阴极质量增加12.8 g时,乙池阳极放出氯气的体积,D错误。
变式题2 某研究小组将两个甲烷燃料电池串联后作为电源,进行电解饱和食盐水,如图所示。有关说法正确的是 ( )A.燃料电池工作时,通入甲烷电极的电极反应式为CH4+2H2O-8e- =CO2+8H+B.闭合开关K后,b电极上有Cl2生成C.若每个电池甲烷通入量为1 L(标准状况),且反应完全,理论上最多能产生氯气的体积为8 L(标准状况)D.电解饱和食盐水总反应的离子方程式为2Cl-+2H2O 2OH-+H2↑+Cl2↑
探究点2 “多室”电化学装置及分析
1.离子交换膜的分类与作用
2.含膜电化学装置的思路分析
例2 乙醛酸是一种重要的化工中间体,可采用如图所示的电化学装置合成。图中的双极膜中间层中的H2O解离为H+和OH-,并在直流电场作用下分别向两极迁移。下列说法正确的是( )A.KBr在上述电化学合成过程中只起电解质的作用B.阳极上的反应式为 2H++2e- →C.制得2 ml乙醛酸,理论上外电路中迁移了1 ml电子D.双极膜中间层中的H+在外电场作用下向铅电极方向迁移
[解析]该装置通电时,乙二酸被还原为乙醛酸,因此铅电极为电解池阴极,石墨电极为电解池阳极,阳极上Br-被氧化为Br2,Br2将乙二醛氧化为乙醛酸,双极膜中间层中的H+在直流电场作用下移向阴极,OH-移向阳极,故D正确;KBr在上述电化学合成过程中除作电解质外,同时还是电解过程中阳极的反应物,生成的Br2为乙二醛制备乙醛酸的反应物,故A错误;
阳极上为Br-失去电子生成Br2,Br2将乙二醛氧化为乙醛酸,故B错误;电解过程中阴阳极均生成乙醛酸,1 ml乙二酸生成1 ml乙醛酸转移电子为2 ml,1 ml乙二醛生成1 ml乙醛酸转移电子为2 ml,根据转移电子守恒可知每生成1 ml乙醛酸转移电子为1 ml,因此制得2 ml 乙醛酸时,理论上外电路中迁移了2 ml电子,故C错误。
变式题1 为适应可再生能源的波动性和间歇性,我国科学家设计了一种电化学装置,其原理如图所示。当闭合K1和K3、打开K2时,装置处于蓄电状态;当打开K1和K3、闭合K2时,装置处于放电状态。放电时,双极膜中间层中的H2O解离为H+和OH-并分别向两侧迁移。下列有关该电化学装置工作时的说法不正确的是 ( )A.蓄电时,碳锰电极附近溶液pH减小B.蓄电时,图中右侧电解池发生的总反应为2ZnO 2Zn+O2↑C.放电时,每消耗1 ml MnO2,理论上有4 ml H+由双极膜向碳锰电极迁移D.理论上,该电化学装置运行过程中不需要补充H2SO4和KOH
[解析]蓄电时为电解池,Mn2+失电子生成MnO2,电极反应式为Mn2++2H2O-2e- =MnO2+4H+,溶液pH减小,A正确;蓄电时,右侧电解池中ZnO得电子生成Zn,OH-失电子生成O2,总反应为2ZnO 2Zn+O2↑,B正确;
探究点一 多池串联电化学装置及分析
1. 在如图所示串联装置中,通电片刻后发现乙装置左侧Pt电极表面出现红色固体,则下列说法不正确的是 ( )A.丙中Ag电极连接的是电源的正极B.向乙中加入适量的Cu(OH)2固体,一定能使溶液恢复到电解前的状态C.电解过程中丙中c(Ag+)无变化D.标准状况下当甲中产生4.48 L气体时,丙中Cu电极质量可能增加21.6 g
[解析]通电片刻后发现乙装置左侧Pt电极表面出现红色固体,则左侧Pt电极发生还原反应:Cu2++2e- =Cu,由串联装置可知,丙中Ag电极为阳极,连接的是电源的正极,A正确;乙池阴极的电极反应为Cu2++2e- =Cu,阳极电极反应为2H2O-4e- =4H++O2↑,电解后加入CuO,能使溶液恢复到电解前的状态,CuSO4溶液足量时加入Cu(OH)2固体不能恢复到电解前状态,B错误;
2. 利用膜技术原理和电化学原理制备少量硫酸和绿色硝化剂N2O5,装置如图所示,下列说法正确的是 ( )A.a电极和d电极上都发生氧化反应B.c电极上的电极反应式为N2O4-2e-+H2O =N2O5+2H+C.乙装置d极区溶液的pH增大D.电路中每转移2 ml e-,甲池质子膜右侧溶液质量变化为18 g
[解析]甲池中通入O2的一极为正极,即b电极为正极,则a电极为负极,d电极为阴极,氢离子在阴极得到电子发生还原反应生成氢气,A错误;与正极相连的c电极为电解池的阳极,在无水硝酸作用下,四氧化二氮在阳极失去电子发生氧化反应生成五氧化二氮和氢离子,电极反应式为N2O4+2HNO3-2e- =2N2O5+2H+,B错误;
3. MFC-电芬顿技术不需要外加能量即可发生,通过产生羟基自由基(·OH)处理有机污染物,可获得高效的废水净化效果,其耦合系统原理示意图如图所示。下列说法中错误的是 ( )A.标准状况下,乙池中消耗22.4 L O2时,可以产生2 ml·OHB.甲池是将化学能转化为电能的装置,其中a电极上发生氧化反应C.电子移动方向为a→Y,X→bD.乙池中生成羟基自由基的反应为Fe2++H2O2+H+ =Fe3++H2O+·OH
[解析]乙池中Y电极上的反应为O2+2H++2e- =H2O2,之后再发生反应H2O2+H++Fe2+ =Fe3++H2O+·OH, 当产生1 ml羟基自由基时,需要 1 ml H2O2,消耗1 ml的O2,标准状况下消耗22.4 L的O2,A错误;甲池为原电池,将化学能转化为电能,是燃料电池,b电极上氧气被还原,为正极,a电极为负极,发生氧化反应,B正确;
甲池为原电池,a电极为负极,b电极为正极,乙池为电解池,X电极为阳极,Y电极为阴极,串联装置中,电子由原电池负极流向电解池阴极,即a→Y,由电解池的阳极流向原电池正极,即X→b,C正确;乙池中生成羟基自由基的反应:H2O2+H++Fe2+ =Fe3++H2O+·OH,其中H2O2作氧化剂,亚铁离子作还原剂,D正确。
4.海水资源的开发利用是自然资源开发利用的重要组成部分。氯碱工业是高耗能产业,某化学学习小组设想将其与氢氧燃料电池相结合可以有效降低能耗,其原理如下(A、B、C、D为惰性电极)。下列说法正确的是 ( )A.乙池中C电极上的反应为H2-2e- =2H+B.乙池中Na+通过Na+交换膜向C电极移动C.甲池中每生成2 ml H2,乙池中便会消耗22.4 L O2D.甲池中发生的总反应为2NaCl+2H2O 2NaOH+Cl2↑+H2↑
[解析]通入氢气的一极为原电池的负极,通入氧气的一极为原电池的正极,则A为电解池的阳极,B为电解池的阴极,据此解答。乙池C处通入氢气,为原电池的负极,溶液为氢氧化钠溶液,故电极反应为H2-2e-+2OH- =2H2O,A错误;原电池中阳离子向正极移动,即钠离子通过钠离子交换膜向D极移动,B错误;
甲池中每生成2 ml H2,转移4 ml电子,乙池中便会消耗标准状况下22.4 L O2,题中未说明为标准状况,C错误;甲池为电解氯化钠溶液,电解方程式为2NaCl+2H2O 2NaOH+Cl2↑+H2↑,D正确。
5.某课题研究小组设计如图所示装置(电极材料均为Pt),该装置可将工业废水中的乙胺(CH3CH2NH2)转化为无毒无害物质。下列说法中错误的是 ( )A.电极N为电池的负极B.电池工作时,H+由N极区通过质子交换膜移动到M极区C.电极N的电极反应式为2CH3CH2NH2+8H2O-30e- =4CO2↑+N2↑+30H+D.当空气(氧气体积分数为20%)的进入量为7.5 ml时,可以处理含乙胺(质量分数为9%)的废水0.1 kg
探究点二 “多室”电化学装置及分析
[解析]含有乙胺的废水通入电极N区,空气通入电极M区,则电极N是电池的负极,电极M是正极,A正确;电池工作时,阳离子向正极移动,则H+由N极区通过质子交换膜移动到M极区,B正确;电极N上,CH3CH2NH2发生氧化反应转化为无毒无害物质,应生成N2和CO2,电极反应式为2CH3CH2NH2+8H2O-30e- =4CO2↑+N2↑+30H+,C正确;
6.某科研小组利用图所示装置完成乙炔转化为乙烯的同时为用电器供电。其中锌板处发生的反应有:①Zn-2e- =Zn2+;②Zn2++4OH- =[Zn(OH)4]2-;③[Zn(OH)4]2- =ZnO+2OH-+H2O。下列说法不正确的是 ( )A.电极a的电势高于电极b的电势B.放电过程中正极区KOH溶液浓度保持不变,OH-从左室流向右室C.电极a上发生的电极反应为C2H2+2H2O+2e- =C2H4+2OH-D.电解足量CuSO4溶液,理论上消耗2.24 L(标准状况)C2H2时,生成6.4 g Cu
[解析]在a电极,C2H2转化为C2H4,C元素由-1价降低到-2价,得电子发生还原反应,则该电极为正极;锌板b为负极。由分析可知,电极a为正极,电极b为负极,则电极a的电势高于电极b的电势,A正确;放电过程中,正极区发生反应C2H2+2H2O+2e- =C2H4+2OH-,OH-透过阴离子交换膜移向负极,正极区KOH的物质的量不变,但H2O参加电极反应,造成水量减少,KOH溶液浓度增大,B不正确;
7.双极膜(BP)是一种能将水分子解离成H+和OH-的特殊离子交换膜。应用双极膜制取聚合硫酸铁净水剂 [Fe2(OH)n(SO4)(3-0.5n)]m(PFS)的电化学装置如图所示。下列说法错误的是( )A.M为阴离子交换膜,乙为OH-B.电极a的电极反应式为2H++2e- =H2↑C.电流密度过大,会使PFS产品含量降低D.若制得1 ml [Fe(OH)SO4]3,理论上转移的电子为2 ml
相关课件
这是一份专题四 选择题专攻 4.电化学中的多室、多池装置 2024年高考化学二轮复习课件+讲义,文件包含专题四选择题专攻4电化学中的多室多池装置pptx、专题四选择题专攻4电化学中的多室多池装置教师版docx、专题四选择题专攻4电化学中的多室多池装置docx等3份课件配套教学资源,其中PPT共30页, 欢迎下载使用。
这是一份2024年高考化学一轮复习课件(鲁科版)第6章 第39讲 多池、多室的电化学装置,文件包含第6章第39讲多池多室的电化学装置pptx、第6章第39练多池多室的电化学装置docx、第6章第39讲多池多室的电化学装置docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
这是一份2024年高考化学一轮复习(新高考版) 第7章 第43讲 多池、多室的电化学装置,文件包含2024年高考化学一轮复习新高考版第7章第43讲多池多室的电化学装置pptx、2024年高考化学一轮复习新高考版第7章第43讲多池多室的电化学装置docx、第7章第43讲多池多室的电化学装置docx、第7章第43练多池多室的电化学装置docx等4份课件配套教学资源,其中PPT共60页, 欢迎下载使用。








