





2024届高中化学一轮复习课件:化学平衡 化学平衡常数
展开
这是一份2024届高中化学一轮复习课件:化学平衡 化学平衡常数,共3页。PPT课件主要包含了正反应,逆反应,逐渐减小,逐渐增大,保持不变,3化学平衡特点,正反应速率,逆反应速率,质量或浓度,①②③④⑥等内容,欢迎下载使用。
1. 可逆反应2.化学平衡状态(1)概念:在一定条件下的 反应中,当正、逆反应速率 时,反应物和生成物的浓度均保持不变,即体系的组成不随时间而改变,表明该反应中物质的转化达到了“限度”,这时的状态称之为化学平衡状态。
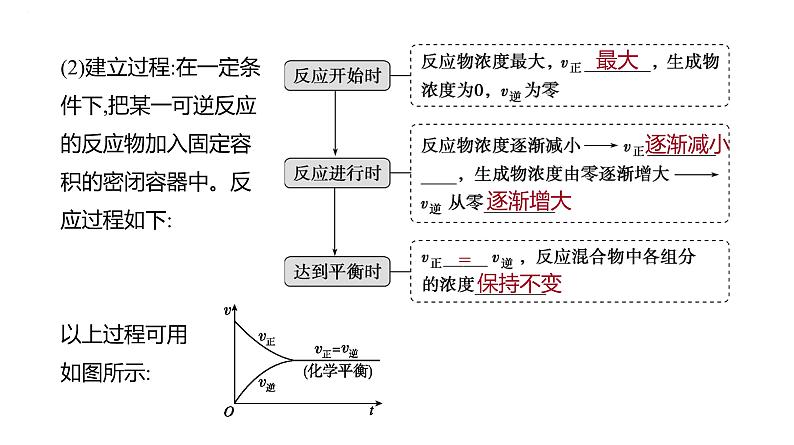
(2)建立过程:在一定条件下,把某一可逆反应的反应物加入固定容积的密闭容器中。反应过程如下:以上过程可用如图所示:
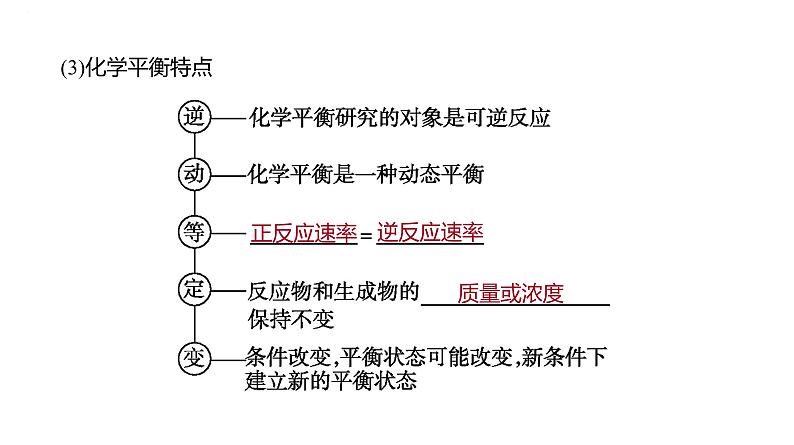
②静态标志(各种“量”不变)a.各物质的质量、物质的量或浓度不变。b.各物质的百分含量(物质的量分数、质量分数等)不变。c.温度(绝热容器)、压强(化学反应前后气体分子数不相等)或颜色(某组分有颜色)不变。总之,若物理量由变量变成了不变量,则表明该可逆反应达到平衡状态;若物理量恒为不变量,则不能作为平衡标志。
(2)对反应A(g)+B(g) ⇌C(g)+D(g),压强不随时间而变,说明反应已达到平衡状态( )
1.判断正误(正确的打“√”,错误的打“×”)(1)反应2NaHCO3 Na2CO3+CO2↑+H2O、Na2CO3+CO2+H2O =2NaHCO3互为可逆反应( )
[解析]两反应条件不同,不属于可逆反应,错误。
[解析]反应A(g)+B(g) ⇌C(g)+D(g)在反应前后气体的物质的量不变,故压强不随时间而变,错误。
[解析]可逆反应的反应物不能都转化为生成物,所以具有一定的限度。一个可逆反应达到的平衡状态就是这个反应在该条件下所能达到的限度,条件改变平衡可能会发生移动,其限度会发生变化,正确。
(3)在一恒温恒容的密闭容器中充入2 ml SO2、1 ml O2,一定条件下发生反应,在相同的容器中充入2 ml SO3,在相同条件下发生反应,二者最终达到平衡时,各组分的百分含量对应相同( )
(4)可逆反应都具有一定的限度,化学反应的限度可以通过改变反应条件而改变( )
[解析]根据等效平衡的建立条件,二者属于恒温恒容等量投料,建立的平衡等效,正确。
(5)在恒温恒压条件下,对于反应A(g)+B(g) ⇌2C(g)+D(g),当密度保持不变时,反应达到化学平衡状态 ( )(6)由2SO2(g)+O2(g) ⇌2SO3(g) ΔH=-196.6 kJ·ml-1知,2 ml SO2与1 ml O2在恒压密闭容器中充分反应,可放出196.6 kJ的热量( )
[解析] 2 ml SO2与1 ml O2并不能完全反应,放出的热量小于196.6 kJ。
2.在一个温度恒定、容积固定的密闭容器中,发生可逆反应mA(s)+nB(g) ⇌pC(g)+qD(g),已知m+n=p+q,且该反应为放热反应,反应达到平衡的标志是 。 ①体系的压强不再改变②气体的密度不再改变③各气体的浓度不再改变④各气体的质量分数不再改变⑤反应速率v(C)∶v(D)=p∶q⑥单位时间内n ml B断键反应,同时p ml C也断键反应
1.下列对可逆反应的认识正确的是 ( )A.NH4Cl NH3↑+HCl↑与NH3+HCl =NH4Cl互为可逆反应B.既能向正反应方向进行,又能向逆反应方向进行的反应叫作可逆反应C.在同一条件下,同时向正、逆两个方向进行的反应叫作可逆反应D.对于可逆反应N2+3H2 ⇌2NH3,增加反应物中N2的比例,可使H2完全转化为NH3
[解析]可逆反应的特征是“两同”——同时、同条件和“一不能”——不能完全转化。A项中两个反应的条件不同,A错误;B项不具备同时、同条件的特征,B错误;可逆反应中不管反应物比例如何,反应物不可能完全转化为生成物,D错误。
2. 16 mL由NO与NH3组成的混合气体在催化剂作用下于400 ℃左右可发生反应:6NO+4NH3 ⇌5N2+6H2O(g),达到平衡时在相同条件下气体体积变为17.5 mL,则原混合气体中NO与NH3的物质的量之比有四种情况:①5∶3、②3∶2、③4∶3、④9∶7。其中正确的是( )A.②③B.③④C.①②D.①④
[解析] 6NO+4NH3 ⇌5N2+6H2O(g) ΔV增大 6 4 5 6 1 9 mL 6 mL 7.5 mL 9 mL (17.5-16) mL=1.5 mL反应后NO和NH3的混合气体中剩余的气体体积为16 mL-9 mL-6 mL=1 mL;若剩余NO,则原混合气体中NO体积为9 mL+1 mL=10 mL,NH3的体积为6 mL,在
原混合气体中NO和NH3的物质的量之比为10 mL∶6 mL=5∶3;若剩余NH3,则原混合气体中NH3的体积为6 mL+1 mL=7 mL,NO为9 mL,在原混合气体中NO和NH3的物质的量之比为9 mL∶7 mL=9∶7;此反应为可逆反应,不可能进行完全,所以比值应处于①④之间。
[方法点拨] “一边倒”法判断可逆反应中物质的浓度取值(1)完全转化到“ ⇌”的右侧,求出生成物的最大值,反应物的最小值,此时反应物可能为0,也可能不为0。(2)完全转化到“⇌”的左侧,求出反应物的最大值,生成物的最小值。(3)据(1)(2)得出各物质的浓度的取值范围进行讨论。
题组二 化学平衡状态的判断
1.一定温度下,反应N2O4(g) ⇌2NO2(g)的焓变为ΔH。现将1 ml N2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是 ( )A.①②B.②④C.③④D.①④
反应开始时,加入1 ml N2O4,随着反应的进行,N2O4的浓度逐渐变小,故v正(N2O4)逐渐变小,直至达到平衡,③不符合题意;N2O4的转化率逐渐增大,不再变化时说明N2O4的浓度不再变化,反应达到平衡状态,④符合题意。
2.将一定量纯净的氨基甲酸铵置于密闭真空容器中(假设容器容积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:H2NCOONH4(s) ⇌2NH3(g)+CO2(g)。①v(NH3)=2v(CO2)②密闭容器中总压强不变 ③密闭容器中混合气体的密度不变 ④密闭容器中氨的体积分数不变 ⑤密闭容器中c(NH3)不变 ⑥密闭容器中混合气体的平均相对分子质量不变能判断该反应已经达到平衡状态的是 ( )A.②③⑤B.②③⑤⑥C.①④⑤⑥D.②③④
[解析]平衡时正、逆反应速率相等,但该项没有指明是正反应速率,还是逆反应速率,故①不选;该正反应是气体分子数增多的反应,所以未平衡时容器内压强会发生变化,当压强不变时说明反应达到平衡,故②选;反应物为固体,则未平衡时气体的质量发生变化,容器恒容,所以混合气体的密度会发生变化,当密度不变时说明反应达到平衡,故③选;初始投料只有H2NCOONH4固体,所以NH3(g)、CO2(g)的体积之比始终是2∶1,因此密闭容器中氨的体积分数始终不变,不能说明反应达到平衡,故④不选;反应达到平衡时各物质的浓度不再改变,所以密闭容器中c(NH3)不变可以说明反应达到平衡,故⑤选;容器内始终为物质的量之比为2∶1的NH3和CO2的混合气体,平均相对分子质量为定值,故⑥不选。
[方法技巧] 判断化学平衡状态的两方法和两标志1.两方法——逆向相等、变量不变(1)逆向相等:反应速率必须一个是正反应的速率,一个是逆反应的速率,且经过换算后同一种物质的减少速率和生成速率相等。(2)变量不变:如果一个量是随反应进行而改变的,当不变时为平衡状态;一个随反应的进行保持不变的量,不能作为是否达到平衡状态的判断依据。2.两标志——本质标志、等价标志(1)本质标志:v正=v逆≠0。对于某一可逆反应来说,正反应消耗掉某反应物的速率等于逆反应生成该反应物的速率。
(2)等价标志①全部是气体参加的非等体积反应,体系的压强、平均相对分子质量不再随时间变化。例如,N2(g)+3H2(g) ⇌2NH3(g)。②体系中各组分的物质的量浓度、体积分数、物质的量(或质量)分数保持不变。③对同一物质而言,断裂的化学键的物质的量与形成的化学键的物质的量相等。④对于有色物质参加或生成的可逆反应,体系的颜色不再随时间变化。例如,2NO2(g) ⇌N2O4(g)。⑤体系中某反应物的转化率或某生成物的产率达到最大值且不再随时间变化。⑥绝热体系的温度不变,说明反应处于平衡状态。
1.化学平衡常数(1)概念在一定 下,一个可逆反应达到化学平衡时,生成物 与反应物 的比值是一个常数,用符号K表示。 (2)表达式对于一般的可逆反应mA(g)+nB(g)⇌ pC(g)+qD(g),在一定温度下达到平衡时:浓度平衡常数K= ;压强平衡常数Kp= 。(固体和纯液体的浓度视为常数,不用注明)
(3)意义及影响因素[微点拨] ①K只受温度影响,与反应物或生成物的浓度变化无关。②K值的大小只能预示某可逆反应向某方向进行的最大限度,不能预示反应达到平衡所需要的时间。
(5)应用①利用化学平衡常数,判断反应是否达到平衡或向何方向进行。对于化学反应mA(g)+nB(g) ⇌pC(g)+qD(g)的任意状态,浓度商Q= 。 QK,反应向 反应方向进行。 ②利用K可判断反应的热效应:若升高温度,K值增大,则正反应为 ;若升高温度,K值减小,则正反应为 。
(3)可逆反应若有水反应或生成,平衡常数表达式中均不写水的浓度( )
1.判断正误(正确的打“√”,错误的打“×”)(1)对于反应2SO2(g)+O2(g) ⇌2SO3(g),升高温度,K值减小,则ΔH丙>丁C.乙=甲>丁=丙D.丁>丙>乙>甲
[解析]将四种情况的生成物通过极限转换法转换为反应物进行比较:甲、丙两实验为等效平衡,乙、丁两实验为等效平衡,相较于甲和丙,乙和丁相当于增大了反应物CO2的初始量,平衡向正反应方向移动,n(CO)增大,故n(CO):乙=丁>甲=丙。
2.初始温度为t ℃,向三个密闭的容器中按不同方式投入反应物,发生反应:4HCl (g) +O2(g) ⇌2Cl2(g)+2H2O(g) ΔH=-116 kJ·ml-1,测得反应的相关数据如下:下列说法正确的是 ( )A.反应4HCl(g)+O2(g) ⇌ 2Cl2(g)+2H2O(l)的ΔH>-116 kJ·ml-1B.a>1,b>2C.p2=1.6×105 Pa, p3=4×105 PaD.若起始向容器Ⅰ中充入0.5 ml HCl、0.5 ml O2、0.5 ml Cl2和0.5 ml H2O(g),则反应向正反应方向进行
[解析]三个容器中,Ⅰ与Ⅱ均为恒容容器,差别在于前者恒温,后者绝热;不妨设想容器Ⅳ,其与容器Ⅰ类型相同,仅投料方式按照容器Ⅱ中的投料方式进行,那么容器Ⅳ中的平衡与Ⅰ中的等效,容器Ⅳ中的反应达到平衡时,Cl2的物质的量为1 ml。容器Ⅲ相比于容器Ⅰ,容积扩大了一倍,初始投料也增加了一倍,但容器Ⅲ是在恒温恒压的条件下反应的;不妨设想容器Ⅴ,其与容器Ⅲ的其他的条件相同,仅容器类型更改为恒温恒容的容器,那么容器Ⅴ中的平衡状态与Ⅰ中的等效,容器Ⅴ中的反应达到平衡时,Cl2的物质的量为2 ml。
生成液态水相比于生成气态水,同等条件下放出的热量更多,放热越多反应的ΔH越小,因此反应4HCl(g)+O2(g) ⇌2Cl2(g)+2H2O(l)的ΔH1;构造的容器Ⅴ的类型为恒温恒容条件下,加入8 ml HCl、2 ml O2,容器Ⅲ的类型为恒温恒压,
相关课件
这是一份2024届高中化学一轮复习课件:平衡思想——化学平衡常数K、Kp的计算,共3页。PPT课件主要包含了信息解读,p1p2p3等内容,欢迎下载使用。
这是一份人教版高考化学一轮复习7.3化学平衡常数课件
这是一份高中化学第二单元 化学反应的方向与限度多媒体教学课件ppt,共14页。PPT课件主要包含了学习目标,课堂探究,对于如下可逆反应,观察思考,K1K22,学以致用,课堂练习等内容,欢迎下载使用。








