所属成套资源:人教版高中化学选择性必修二精品同步讲义 (精讲精练)(含解析)
化学选择性必修2第一节 原子结构精品课时练习
展开
这是一份化学选择性必修2第一节 原子结构精品课时练习,共16页。试卷主要包含了构造原理与元素周期表,微粒半径大小比较,电离能与电负性,原子结构的综合运用等内容,欢迎下载使用。
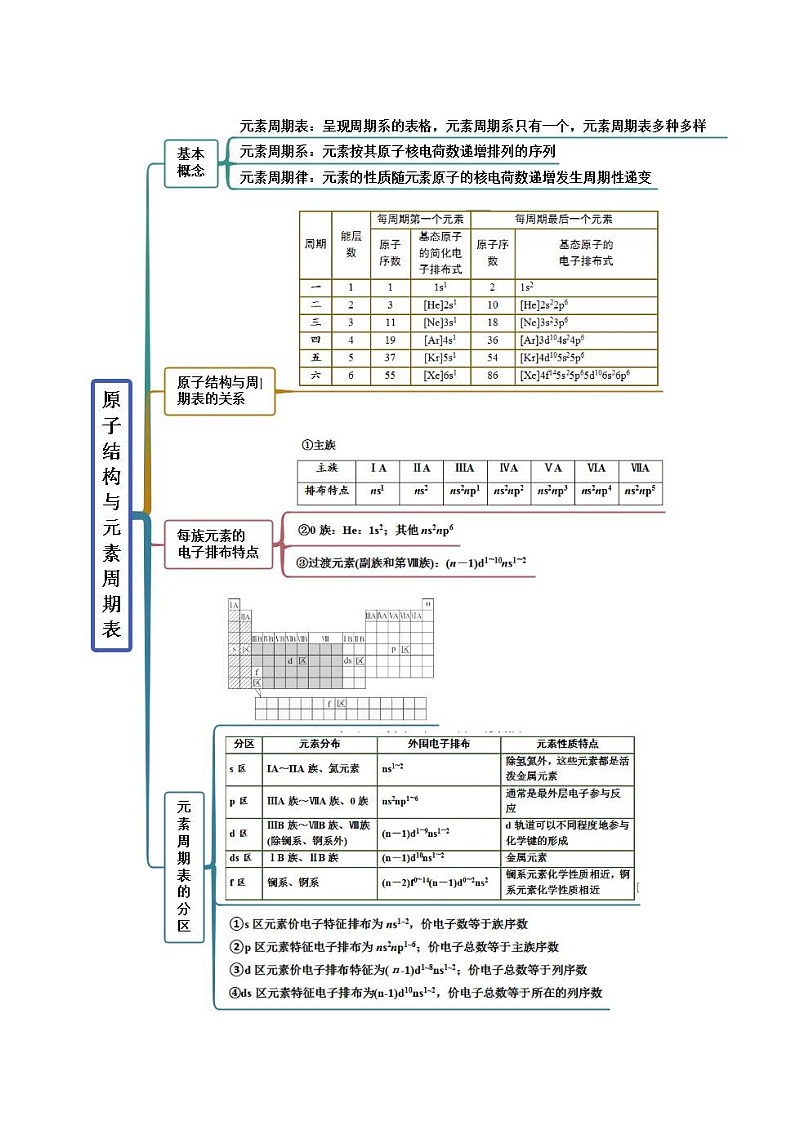
考点一 构造原理与元素周期表
【例1-1】(2022春·北京丰台·高二北京十八中校考期末)下列说法中,正确的是
A.s区元素全部是金属元素
B.p能级电子能量一定高于s能级电子能量
C. SKIPIF 1 < 0 属于p区主族元素
D.第VIIA族元素从上到下,非金属性依次增强
【答案】C
【解析】A.s区元素不一定是金属元素,还有非金属氢,故A错误;
B.p能级电子能量不一定高于s能级电子能量,如2p能级电子的能量小于3s能级的能量,故B错误;
C. SKIPIF 1 < 0 是第ⅥA族元素,属于p区主族元素,故C正确;
D.同主族元素从上到下,原子半径递增,核对最外层电子吸引能力逐渐减弱,则金属性逐渐增强、非金属性逐渐减弱,故D错误;
故选C。
【例1-2】(2022黑龙江)已知某元素+2价离子的核外电子排布式为 SKIPIF 1 < 0 ,则该元素在元素周期表中的位置及所属分区是
A.第四周期Ⅷ族,p区B.第六周期ⅤB族,d区
C.第四周期ⅠB族, SKIPIF 1 < 0 区D.第四周期ⅤB族,f区
【答案】C
【解析】由题意可知,该元素+2价离子的核外有27个电子,则该元素原子核外有29个电子,即该元素是 SKIPIF 1 < 0 ,位于第四周期ⅠB族,属于 SKIPIF 1 < 0 区,C符合题意;答案选C。
【一隅三反】
1.(2022西藏)下列有关元素周期表分区的说法错误的是
A.p区不包含副族元素B.第五周期有15种f区元素
C.d区、ds区均不存在非金属元素D.s区所有元素的p能级电子均为全满或全空状态
【答案】B
【解析】A.p区是最后一个电子填充到p能级上(He除外),包括ⅡA至0族,不包括副族元素,故A说法正确;
B.f区指的是镧系和锕系,镧系和锕系在第六、七周期的ⅢB,第五周期不含有f区,故B说法错误;
C.d区和ds区包括过渡元素,过渡元素都是金属元素,故C说法正确;
D.s区的价电子构型为ns1~2,s区所有元素的p能级电子均为全满或全空状态,故D说法正确;答案为B。
2.(2022·海南)下列元素属于 SKIPIF 1 < 0 区元素的是
A. SKIPIF 1 < 0 B. SKIPIF 1 < 0 C. SKIPIF 1 < 0 D. SKIPIF 1 < 0
【答案】D
【解析】A.Fe属于第VIII族,为d区,故A不选;
B.Mg的最外层电子排布为3s2,属于s区,故B不选;
C.Br的最外层电子排布为4s24p5,属于p区,故C不选;
D.Cu属于IB族,属于 SKIPIF 1 < 0 区,故D选;
答案选D。
3.(2022·山西)元素周期表中,有非金属元素的区域为()
A.只有s区B.只有p区C.s区、d区和ds区D.s区和p区
【答案】D
【解析】s区包含ⅠA族、ⅡA族元素,除氢元素外均为金属元素;p区包含零族元素、ⅢA~ⅦA元素,含有金属元素与非金属性元素;d区、ds区,全部为金属元素;f区为镧系元素和锕系元素,全部为金属元素,故答案为D。
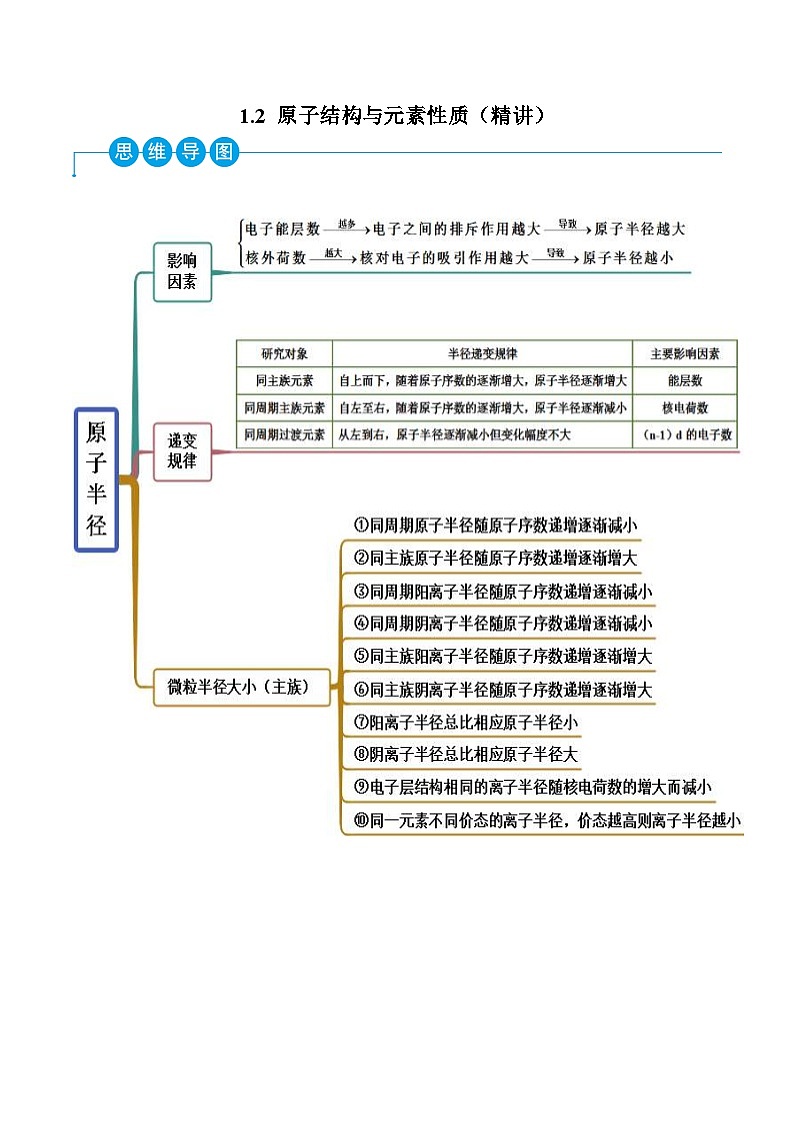
考点二 微粒半径大小比较
【例2】(2022上海)下列微粒半径的大小关系,不正确的是( )
A.Na>Be>C>FB.S2﹣>S>O>F
C.S2﹣>Cl﹣>K+>Ca2+D.Cl>Li>N>He
【答案】D
【解析】A.钠的电子层最多,原子半径最大,Be、C、F的电子层相同,核电荷数Be<C<F,则原子半径Be>C>F,所以原子半径大小为:Na>Be>C>F,故A正确;
B.S2﹣、S的电子层相同,硫离子的核外电子总数大于S,则其比较S2﹣>S;O、F的电子层相同,核电荷数F>O,则原子半径F<O,其粒子半径大小为:S2﹣>S>O>F,故B正确;
C.电子层结构相同的离子,随核电荷数增大,离子半径依次减小,S2﹣、Cl﹣、K+、Ca2+的电子层相同,核电荷数依次增大,则离子半径大小为:S2﹣>Cl﹣>K+>Ca2+,故C正确;
D.由教材原子半径示意图可知,稀有气体He的原子半径大于N的原子半径,故D错误;
答案选D。
【一隅三反】
1.(2022秋·高二单元测试)下列关于粒子半径大小关系的判断不正确的是
①r(Li+)②>④>③B.最高正化合价:③>①>②>④
C.电负性:③>①>②>④D.第一电离能:③>②>④>①
【答案】C
【解析】A.同周期自左而右原子半径减小,所以原子半径Si>P>S,电子层越多原子半径越大,所以原子半径F最小,故原子半径Si>P>S>F,即④>②>①>③,故A错误;
B.最高正化合价等于最外层电子数,但F元素没有正化合价,所以最高正化合价为①>②>④,故B错误;
C.同周期自左而右电负性增大,所以电负性Si < P< S < Cl,同主族从上到下电负性减弱,所以电负性F> Cl,故电负性Si < P< S< F,即④Tl,故A错误;
B.根据元素周期律,同主族元素原子半径从上到下依次增大,所以原子半径:Tl>Al,故B错误;
C.金属性越强,最高价氧化物对应水化物的碱性越强,金属性:Al>Tl,所以碱性: SKIPIF 1 < 0 ,故C正确;
D.因为还原性:Al>Tl,所有氧化性: SKIPIF 1 < 0 ,故D正确;
故答案为:CD;
(3)A. Tl 与 Al 同族,即 Tl 在 ⅢA 族,其原子最外层有3个电子,+1价阳离子为Tl失去6s轨道上的一个电子形成, SKIPIF 1 < 0 最外层有2个电子,即 SKIPIF 1 < 0 最外层有2个电子,故A错误;
B.T1在Ⅲ A 族,其最高正化合价为+3价,从 SKIPIF 1 < 0 来看T1元素有+1价,则T1能形成+3价和+1价的化合物,故B正确;
C.根据氧化还原反应规律,氧化性:氧化剂>氧化产物,由 SKIPIF 1 < 0 可知, SKIPIF 1 < 0 能将 Ag 氧化,而 SKIPIF 1 < 0 为氧化产物, SKIPIF 1 < 0 为氧化剂,所以氧化性: SKIPIF 1 < 0 ,故C错误;
D.根据氧化还原反应规律,还原性:还原剂>还原产物,由 SKIPIF 1 < 0 可知, Ag能将 SKIPIF 1 < 0 还原,而 SKIPIF 1 < 0 为还原产物,Ag为还原剂,所以还原性: SKIPIF 1 < 0 ,故D错误;
故答案为:B;
(4)一般而言,根据元素周期律,同周期元素从左到右,电负性依次增强,同主族从上到下依次减弱;结合表中提供的信息,a为Cl元素,b为S元素,c为P元素,d为Al元素,e为Na元素;
①a为Cl元素,原子序数为17,最外层7个电子,价层电子轨道表示式为;
故答案为:;
②一般而言,根据元素周期律,同周期元素从左到右,电负性依次增强,同主族从上到下依次减弱;c为P元素,其电负性X的取值范围为 SKIPIF 1 < 0 ;
故答案为:1.5;2.5;
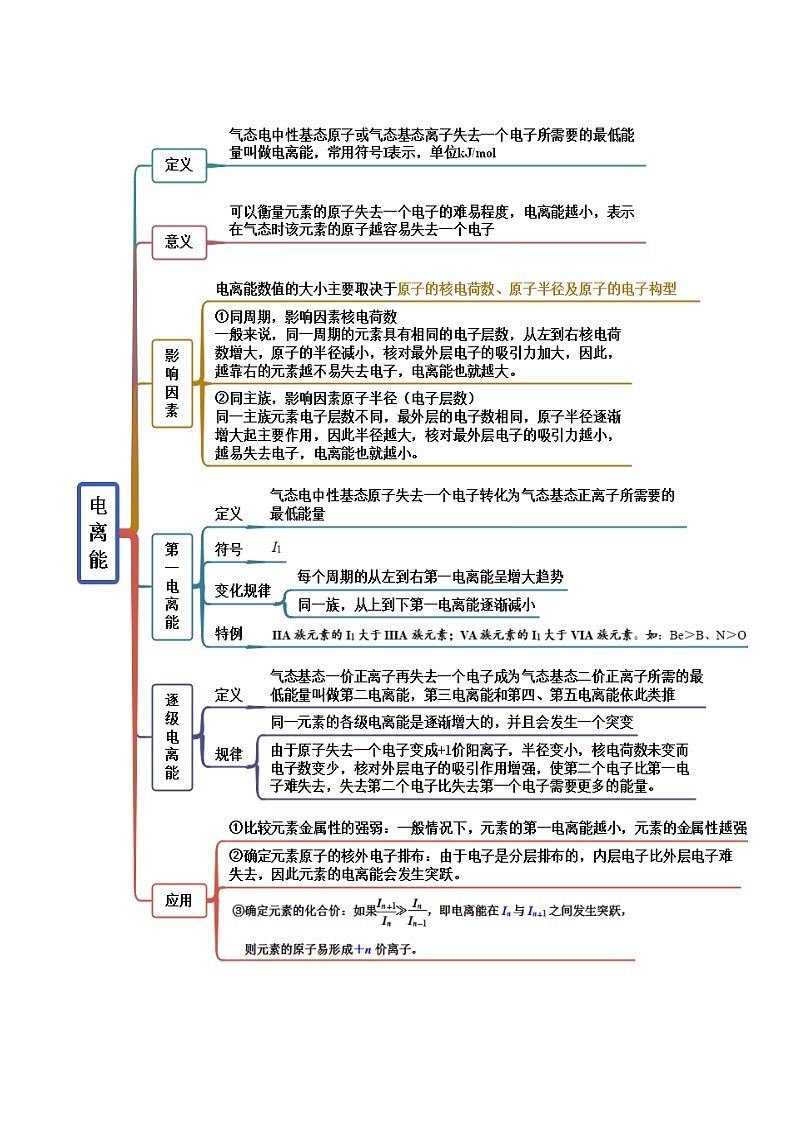
③一般而言,根据元素周期律,同周期元素从左到右,第一电离能依次增大,同主族从上到下依次减小,但是第ⅡA族因s轨道全充满,第一电离能比第ⅢA族大;第ⅤA族p轨道半充满,第一电离能比第ⅥA族大,所以以上几种元素的第一电离能大小为: SKIPIF 1 < 0 ;
故答案为:P;
(5)①Ti元素原子序数22,核外电子数22,电子排布式为 SKIPIF 1 < 0 ;
故答案为: SKIPIF 1 < 0 ;
②Fe元素原子序数26,基态 SKIPIF 1 < 0 价电子轨道式为,未成对电子数为5;基态 SKIPIF 1 < 0 价电子轨道式为,未成对电子数为4;所以基态 SKIPIF 1 < 0 、 SKIPIF 1 < 0 离子中未成对的电子数之比为 SKIPIF 1 < 0 ;
故答案为: SKIPIF 1 < 0 ;
③Li为第二周期第IA族元素,属于s区元素;
故答案为s。
元素编号
a
b
c
d
e
电负性
3.0
2.5
X
1.5
0.9
主要化合价
-1,+7
-2,+6
-3,+5
+3
+1
相关试卷
这是一份化学人教版 (2019)第二节 氮及其化合物练习,文件包含三角函数及解三角形大题专题练习卷参考答案doc、三角函数及解三角形专题卷docx等2份试卷配套教学资源,其中试卷共21页, 欢迎下载使用。
这是一份高中人教版 (2019)第二节 分子的空间结构精品同步练习题,共13页。试卷主要包含了孤电子对的计算,价层电子互斥模型及其应用,综合运用等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修2第一节 共价键精品课时训练,共13页。试卷主要包含了共价键的形成与特征,共价键的类型,键参数及其应用,综合运用等内容,欢迎下载使用。











